640层容积CT双低剂量肾透明细胞癌动态灌注成像的应用
2019-06-17齐燕刘玉品黄汝杭李松娜黄丽霞李龙张立军冷蓉
齐燕,刘玉品,黄汝杭,李松娜,黄丽霞,李龙,张立军,冷蓉
广州中医药大学第二附属医院 影像科,广东 广州 510006
引言
近年来随着体检人数的增加,肾透明细胞癌的检出率不断上升。手术切除是目前治疗肾透明细胞癌的主要选择。肿瘤病理分级对治疗方案的选择有重要价值[1],亦是判断临床预后的重要指标[2]。部分病理分级低的病灶可以选择保留肾单位的肾部分切除术,既能获得较好的治疗疗效,又可以降低术后并发症的发生率。因此术前如何无创准确预测病理分级已成为临床的迫切需求。本研究旨在探讨640层容积CT双低剂量动态灌注成像定量指标对肾透明细胞病理分级的预测价值,以期为肾透明细胞癌的术前分级提供量化的评估方法。
1 资料与方法
1.1 一般资料
回顾性分析我院2013年8月至2017年8月53例临床资料完整、经手术证实为肾透明细胞癌患者的双肾CT灌注资料。其中女18例,男35例,年龄30~85岁,平均年龄(51±16)岁,身高147~178 cm,平均身高(163±7)cm,体重 45~86 kg,平均体重(63±11)kg。按病理分级(Fuhrman分级)分为I级8例,II级22例,III级15例,IV级8例,其中I、II级为低级别组、III、IV级为高级别组。所有患者均签署CT检查知情同意书。
1.2 方法
采用东芝Aquilion ONE 640层CT机。低剂量灌注模式。扫描条件 :电压 100 kV,电流 60 mA 或 100 mA(其中 20、22、32、35 s为 100 mA,其余各期均为 60 mA),球管旋转时间 0.5 s,矩阵 512×512。间隔 2~3 s采集 1 次(曝光 0.5 s,间隔 1.5~2.5 s),共采集 24 次,扫描时间 72 s。层厚 5 mm,层间距5 mm。探测器宽度160 mm,不动床单次扫描完全覆盖双侧肾脏。同时采用AIDR 3D重建技术。低对比剂用量,采用双筒高压注射器(美国拜耳MEDRAD)经肘静脉注入非离子型对比剂(碘比乐,370 mgI/mL)48 mL,生理盐水30 mL,注射速度为6 mL/s。选择患者肘关节处静脉入药,同时启动高压注射器及CT机扫描按键,CT机自动连续扫描。
1.3 图像处理
所得24个灌注数据包,使用Body Registration软件进行自动对位,所得数据利用Body perfusion灌注软件,采用patlak 软件获得等效血容量(Equivalent Blood Volume, Equiv BV)和清除率,清除率的值乘以6转换成表面渗透性(Surface,PS);采用最大斜率软件获得血流量 (Blood Flow,BF)。选择横轴位瘤体最大层面,手动绘制ROI,避开囊变坏死,多次取其平均值,如图1~2。利用100 mA图像观察肿瘤坏死、血供及肾盂肾盏破坏等CT征象,在肿瘤最大层面测量肿瘤直径。
1.4 辐射剂量
灌注成像辐射剂量为15.06 mSv,剂量转换因子k=0.015 mSv ·mGy-1·cm-1。
1.5 统计学分析
采用SPSS 17.0统计学软件进行数据分析。计量资料用均数±标准差()表示。不同病理分级的CT灌注参数比较,采用方差分析,两两比较采用LSD法,绘制ROC曲线,计算曲线下面积(AUC),分析各指标的诊断效能,并选择最佳临界值;采用 Pearson 相关分析法对CT灌注参数及CT特征与肿瘤病理分级行相关性分析。P<0.05表示差异具有统计学意义。

图1 Fuhrman II级左肾透明细胞癌影像图片

图2 Fuhrman III级左肾透明细胞癌影像学图片
2 结果
2.1 不同病理分级透明细胞癌CT灌注定量指标
除I级与II级Ps值、III级与IV级Equiv BV、BF值之间差异无统计学意义外(P=0.073、0.055、0.727),其余参数之间存在统计学差异(P<0.05)。Equiv BV、Ps、BF灌注值与病理分级呈显著负相关(r=0.628、0.637、489,P=0.000、0.000、0.000)。各灌注参数值见表1。
表1 透明细胞癌不同病理分级各灌注参数比较 ()
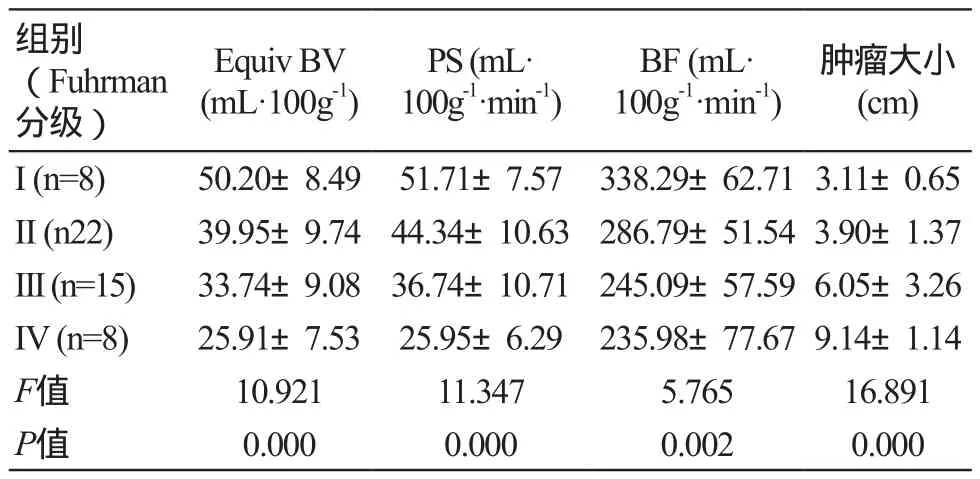
表1 透明细胞癌不同病理分级各灌注参数比较 ()
注:等效血容量(Equiv BV),表面渗透性(PS),血流量(BF)。I级与II级之间PS值、肿瘤大小差异无统计学意义;III级与IV级之间Equiv BV值、BF值差异无统计学意义。
肿瘤大小(cm)I (n=8) 50.20±8.49 51.71±7.57 338.29±62.713.11±0.65 II (n22) 39.95±9.74 44.34±10.63286.79±51.543.90±1.37 III (n=15) 33.74±9.08 36.74±10.71245.09±57.596.05±3.26 IV (n=8) 25.91±7.53 25.95±6.29 235.98±77.679.14±1.14 F值 10.921 11.347 5.765 16.891 P值 0.000 0.000 0.002 0.000组别(Fuhrman分级)Equiv BV(mL·100g-1)PS (mL·100g-1·min-1)BF (mL·100g-1·min-1)
2.2 ROC曲线评估CT各灌注指标的诊断效能
高级别组(III、IV级)的Equiv BV、PS、BF值明显低于低级别组(I、II级),差异有统计学意义(P<0.05)。结果见表2。Equiv BV、PS、BF值的ROC曲线下面积(AUC)分别为 0.791、0.829 和 0.770。以 PS 值 37.35(mL·100g-1·min-1)作为诊断阈值,诊断效能最高,判断病理分级的敏感性为80.0%,特异性为78.0%。ROC曲线见图3a。
表2 低高组别透明细胞癌CT灌注参数比较()

表2 低高组别透明细胞癌CT灌注参数比较()
组别(Fuhrman 分级)Equiv BV(mL·100g-1)PS(mL·100g-1·min-1)BF (mL·100g-1·min-1)肿瘤大小(mm)低级别(n=30) 42.69±10.3646.30±10.33300.52±58.3936.9±12.6高级别(n=23) 31.02±9.2232.99±10.64241.92±63.6471.3±30.7 F值 18.122 21.087 12.131 22.279 P值 0.000 0.000 0.001 0.000

图3 ROC曲线
2.3 不同病理分级透明细胞癌常规CT特征
53例肾透明细胞癌患者,肿瘤大小为2~14 cm,平均(6.7±2.3)cm,I、II级之间无差异,其余各级之间存在差异(P<0.05)。肿瘤大小与病理分级呈显著正相关(r=0.686,P=0.000),见表1。肿瘤大小的ROC曲线下面积(AUC)为0.827。以肿瘤大小为4.35 cm作为区分高、低级别肿瘤的最佳阈值,其敏感性为78.3%,特异性为86.7%,见图3b。41例患者见坏死,肿瘤内见低密度区;19例患者侵犯肾盂肾盏,表现为肾盂肾盏破坏、延迟期见充盈缺损;45例患者可见肿瘤供血动脉,表现为肾动脉分支增粗,供应肿瘤,图4;22例患者可见肿瘤引流静脉,表现为肾静脉分支增粗,部分迂曲。高级别组肿瘤坏死、肿瘤血管及肾盂肾盏破坏的发生率均高于低级别组。其中肾盂肾盏侵犯在高低组别之间存在统计学差异(P<0.05)。

图4 Fuhrman II级左肾透明细胞癌4D重建及CTA图像
3 讨论
肾透明细胞癌的病理分级是判断肿瘤恶性程度、预测肿瘤侵袭性和潜在转移的重要指标,对肾癌的预后判断有重要的指导意义[3-6]。因此,如果能够通过术前肾脏灌注CT成像预测肾透明细胞癌的Fuhrman 病理分级,对手术方式和治疗方案的选择有重要的临床意义。
CT灌注成像是集合解剖和功能的成像技术,可以完成器官的“一站式”评估。有研究认为肾脏CT灌注成像可以显示肾脏动静脉解剖及变异,评估肾脏功能,预测肾脏肿瘤的病理类型[7-13]。但CT灌注成像存在辐射剂量较高等不足。Chen等[13]、刘静红等[14]研究采用宽体探测器CT进行肾脏灌注检查,其有效辐射剂量为18.5 mSv和(23.10±4.39)mSv。而常规肾脏多期CT增强亦存在对比剂用量较大的问题。鲍光进等[15]、杨保智等[16]关于肾脏动脉CT成像及肾透明细胞癌CT增强特征的研究中,其对比剂用量均大于80 mL。本研究采用优化CT灌注扫描方案,在降低管电压及管电流的同时采用AIDR 3D重建技术,明显降低辐射剂量(15.06 mSv)。本研究同时降低了对比剂用量(48 mL),且在8 s内快速注射完对比剂,既可以保证灌注值的准确性,同时可以降低对比剂引起的急性肾损伤。
本研究总结肾透明细胞癌的常规CT影像特征为:肿瘤血供丰富,可见肿瘤血管及肿瘤周边细小迂曲新生血管。肿瘤坏死发生率较高(77.4%),高级别组肿瘤坏死发生率高于低级别组,与裴子璐等[17]、Oh等[18]、Chen等[19]研究认为肿瘤坏死与病理分级关系密切的结果相一致。本研究认为肿瘤大小与病理分级呈正相关。肿瘤直径大于4.35 cm可作为预测低高组别肾透明细胞癌的最佳临界值。Chen等[20]研究及Oh等[18]研究结果显示高级别组肿瘤直径大于低级别组,区分低高组别肿瘤直径最佳临界值分别为5 cm及3.6 cm,本研究结果与上述结果相似。Maruyama等[21]研究显示低高组别肿瘤直径分别为(48.5±21.3)mm、(84.5±39.3)mm,本研究结果显示低高组别肿瘤直径分别为(36.9±12.6)mm、(71.3±30.7)mm,与上述研究结果相近。本研究认为高级别组肾盂肾盏侵犯发生率高,分析其原因可能为高级别组肿瘤体积大、浸润性强,周围结构受压明显所致。
本研究总结肾透明细胞癌的CT灌注特征为:肿瘤灌注不均匀,边缘呈高灌注,中心灌注减低,坏死区呈明显低灌注。高灌注区Equiv BV、PS、BF仍低于正常肾皮质。肾透明细胞癌CT征象与病理分级的研究发现,高级别组肾透明细胞癌CT密度不均匀多于低级别组[17-19]。本研究认为高级别组灌注不均匀明显多于低级别组,与其结论相同。肿瘤内部的不均质成份是导致肿瘤的密度及灌注不均匀的原因,同时也预示着肿瘤的病理分级较高。这种不均质成份在常规CT图像上显示有限,但CT灌注图像能够清晰显示其不均质成分的范围及位置。本研究对CT灌注参数值与病理分级行相关性分析,结果显示Equiv BV、PS、BF值与病理分级呈显著负相关(P<0.05)。其中PS值对病理级别的诊断效能最高,当临界值为37.35 mL·100g-1·min-1时,其敏感性及特异性均较高。Chen等[20]、Reiner等[22]研究认为PS值与肿瘤病理分级呈负相关。本研究结果与其结论相同。其原因可能为PS值可以反映肿瘤内微血管密度(MVD)。而MVD与肿瘤的恶性程度密切相关,肿瘤的恶性程度越高,凝固性坏死成份越多,微血管密度越低。Chen等[20]研究结果显示PS值的最佳临界值为71.63 mL·100g-1·min-1,本研究PS值与其结果相差较多。分析其原因可能为,本研究ROI的勾画与该研究存在一定的偏差。Chen等[20]研究ROI勾画病灶肿瘤实性成分(避开坏死),而本研究ROI勾画包含一些低灌注区域,(仅有少量血流,但未坏死),这可能造成本研究结果数值偏低。
除此之外,本研究尚存在一些不足之处。本研究样本量小,为单中心研究,结果会存在一定差异,今后将扩大样本量,选取多中心研究,以排除相关干扰因素,提高诊断的准确性。总之,640层容积CT双低剂量动态灌注成像能够为术前准确诊断肾透明细胞癌及预测其病理分级提供定量的影像学数据,具有一定的临床应用价值。
