线粒体抗氧化对神经病理性疼痛大鼠TRPV1表达的影响
2019-06-12孙玉红
孙玉红,李 锐,张 野
神经病理性疼痛(neuropathic pain, NP)是损伤或疾病累及包括外周和中枢水平在内的躯体感觉系统的结果。 NP两种主要突出特征是痛觉过敏和自发疼痛。NP起因广泛,病理生理机制复杂,常规阿片类药物或非甾体抗炎药治疗效果均不理想[1]。前期研究[2]显示线粒体靶向抗氧化剂能有效缓解大鼠的疼痛行为,与减轻氧化应激水平,改善线粒体功能有关,但具体机制仍不明确。瞬时感受器电位香草酸受体1(transient receptor potential cation channel,subfamily V, member 1,TRPV1)是瞬时感受器电位(transient receptor potential, TRP)超家族成员之一,主要表达在初级传入感觉神经元上,与痛觉传递与调制密切相关。激活的TRPV1可以介导P物质等释放产生痛觉[3]。该研究拟探讨线粒体抗氧化对 NP大鼠疼痛行为及TRPV1表达的影响。
1 材料与方法
1.1 实验动物、仪器和试剂清洁级雄性SD大鼠120只,6~8周龄,体质量200~230 g,由安徽医科大学实验动物中心提供。von-Frey触痛仪购自美国IITC公司;热痛刺激仪(BME-410A)购自北京中国医学科学院生物工程研究所;三苯基磷阳离子结合抗氧化剂 (mito-tempo,MT,sc-221945A)购自美国Santa Cruz公司,-20 ℃冰箱保存,使用生理盐水稀释成所需浓度;TRPV1一抗购自台湾Abnova公司;β-actin一抗、山羊抗鼠IgG二抗购自美国Abcam公司。
1.2 NP模型的建立参考Bennett et al[4]的方法制备左侧后肢慢性坐骨神经损伤(chronic constriction injury,CCI)模型。大鼠称重后,采用腹腔给药戊巴比妥钠(40~50 mg/kg)麻醉。麻醉起效后, 在股骨下方约1 cm平行于股骨切开皮肤,用小剥离子经股二头肌间隙钝性分离肌肉,暴露坐骨神经,用神经剥离子轻柔将坐骨神经与周围软组织分离;在坐骨神经分成三支前的主干部位游离神经7 mm左右,在距神经起始处(三支分叉处)上方2 mm用4-0含铬羊肠线结扎坐骨神经4道,每道间隔约1 mm,使被结扎的神经长4~5 mm。注意结扎的松紧度,以打结时可见肌肉轻微抽动为准;局部生理盐水冲洗,间断缝合肌肉筋膜、皮下组织以及皮肤。假手术组(Sham组)除不结扎坐骨神经外,其余同模型组。剔除运动障碍或机械和热刺激无反应的大鼠。
1.3 实验分组与动物处理所有大鼠饲养在温度、湿度、灯光受调控的房间,食物和水充足。采用随机数字表法分为3组(n=40):假手术组(Sham组)、神经病理性疼痛组(NP组)和抗氧化治疗组(MT组),每组再根据时间点细分为术前、术后3、7、14、21 d, 每组8只大鼠。Sham组和NP组分别于术后7~21 d腹腔注射生理盐水1 ml; MT组于术后7~21 d时腹腔注射三苯基磷阳离子结合抗氧化剂(mito-tempo,MT)0.7 mg/kg(溶于1 ml生理盐水)。
1.4 疼痛行为学检测
1.4.1机械缩足阈值(mechanical paw withdrawal threshold,MWT)的测定 有机玻璃笼(20 cm×20 cm×40 cm)置于金属筛网上,大鼠在其中适应环境15 min,用von-Frey触痛仪垂直刺激大鼠术侧足底中部,每足刺激6次,间隔10 s。大鼠会突然缩足或舔足动作视为阳性反应,记录电子Von Frey读数,将6次读数平均值计为MWT,评价机械痛敏。
1.4.2热缩足潜伏期(thermal paw withdrawal latency,TWL)的测定 在安静的环境中,将大鼠单独放置于20 cm×20 cm×40 cm大小有机玻璃笼内,笼底为厚0.2 mm玻璃,光源自动切断时间为20 s,以防止足底烫伤。待大鼠适应环境15 min后,光辐射热照射足底表面,每足照射3次,间隔5~10 min, 20 s内缩足视为阳性,记录从照射到缩足的时间,3次时间的平均值即为TWL,评价热痛敏。
1.5 脊髓TRPV1表达的测定采用Western blot法进行测定。每组行为学结束后随机处死3只大鼠,取L4-6节段脊髓组织,加入RIPA裂解液于冰上匀浆,4 ℃、12 000 r/min 离心30 min,取上清液,采用BCA蛋白定量试剂盒测定蛋白浓度。蛋白经丙烯酰胺凝胶电泳后,电转移至PVDF膜上,用8%脱脂牛奶室温封闭1.5 h,加入TRPV1一抗(1 ∶500),β-actin一抗(1 ∶1 000),4 ℃孵育过夜。TBST液漂洗10 min×3次,山羊抗鼠IgG二抗(1 ∶10 000),TBST液漂洗10 min×3次,洗膜后ECL显色,随后暗室曝光。采用Image J软件进行分析。以目的蛋白条带灰度值与β-actin条带灰度值的百分比反映目的蛋白表达水平。
2 结果
2.1 线粒体抗氧化对大鼠机械触痛的影响与Sham组比较,NP组术后第3、7、14、21天MWT明显降低(F=46.47,P<0.05);MT组术后第3、7天 MWT明显降低(F=30.49,P<0.05);与NP组比较,MT组术后第14、21天MWT明显升高(F=39.6,P<0.05)。见图1A。
2.2 线粒体抗氧化对大鼠热触痛的影响与Sham组比较,NP组术后第3、7、14、21天TWL明显降低(F=68.87,P<0.05);MT组术后第3、7天 TWL明显降低(F=27.98,P<0.05);与NP组比较,MT组术后第14、21天 TWL明显升高(F=48.56,P<0.05)。见图1B。
2.3 线粒体抗氧化对TRPV1表达的影响与Sham组比较,NP组脊髓组织L4-6节段术后第7、14、21天时TRPV1表达明显上调(P<0.05),且于术后第14天达峰值;MT组TRPV1表达在术后第7天时达峰值;与NP组比较,MT组TRPV1表达在术后第14、21天明显降低(P<0.05),术后第3、7天差异无统计学意义(P>0.05)。见表1。
3 讨论
NP有机械触痛、热触痛等明显特征。一旦外周神经受损,一系列病理生理改变将会产生。本研究通过制造大鼠CCI模型,行为学测试表明机械触痛及热触痛阈值明显降低,表明NP模型建立成功。
线粒体是自由基的主要来源,也是自由基攻击的目标,神经损伤后自由基过度产生可引起线粒体氧化应激、结构和功能异常,导致线粒体能量产生障碍。线粒体靶向抗氧化剂可以被线粒体有效摄取,缓解线粒体氧化应激[5]。前期研究[2]显示,与对照组相比,慢性坐骨神经性疼痛大鼠脊髓线粒体融合相关蛋白视神经萎缩蛋白1、线粒体融合蛋白1表达明显降低,分裂相关蛋白线粒体动力相关蛋白、分裂蛋白表达明显升高,线粒体抗氧化治疗后,线粒体分裂融合相关蛋白表达与对照组比较无明显差异。参照文献[6],大鼠NP建立后每天腹腔注射0.7 mg/kg的MT,实验结果也证实抗氧化治疗能明显改善NP大鼠的疼痛阈值。线粒体抗氧化治疗可以逆转慢性坐骨神经痛大鼠脊髓TRPV1表达的上调。这些结果提示MT可能通过抑制脊髓TRPV1的表达来发挥镇痛作用。
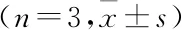
表1 三组大鼠脊髓TRPV1表达水平的比较
与Sham组比较:*P<0.05; 与NP组比较:#P<0.05
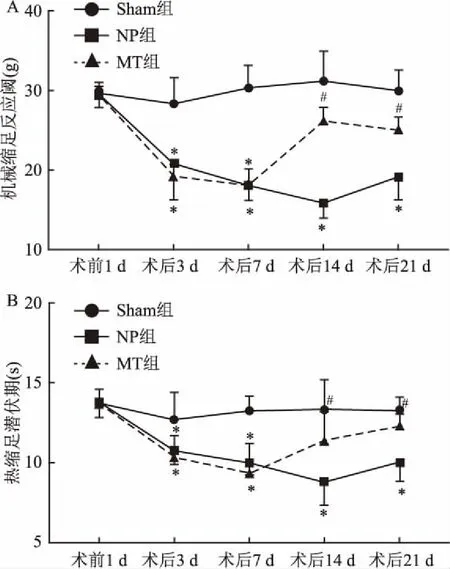
图1 3组大鼠各时间点机械触痛及热触痛
A:3组大鼠各时间点机械触痛;B:3组大鼠各时间点热触痛;与Sham组比较:*P<0.05;与NP组比较:#P<0.05
TRPV1作为一种非选择性离子通道,可能被大量生理或化学刺激激发。有报道[7]称TRPV1在神经元上表达可能导致神经病变。很多研究[8-9]证实TRP通道涉及紫杉醇或奥沙利铂诱导的神经性疼痛。长春新碱抗肿瘤治疗不可避免地会引起外周神经病变,研究[7]显示长春新碱诱导的NP大鼠小背根神经节神经元上TRPV1表达会明显增加。TRPV1表达可能导致长春新碱诱导的神经性疼痛的发生发展。本实验也显示NP大鼠脊髓TRPV1表达有明显增加;抗氧化治疗后,TRPV1表达明显下降,说明TRPV1可能参与慢性坐骨神经痛的发展。
线粒体抗氧化治疗减轻NP的具体机制尚未明确。前期研究[2]表明线粒体抗氧化治疗能降低NP大鼠氧化应激水平,改善线粒体功能。其他抗氧化剂如迷迭香酸,可通过抑制肿瘤坏死因子(tumor necrosis factor-α, TNF-α)、诱导型一氧化氮合酶、凋亡因子来减轻慢性坐骨神经痛大鼠的疼痛阈值[10]。也有研究[11]报道炎症因子TNF可使TRPV1表达上调产生疼痛,予以抗TNF生物制剂可明显缓解疼痛。本研究表明NP大鼠线粒体靶向抗氧化治疗后,TRPV1表达明显下调。线粒体抗氧化治疗是否通过缓解氧化应激,减轻炎症反应来调节TRPV1的表达还需要进一步研究。
综上所述,线粒体抗氧化能明显降低慢性坐骨神经损伤大鼠的疼痛行为;NP的发生发展与TRPV1表达明显增加有关,线粒体抗氧化治疗能降低TRPV1表达,可能成为NP治疗的新靶点。
