结直肠癌中RAC3表达水平及其对FOLFOX方案疗效的影响
2019-06-12方昌义昝建宝邹兵兵姜朋朋余昌俊
方昌义,昝建宝,苗 祥,邹兵兵,姜朋朋,余昌俊
近年来,我国结直肠癌(colorectal cancer,CRC)的发病率逐年升高,且呈现趋向年轻化的态势。其中,在城市地区恶性肿瘤的发病率位列第二,在农村地区位列第五,年死亡率为10.25/10万人[1],发病及死亡绝对例数均高居世界第一。目前CRC的外科治疗理念和手段包括:开腹、腹腔镜、机器人D3 CRC根治术,全直肠系膜切除术、结肠完整系膜切除术等均较为成熟并广泛开展,但事实证明,单纯依靠提高手术技术手段并不能明显改善CRC患者的预后。以5-氟尿嘧啶(5-fluorouracil,5-FU)为基础药物联合奥沙利铂(oxaliplatin, L-OHP)的药物化疗已成为Ⅲ期及部分Ⅱ 期CRC患者的标准治疗方案[2-3],但部分患者对亚叶酸钙联合5-FU、奥沙利铂(folic acid-5-fluorouracil and oxaliplatin,FOLFOX)化疗方案反应不佳,总体有效率仅有50%左右[4]。因此,筛选出对FOLFOX化疗方案不敏感的CRC患者,将是提高CRC患者化疗疗效的良好策略,也是CRC精准治疗的重要一环。研究[5]显示受体相关共激酶3(receptor associated-coactivator 3,RAC3)来源于CRC患者异常扩增的染色体区域20 q,并与多种CRC细胞对5-FU及L-OHP的耐药有关。该研究拟通过实验检测RAC3在CRC组织中的表达水平并验证其表达水平与CRC患者对FOLFOX方案敏感度的相关性。
1 材料与方法
1.1 材料
1.1.1病例资料 所选48例CRC组织标本来自2016年8月~2017年9月间在安徽医科大学附属安庆医院接受首次CRC根治手术的患者,CRC诊断有明确的病理组织学证据。所有入选患者术前未接受局部或全身的包括化疗、放疗及免疫治疗等在内的任何形式的抗肿瘤治疗。所有标本离体后30 min内进行样本取材并放入液氮贮存,取材范围包括肿瘤组织和相对应的距肿瘤边缘5~10 cm以上的正常黏膜上皮组织。所有入选组织标本具有完整的术后病理资料。同时收集到安徽医科大学第一附属医院及附属安庆医院病理科2014年3月~2017年4月经结肠镜或直肠镜活检并获得病理证实为结/直肠癌125例石蜡包埋组织标本,入选患者初次评估无法手术切除且术前行FOLFOX方案化疗2~3个月,且在化疗后1个月内行影像学检查并根据实体肿瘤客观疗效评定标准进行临床疗效评价,排除术前行新辅助放化疗患者。
1.1.2入选病例一般情况 48例CRC患者中,男26例,女22例;年龄40~81岁,中位年龄63岁。术后病理分期按照第七版美国癌症联合委员会联合修订的标准:Ⅰ期3例,Ⅱ期29例,Ⅲ期12例,Ⅳ期4例;病理学类型:高分化15例,中分化19例,低分化14例。125例石蜡标本中,来源于男性患者65例,女性60例,年龄44~75岁,中位年龄63岁,其中远处转移者76例(肝脏转移43例,其中单发转移灶31例,多发转移灶12例;骨转移19例,其中耻骨联合/髂关节转移8例,椎骨及骶前转移11例;腹膜后淋巴结及大网膜转移14例)、局部病灶浸润固定无法根治性切除者37例(前列腺/精囊腺/膀胱/附件侵犯23例,髂血管旁淋巴结侵犯9例,侧腹壁浸润固定5例)。超低位直肠癌(距肛缘≤3 cm)极力要求保肛者12例。
1.1.3主要试剂及仪器 RNA提取试剂 RNAisoTMPlus、逆转录试剂及荧光定量试剂盒SYBR Premix ExTaqⅡ购自大连TaKaRa Bio公司;兔抗人 RAC3 单抗购自美国 Santa Cruz生物技术公司。酶联免疫检测仪购自美国Thermo scientific公司;实时荧光定量 PCR仪(Light Cycler® 480 System)购自上海罗氏公司;抗鼠/兔通用型免疫组化检测试剂盒购自上海基因科技有限公司。
1.2 方法
1.2.1实时荧光定量PCR 根据逆转录及荧光定量试剂盒说明书进行实时荧光定量PCR。PCR引物序列见表1。在Light Cycler® 480 System实时荧光定量PCR仪上进行两步法PCR,反应条件见表2。

表1 RAC3实时荧光定量PCR引物序列信息

表2 CRC组织标本RAC3实时荧光定量PCR反应参数
1.2.2免疫组化 免疫组化石蜡切片经脱蜡水化、高压抗原修复后按照说明书进行免疫组化染色。显微镜下检测组织切片中 RAC3 的蛋白表达情况。对染色强度进行评分:0 分(未染色)、1 分(淡黄色弱染色)、2 分(棕黄色中度染色)、3 分(棕褐色强染色)。对染色面积进行打分:0 分(<10%)、1 分(10%~ 25%)、2 分(25%~ 50%)、3 分50%~ 75%)、4 分(>75%)。染色总得分 = 染色强度得分×染色面积得分。染色总得分≤3 分定义为阴性,3分<总得分≤6 分为弱阳性,>6 分为强阳性。
1.3 统计学处理采用 SPSS 22.0软件进行统计分析,student’t检验用于比较CRC组织与癌旁正常组织中的RAC3表达水平差异,χ2检验用于比较CRC组织中RAC3的相对表达水平与术后临床病理指标之间的关系。Kaplan-Meier生存分析及Log-rank检验用于比较不同RAC3表达水平患者的预后差异,P<0.05为差异有统计学意义。
2 结果
2.1 CRC组织中RAC3的表达水平及其与临床病理特征之间的关系qRT-PCR结果显示CRC组织中RAC3水平明显高于癌旁正常黏膜上皮组织 (数据以ΔCt显示,P<0.01),见图1。并且分析结果显示RAC3表达水平与肿瘤较晚分期(P=0.041)、微血管侵犯(P=0.014)、淋巴结转移(P=0.030)相关,见表3,提示RAC3可能与CRC患者预后有关。随后分析癌症基因组图谱(the cancer genome atlas, TCGA)公共数据库中597例CRC(低表达组患者298例,高表达组患者299例)患者的总生存数据,Kaplan-Meier生存分析显示RAC3表达增高的CRC患者术后总体生存期(overall survival,OS)缩短(P<0.01),见图2。
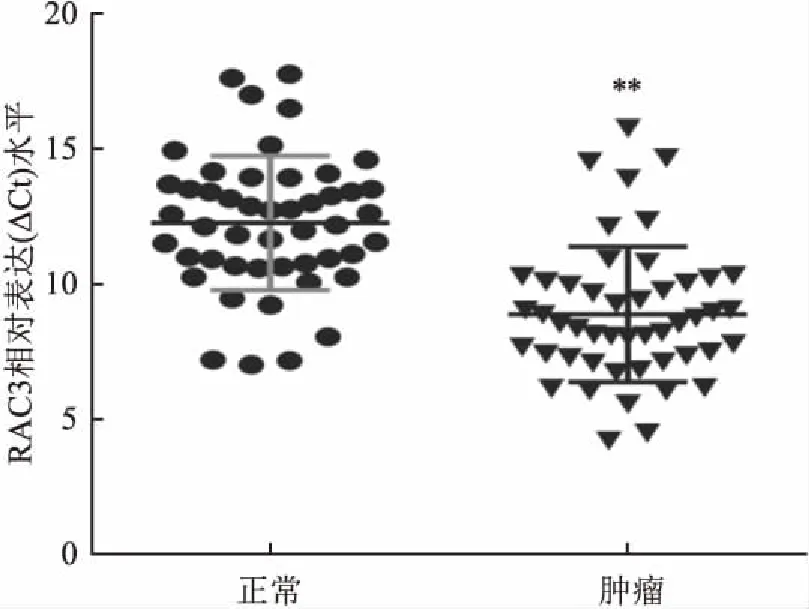
图1 RAC3在结肠癌组织及癌旁正常结肠黏膜组织中表达水平
与正常结肠黏膜比较:**P<0.01
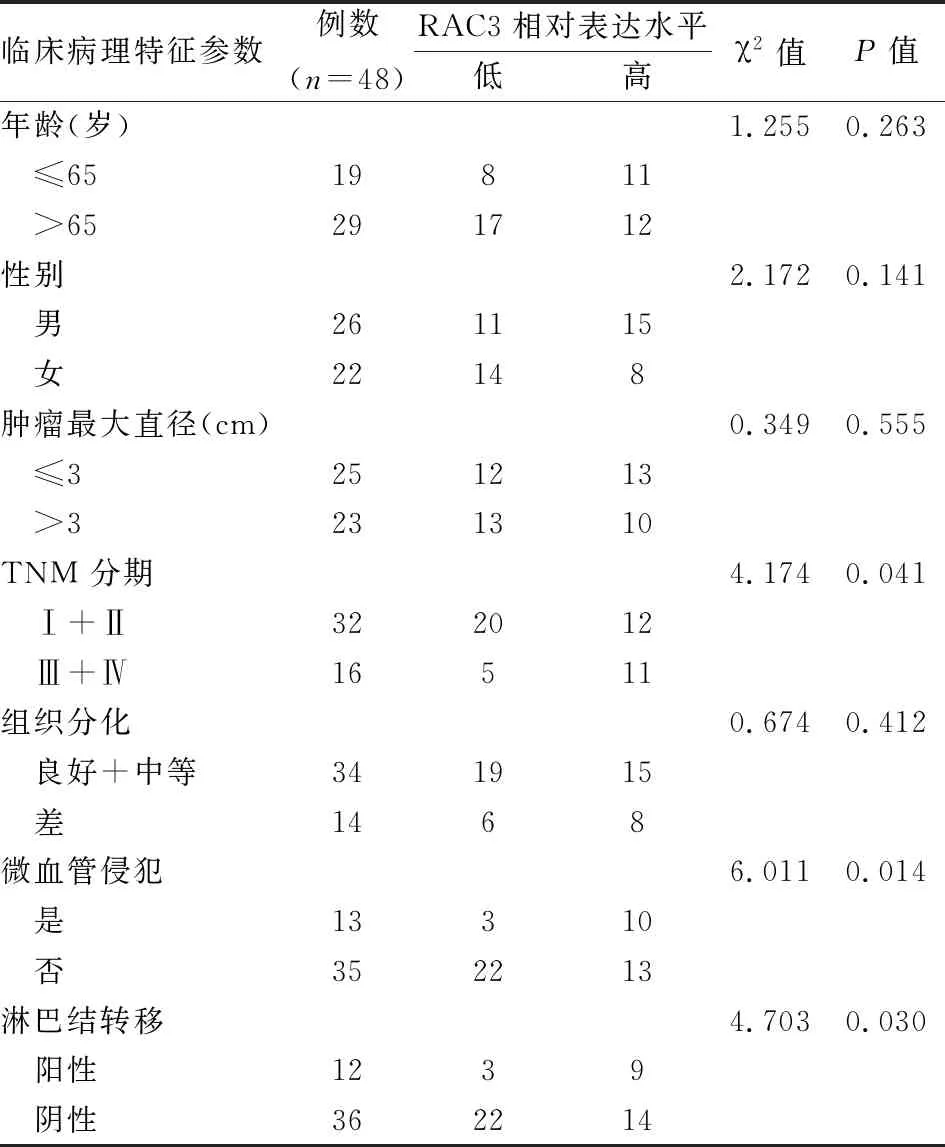
表3 CRC组织中RAC3的表达水平与不同临床病理特征之间的关系
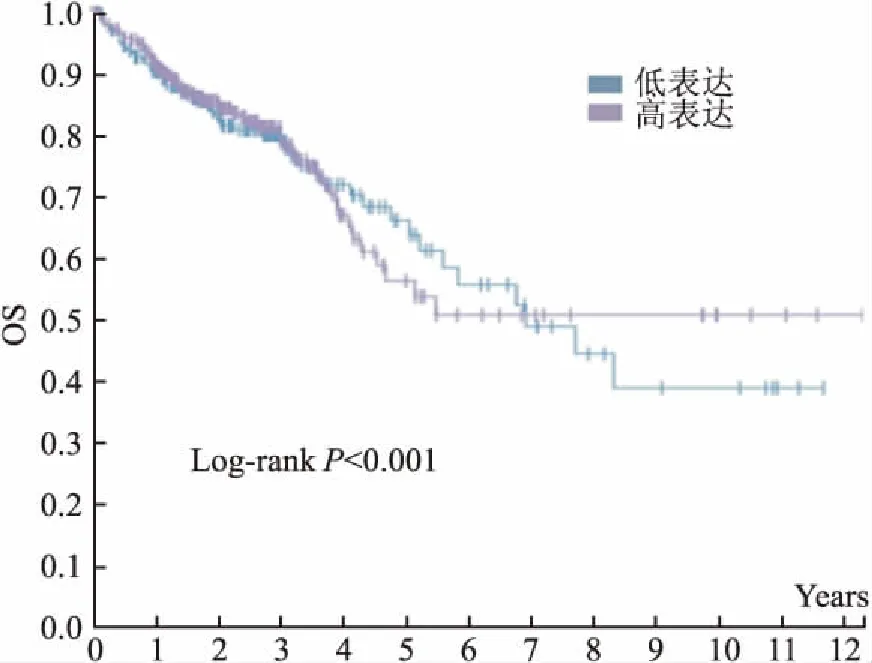
图2 Kaplan-Meier 生存曲线显示TCGA数据库中不同RAC3表达水平的 CRC患者的OS
2.2 CRC组织中RAC3的蛋白表达水平及其与FOLFOX化疗方案临床疗效之间的关系RAC3抗体免疫组化染色后,阳性信号(棕褐色颗粒),主要在细胞质中表达。结果显示CRC组织中RAC3高表达,正常结直肠黏膜上皮组织RAC3不表达或弱表达,见图3。随后根据RAC3蛋白在CRC组织中的表达水平分为阴性和阳性两组,并分析其与患者对FOLFOX 化疗方案敏感性之间的关系。结果显示RAC3阳性表达患者对FOLFOX 化疗反应较差(P<0.05)。见表4。
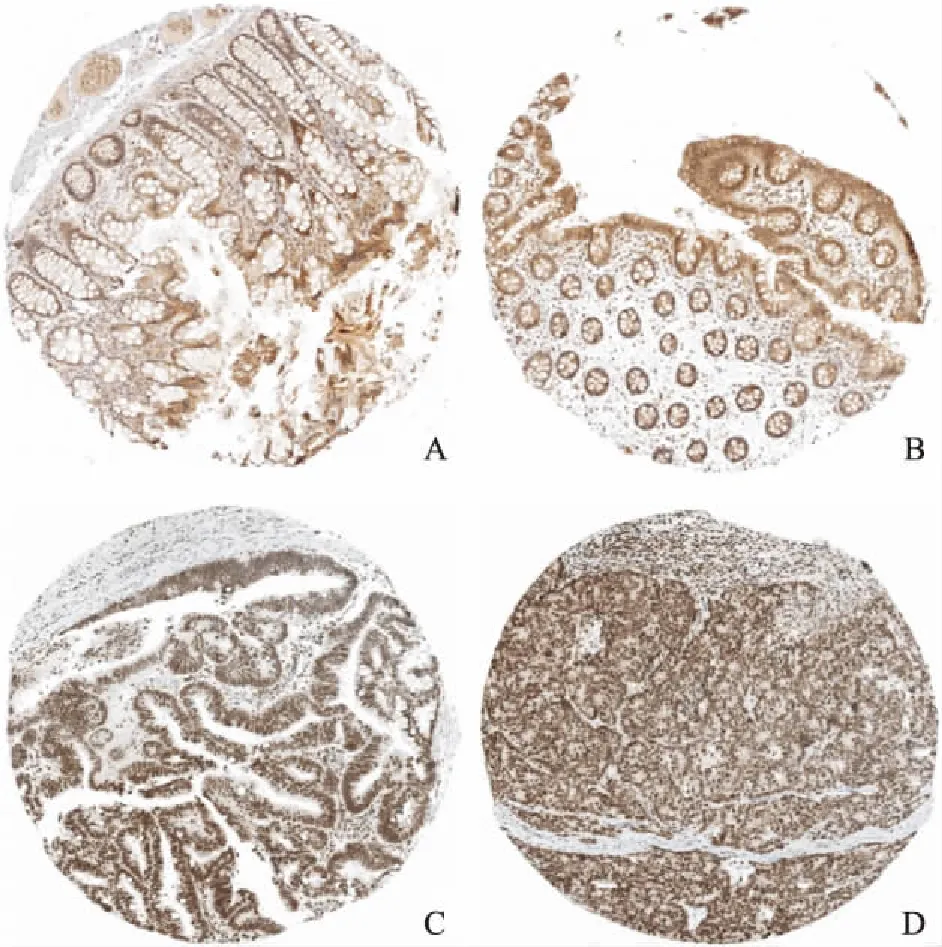
图3 免疫组化分析 RAC3 在正常结肠黏膜
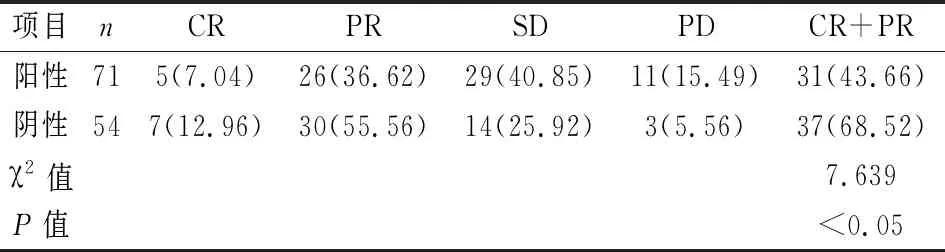
项目nCRPRSDPDCR+PR阳性715(7.04)26(36.62)29(40.85)11(15.49)31(43.66)阴性547(12.96)30(55.56)14(25.92)3(5.56)37(68.52)χ2值7.639P值<0.05
CR:完全缓解;PR:部分缓解;SD:疾病稳定;PD:疾病进展
3 讨论
CRC已成为我国居民健康的严重威胁和医疗卫生的重大负担。虽然CRC的综合诊疗逐渐规范、临床疗效提高,但CRC患者的总体预后仍较差,五年标准化生存低于欧美等发达国家10个百分点左右[6]。自20世纪90年代开始,辅助化疗进入临床实践,代表性药物如5-FU等能在一定程度上改善CRC患者的总体预后,由此进入了根治性手术与辅助化疗相结合的综合治疗的时代。但化疗耐药事件在临床上时有发生,部分患者对化疗反应不敏感,最终导致肿瘤复发或转移,严重影响预后。CRC化疗耐药的出现,与多种潜在的关键调控分子及信号通路的激活有关。因此,针对驱动化疗耐药的关键基因开展研究,将是加快化疗耐药基础及临床研究进展、提高CRC患者化疗疗效的良好策略,也是CRC综合治疗精准化和个体化的重要内涵。
RAC3来源于CRC患者异常扩增的染色体区域20q,同时也是影响包括乳腺癌在内的多种肿瘤患者预后的重要因素[7-8]。在中国人群中,约35%的CRC样本出现RAC3过表达且影响肿瘤的进程[9]。新近研究显示结肠癌中RAC3过表达与包括HCT116在内的多种CRC细胞对5-FU及L-OHP的耐药有关[5],其可能的机制涉及抗自噬作用以及核因子kappa-B(nuclear factor kappa-B,NF-κB)分子的激活等[10]。由此,RAC3可能是筛选对FOLFOX 化疗反应不敏感的CRC患者亚群的潜在标志物[11]。
本研究显示,RAC3在CRC组织中的表达明显高于癌旁正常结肠黏膜上皮组织,免疫组化结果亦显示RAC3蛋白阳性表达率在CRC组织中较高,差异有统计学意义。通过分析CRC组织标本的临床病理资料表明,RAC3的表达水平在有淋巴结转移及较晚临床分期患者中较高,与Xie et al[12]等研究结果相一致。同时本研究还表明有微血管侵犯的CRC组织标本中RAC3水平亦显著增高,这些结果表明RAC3过表达与CRC的进程相关,可能影响患者预后。TCGA公共数据库中597例CRC患者的Kaplan-Meier 生存分析显示 RAC3表达增高的CRC患者术后5年生存率为56%,而RAC3低表达的患者术后5年生存率为64%。随后依据RAC3蛋白是否表达对经肠镜活检CRC标本进行分组,并分析亚组患者对FOLFOX方案化疗的敏感度。结果显示RAC3阳性表达组患者的CR+PR率只有43.66%(31/71),明显低于RAC3阴性表达组患者68.52%(37/54),差异有统计学意义(P<0.05)。以上结果表明RAC3在CRC组织中高表达与患者恶性病理特征有关,提示患者预后不良;该患者亚群对FOLFOX 化疗方案的敏感度较低,可能需要包括多学科协作在内的更加精准的个体化综合治疗以及更加精细的术后管理和监测。
综上所述,本研究揭示RAC3可能参与CRC的发展进程,并与患者对FOLFOX化疗方案的临床反应有关。RAC3可能是CRC精准治疗策略中一个潜在的生物标志物。
