人参皂苷CK抑制内质网应激防治酒精性肝损伤
2019-06-12王洪波朱振宇刘振文
张 宇,王洪波,朱振宇,任 辉,蒙 轩,刘振文
酒精性肝病(alcoholic liver disease, ALD)是长期大量饮酒导致的第二大肝脏疾病,临床表现为脂肪肝、酒精性肝炎、肝硬化、肝细胞坏死等,其严重危害人民的身体健康[1]。近年来不断有研究表明内质网应激(endoplasmic reticulum stress, ERS)对于诸多肝脏相关疾病,尤其在ALD的发生发展中发挥作用。研究[2]显示ERS可以打破肝脏内脂质稳态平衡,诱发肝细胞凋亡与脂变。人参皂苷CK是人参皂苷在体内发挥活性的主要形式,具有保护肝脏、抗炎、改善免疫功能、抗癌等药理活性[3-4]。该研究基于建立大鼠酒精性肝脏损伤模型,从ERS反应性角度研究人参皂苷CK对肝脏病理变化、细胞凋亡、超微结构、脂质合成的影响,以期通过ALD发病机制寻找合适的抗酒精性肝病靶点药物,对于有效预防和治疗ALD有重要的理论和临床意义。
1 材料与方法
1.1 动物及主要试剂
1.1.1动物 雄性SD大鼠,SPF级,体质量280~300 g,购自北京维通利华实验动物技术有限公司。
1.1.2主要试剂 苏木精-伊红(HE)染色试剂盒购自江苏碧云天生物科技;GRP78抗体、GAPDH抗体购自英国剑桥abcam公司;Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自江苏凯基生物;苏丹Ⅳ染色液购自北京雷根生物技术有限公司;人参皂苷CK(ZT-20093)购自上海甄准生物公司;甘油三酯检测试剂盒购自德国达姆施塔特sigma公司;注射用腺苷蛋氨酸购自德国基诺药厂。
1.2 方法
1.2.1大鼠酒精性肝损伤动物模型的建立 将雄性SD大鼠10只作为对照组,剩余40只参考Wen et al[5]造模方法并加以改进,每日予以56°白酒(10 ml/kg)、玉米油(2 ml/kg)、吡唑(25 mg/kg)混合物灌胃1次,每周腹腔注射0.3 ml/kg四氯化碳、橄榄油混合液(体积比1 ∶3)1次,连续10周,判断酒精性肝损伤动物模型造模成功[6]。第11周起将造模大鼠随机分为模型组和低浓度(20 mg/kg)人参皂苷CK干预组,高浓度(40 mg/kg)人参皂苷CK干预组,腺苷蛋氨酸阳性对照组(200 mg/kg),采用腹腔注射给药方式,每天1次,连续给药2周,对照均采用同体积生理盐水。然后处死,分离肝脏,分离原代细胞或肝脏标本-70 ℃冻存。
1.2.2HE染色病理学检测 取各组肝脏组织,100 g/L甲醛固定,常规石蜡包埋,4 μm切片。切片常规用二甲苯脱蜡,经无水乙醇Ⅰ、无水乙醇Ⅱ、95%乙醇、90%乙醇、80%乙醇、75%乙醇脱水,每次各5 min,蒸馏水洗3次。染色后脱水透明,封固、光镜观察炎症坏死等病变程度。
1.2.3Western blot检测GRP78表达 取各组肝脏组织,RIPA细胞蛋白裂解液提取蛋白,二喹啉甲酸法(BCA法)蛋白定量。SDS-PAGE凝胶电泳后PVDF膜恒流湿法进行转膜。转膜成功的PVDF膜转移到5%脱脂奶粉-TBST封闭液于室温封闭l h。再将PVDF膜分别加入稀释的GRP78、GADPH一抗(1 ∶2 000稀释),4 ℃轻摇过夜;随后加入相应的二抗(1 ∶1 000 稀释),37 ℃恒温摇床孵育l h。蛋白的相对表达量用待测蛋白与GADPH的灰度值比值计算。
1.2.4Annexin V-FITC/PI双标记法检测肝细胞凋亡 收集各组新鲜肝组织剪碎,置于100目铜网上轻搓,生理盐水冲洗,2 500 r/min离心弃去上清及细胞碎片,收集细胞悬液。参照《Annexin V-FITC/PI双染细胞凋亡检测试剂盒》通过流式细胞仪进行分析。
1.2.5电镜观察各组肝细胞超微结构 分离各组肝脏原代细胞,2.5%戊二醛固定,反应4 h;0.1 mmol/L磷酸缓冲液清洗3次;30%、50%、70%、85%、95%乙醇梯度脱水各一次,每次20 min;100%乙醇脱水2次,每次20 min;乙酸异戊酯置换2次,每次20 min;将细胞均匀涂布盖玻片上,-70 ℃冷冻12 h;冷冻干燥48 h;将盖玻片样品喷金粉后上样,观察。
1.2.6甘油三酯含量检测 使用甘油三酯检测试剂盒,甘油三脂总浓度通过偶联酶促反应生成有色产物,在波长570 nm下检测,其颜色深浅程度与样品中甘油三酯的含量成正比。
2 结果
2.1 人参皂苷CK干预对酒精性肝损伤大鼠肝脏组织病理的影响HE染色病理学检测结果显示正常大鼠肝脏组织结构清晰完整,肝血窦腔隙正常,肝细胞索结构明显,肝细胞以中央静脉为中心呈放射性排列。模型组大鼠肝脏组织肝细胞索界限不清晰,肝细胞质呈现一定程度的空泡结构;肝小叶中央静脉周围区域集中可见点状或灶状坏死变性,坏死区域存在大量侵润炎症细胞;肝细胞可见脂肪变性结构, 内含大小不等的脂滴。低浓度(20 mg/kg)人参皂苷CK干预组肝细胞基本恢复正常,肝细胞索排列整齐,肝窦基本恢复正常,肝细胞浊肿明显减轻,部分肝细胞处于气球样变。高浓度(40 mg/kg)人参皂苷CK干预组与腺苷蛋氨酸阳性对照组肝小叶结构清晰,肝索、肝窦无明显异常,细胞浆着色均匀,无明显变性,细胞核结构较清晰,体积正常,但核质略少,或分布不均,可见少量散在的肝细胞有轻度浊肿。见图1。
2.2 人参皂苷CK干预抑制酒精性肝损伤大鼠肝脏ERS反应Western blot检测各组肝脏组织ERS标志蛋白GRP78,结果显示模型组GRP78蛋白表达量相对于对照组明显升高,表明酒精刺激后的大鼠肝脏发生了ERS。低浓度(20 mg/kg)和高浓度(40 mg/kg)人参皂苷CK干预后均不同程度降低GRP78蛋白表达,其中高浓度(40 mg/kg)组GRP78表达接近正常组和腺苷蛋氨酸阳性对照组。表明人参皂苷CK干预可有效抑制酒精刺激大鼠肝脏引起的ERS反应。见图2。

图1 各组大鼠肝脏组织病理变化×200
A:正常组;B:模型组;C:低浓度(20 mg/kg)人参皂苷CK干预组;D:高浓度(40 mg/kg)人参皂苷CK干预组;E:腺苷蛋氨酸阳性对照组

图2 Western blot检测酒精性肝损伤ERS标志蛋白GRP78蛋白表达
1:正常组;2:模型组;3:低浓度(20 mg/kg)人参皂苷CK干预组;4:高浓度(40 mg/kg)人参皂苷CK干预组;5:腺苷蛋氨酸阳性对照组
2.3 人参皂苷CK干预抑制酒精性肝损伤大鼠肝细胞凋亡Annexin V-FITC/PI双标记法检测肝细胞凋亡,结果显示正常组、模型组、低浓度(20 mg/kg)人参皂苷CK干预组、高浓度(40 mg/kg)人参皂苷CK干预组、腺苷蛋氨酸阳性对照组细胞总凋亡率分别为(10.23±0.98)、(24.01±1.76)、(13.66±0.65)、(11.04±0.88)、(9.92±0.71)。经单因素方差分析,组间差异有统计学意义(F=90.95,P<0.05)。模型组较正常组细胞凋亡率显著升高,高浓度(40 mg/kg)干预组较模型组均显著降低,差异均有统计学意义(P<0.05),见图3。表明人参皂苷CK干预可有效抑制酒精刺激大鼠肝脏引起的细胞凋亡。
2.4 人参皂苷CK干预改善酒精性肝损伤大鼠肝细胞超微结构电镜观察各组肝细胞超微结构结果显示,较正常组肝细胞,模型组细胞形态异常,细胞内线粒体数量明显减少,线粒体增大,线粒体嵴结构紊乱,时有线粒体嵴结构消失呈空泡样改变;低浓度(20 mg/kg)人参皂苷CK干预组肝细胞线粒体略有恢复,但基质仍旧稀薄;高浓度(40 mg/kg)人参皂苷CK干预组细胞形态及线粒体结构明显改善,可见大量线粒体,呈椭圆形,线粒体嵴结构整齐,同正常组及腺苷蛋氨酸阳性对照组,见图4。
2.5 人参皂苷CK干预对酒精性肝损伤大鼠肝脏脂质合成代谢的影响检测肝细胞内甘油三酯含量结果显示,正常组、模型组、低浓度(20 mg/kg)人参皂苷CK干预组、高浓度(40 mg/kg)人参皂苷CK干预组、腺苷蛋氨酸阳性对照组细胞甘油三酯含量分别为(24.76±1.53)、(38.25±1.97)、(31.15±1.77)、(28.81±1.21)、(27.64±1.36)。经单因素方差分析,组间差异有统计学意义(F=30.71,P<0.05)。模型组较正常组显著升高,高浓度(40 mg/kg)人参皂苷CK干预组较模型组显著降低,差异均有统计学意义(P<0.05)。表明人参皂苷CK干预可有效抑制酒精刺激大鼠肝脏引起的肝细胞脂肪病变程度。

图3 流式检测酒精性肝损伤细胞凋亡
A:正常组;B:模型组;C:低浓度(20 mg/kg)人参皂苷CK干预组;D:高浓度(40 mg/kg)人参皂苷CK干预组;E:腺苷蛋氨酸阳性对照组
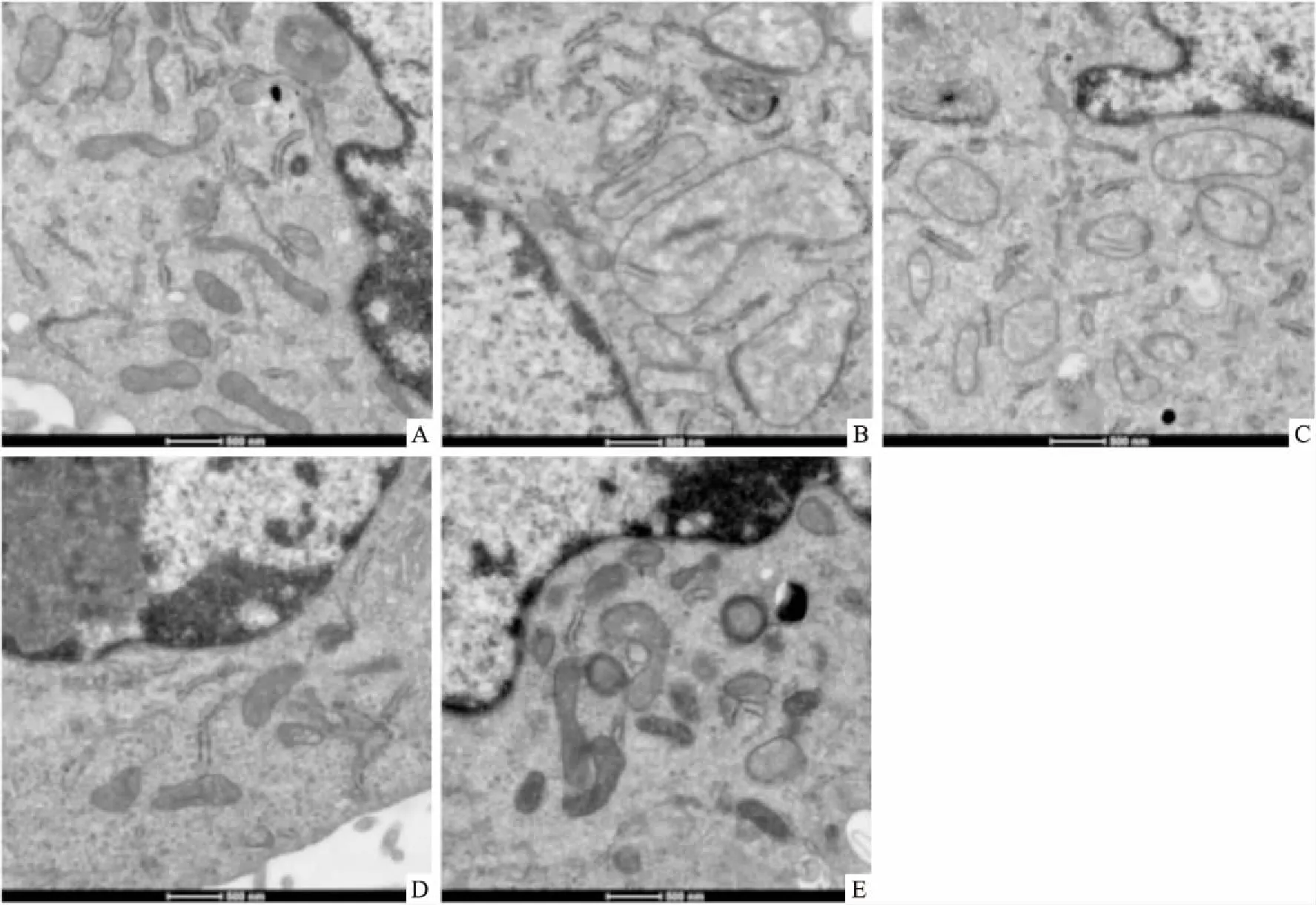
图4 电镜检测酒精性肝损伤细胞超微结构×100 000
A:正常组;B:模型组;C:低浓度(20 mg/kg)人参皂苷CK干预组;D:高浓度(40 mg/kg)人参皂苷CK干预组;E:腺苷蛋氨酸阳性对照组
3 讨论
酒精性肝病作为长期以来主要肝脏疾病和研究重点,其发病机制复杂,除了酒精毒性削弱正常肝细胞的代谢及肝细胞膜的稳定性、损伤线粒体功能等[7-8],越来越多学者开始关注ERS及其介导的肝细胞凋亡可能在其中发挥的重要作用。如Yan et al[9]通过建立大鼠酒精性肝病模型,电镜下观察到模型组大鼠肝细胞的线粒体明显受损,出现膜断裂,嵴断裂或消失,与对照组相比,模型组大鼠肝脏线粒体渗透转运通道PTP开放,导致线粒体肿胀,540 nm处吸收光度值A540减少(P<0.01),模型组线粒体跨膜电位显著降低且模型组线粒体质量有明显损害,胞内钙离子显著增加,表明长期饮酒可引起肝细胞线粒体PTP开放,Ca2+外流,跨膜电位下降甚至崩溃,导致线粒体肿胀,引发肝细胞的凋亡或损伤。关慧[10]通过乙醇处理HepG2细胞建立酒精性肝损体外模型,结果表明乙醇组GRP78基因表达水平明显升高,细胞内甘油三酯含量增多,蛋白酶体活性降低,差异有统计学意义。
内质网是机体蛋白质合成、运输的主要场所,同时参与脂质代谢的合成。当某些因素使细胞内质网生理功能发生紊乱,未折叠及错误折叠的蛋白质增多,在内质网腔内堆积,会引起ERS。ERS进而通过激活未折叠蛋白反应信号传导通路提高细胞生存能力[11-12]。其中,GRP78作为内质网内驻留最多的分子伴侣,当ERS发生、内质网内未折叠蛋白增多时,GRP78可与未折叠蛋白结合并帮助其正确折叠,因此GRP78被认为是ERS发生的标志性分子[13]。本研究显示,大鼠肝脏在造模后GRP78蛋白表达量相对于对照组均显著升高,表明酒精刺激后的大鼠肝脏发生了明显的ERS反应。此外,针对酒精性肝损伤模型组,病理结果显示肝细胞索界限不清晰,肝小叶中央静脉周围区域集中可见点状或灶状坏死变性,坏死区域存在大量侵润炎症细胞;流式结果显示促进细胞凋亡;电镜观察结果显示细胞形态异常,细胞内线粒体数量明显减少,线粒体增大,线粒体嵴结构紊乱,时有线粒体嵴结构消失呈空泡样改变;甘油三酯含量增加;均和上述研究理论及成果一致。
人参皂苷CK是天然二醇型人参皂苷在人体内主要降解产物,是其发挥活性作用的主要形式,诸多研究[14]表明人参皂苷CK具有保护肝脏、抗炎、改善免疫功能、抗癌等药理活性。如张雷明 等[15]用四氯化碳致大鼠慢性肝损伤模型,发现人参皂苷CK可以有效降低血清转氨酶ALT、AST水平,显著增加血清SOD的含量,表明CK对慢性肝损伤具有一定的保护作用,其作用可能与抗氧化有关。本研究显示高浓度(40 mg/kg)人参皂苷CK干预可以明显改善酒精性肝损伤大鼠肝脏组织病理病变,显著降低肝损伤引起的GRP78蛋白表达量上调,抑制酒精刺激大鼠肝脏引起的ERS反应。人参皂苷CK干预可有效抑制酒精刺激大鼠肝脏引起的细胞凋亡及线粒体结构损伤,可见线粒体嵴结构整齐,形态正常。此外,有报道ERS可通过激活固醇调节元件结合蛋白促进甘油三酯合成增多[16],所以在该实验中选取甘油三酯含量的测定作为ERS下游效应的评估。结果表明人参皂苷CK干预明显改善细胞脂肪变性情况,可明显降低甘油三酯含量。
综上所述,本研究进一步证实ERS与酒精性肝病的关系,并且首次证明人参皂苷CK可抑制ERS,并在一定程度上防治酒精性肝病。人参皂苷CK干预可以明显改善酒精性肝损伤大鼠肝脏组织病理病变,抑制ERS反应,抑制酒精刺激大鼠肝脏引起的细胞凋亡及线粒体结构损伤,抑制脂肪病变程度。这为深入研究酒精性肝病损伤的发病机制,为临床寻找理想的抗肝损伤药物具有重要意义。
