多肽301LARSLKT307对斑马鱼胚胎早期心脏发育的影响
2019-06-12严湘芸陈文娟王星云韩树萍余章斌
胡 银,刘 恒,严湘芸,庄 斌,陈文娟,王星云,韩树萍,余章斌
法洛四联症是常见的复杂先天性心脏病,其发生率约占活产婴儿的4‰,死亡率则达5%以上,且需二次手术的患儿高达30%[1],给家庭和社会带来沉重的负担。早期诊断及早期治疗可以显著提高患儿的存活率。本课题组早期利用气-液联动质谱技术,对法洛四联症流产胎儿心肌组织进行多肽组学进行分析[2],发现TALIN-1结构域来源的多肽301LARSLKT307含量较对照组有显著差异,提示这条多肽可能与心脏的发育及功能相关。为了验证此假设,该研究用显微注射技术将多肽注射入斑马鱼受精卵,构建胚胎发育模型,研究在此条件下该多肽对心脏发育的影响。
斑马鱼的心脏发育,在基因表达、形态发生以和生理特性上均与哺乳动物高度相似[3]。并且,斑马鱼胚胎在体外受精与发育、胚胎透明、产量大,且可不完全依赖于心血管系统存活[4]。斑马鱼心脏发育迅速,72 h即可完成胚胎期心脏发育[5],相当于人类妊娠8周内心脏发育的过程。这些优势使得斑马鱼成为心脏发育研究的重要模型。该研究从多肽对斑马鱼的生长发育过程的影响入手,为阐明多肽与胚胎心脏发育畸形的内在机制提供理论依据和线索,以期望能够对人类先天性心脏病的诊断及治疗的研究方面有所帮助。
1 材料与方法
1.1 实验动物Tubingen品系野生型成年斑马鱼购自南京大学模式动物研究所,雌雄斑马鱼分缸饲养,每日予光照14 h、黑暗10 h的人工光照周期;成年斑马鱼予脱壳丰年虫喂食3次/d。实验前12 h,将成年雌雄斑马鱼等比例配对移入交配缸,并用挡板分开,次日亮灯前抽取挡板,光照刺激促排卵,15 min后收集胚胎。收集的胚胎置于28.5 ℃恒温培养箱中,及时更换培养液并挑出死亡的胚胎,防止影响其他胚胎发育。
1.2 试剂与仪器
1.2.1主要试剂 多肽及对照随机乱序肽均委托北京泽溪源公司化学合成,序列分别为LARSLKT和ALKTLRS;原位杂交RNA探针:心肌肌球蛋白轻链2型基因(cardiacmyosin light chain-2,cmlc2)、心室肌球蛋白重链基因(ventricular myosin heavy chain,vmhc)、心房肌球蛋白重链基因(atrtal myosin heavy chain,amhc)由南京市妇幼保健院医学研究中心赠送;Tween-20购自美国Amresco公司;甲酰胺购自美国Promega公司;酵母RNA、多聚甲醛、蛋白酶K、色素抑制剂、马来酸、左旋咪唑、苯甲酸、苯甲醇、甲基纤维素、三卡因均购自美国Sigma公司;封闭剂、地高辛抗体、地高辛标记的UTP、显色液、氯化硝基四氮唑蓝(NBT)、对甲苯胺蓝(BCIP)均购自德国Roche公司;TRIzol购自美国Invitrogen公司;动物组织总RNA提取试剂盒购自北京天根公司;反转录试剂盒及SYBR Premix Ex TaqTM II购自日本TAKARA公司;余试剂均为国产分析纯。
1.2.2主要试验仪器 隔水式电热恒温培养箱(型号:PYX-DHS)购自上海跃进公司;Olympus体式显微镜(型号:MVX-TV0.63XC)购自日本Olympus公司;徕卡立体显微镜(型号:MZ16F)购自英国Leica公司;原位杂交炉(型号:HL-2000 Hybrilinker)购自美国UVP公司;Real-time PCR仪(型号:ViiA 7)购自美国UVP公司。
1.3 实验方法
1.3.1实验分组与多肽的显微注射 将1次所产的胚胎随机分为3组,野生型组(WT)、实验多肽注射组(PEP)、对照多肽注射组(NC)。PEP组在45 min内(斑马鱼胚胎1细胞期)进行显微注射,每个胚胎注射10 μmol/L的实验多肽液1 nl于受精卵的卵黄囊部位。NC组的胚胎在45 min内注射10 μmol/L的对照多肽液1 nl于受精卵的卵黄囊部位。WT组正常生长,不作处理。注射完成后,胚胎立即置于28.5 ℃恒温培养箱中,及时更换培养液并挑出死亡的胚胎,防止影响其他胚胎发育。
1.3.2斑马鱼心率计数 将斑马鱼胚胎置于3%甲基纤维素中,于显微镜下计数斑马鱼胚胎1 min心跳数,得到心率。
1.3.3斑马鱼胚胎原位杂交 收集不同发育时期的胚胎,每管40个胚胎。胚胎撕掉鞘膜,用4%的多聚甲醛固定过夜后,25%、50%、75%、100%甲醇梯度脱水,保存于-20 ℃。原位杂交时,25%、50%、75%、100%的PBST梯度水化胚胎,4%多聚甲醛固定20 min,蛋白酶K(20 μg/ml)处理20 min,缓冲液反复清洗后,转移到hyb-液中,65 ℃杂交炉孵育5 min,换入hyb+液预杂交4 h,接着加入含有1 ng/μl的RNA探针(cmlc2、vmhc、amhc)的hyb+液,65 ℃杂交炉中过夜,SSC溶液反复洗去非特异性结合的探针,然后换入封闭液室温封闭1 h终止反应,之后换为含有1/4 000体积地高辛抗体的封闭液,4 ℃过夜,MABT室温洗涤,用于洗去非特异性结合的抗体,依次加入平衡液和显色液进行避光显色4 h。显色结束后用缓冲液清洗,进一步洗去非特异性信号,将胚胎置于包埋液(苯甲酸与苯甲醇按2 ∶1配制),于徕卡立体显微镜下拍照并采集图像。
1.3.4RNA的提取及cDNA的制备 收集12 h的三组斑马鱼胚胎各20个,加入0.7 ml TRIzol,用匀浆器充分研磨。室温静置10 min后,加入140 μl氯仿,震荡混匀,4 ℃、10 400 r/min离心15 min;转移上层液体到新的离心管,加入1.5倍体积的乙醇充分混匀,转移至RNeasy,室温10 400 r/min离心1 min,弃废液;向吸附柱中加入350 μl RW1,10 400 r/min离心1 min,重复1次;加入500 μl RW,室温2 min后10 400 r/min离心1 min,弃废液,重复1次;空转10 400 r/min离心1 min,置于通风处放置5 min,向吸附柱中加入50 μl水,室温静置2 min,将吸附柱转移至另一1.5 ml离心管,10 400 r/min离心2 min。核酸定量仪读OD值测出浓度,A260/A280为1.8~2的判定质量较好。加入2.0 μl 5×gDNA Eraser Buffer、1.0 μl gDNA Eraser、1 μg斑马鱼总RNA,用DEPC水定容到10 μl,混匀之后,42 ℃反应2 min,冰上放置2 min以去除基因组DNA;加入4.0 μl 5×PrimeScript® Buffer 2(for Real Time)、1.0 μl PrimeScript® RT Enzyme Mix I、1.0 μl RT Primer Mix,DEPC水定容到20 μl,此过程在冰上进行,混匀之后37 ℃反应15 min,85 ℃反应5 s,所得cDNA贮存在-20 ℃。
1.3.5实时定量PCR(qPCR) 采取SYBR Green法进行实时定量PCR,使用的相关引物见表1,模板为胚胎12 h的cDNA,10 μl反应体系,其中包括5 μl 2×SYBR Green Master Mix,0.5 μl 的正向引物(10 μmol/L)和反向引物(10 μmol/L),50 ng cDNA,0.2 μl Rox,加DEPC水定容至10 μl。将上述体系试剂加入384空板中,放入荧光定量PCR仪中进行40个循环的PCR扩增,反应条件如下:50 ℃ 2 min;95 ℃ 10 min;95 ℃ 10 s;60 ℃ 31 s。扩增结束后所得CT值采用相对定量法以β-actin为内参基因计算目的基因表达量的比值,用Fold值表示,用标准的t检验进行统计学分析。

表1 实时定量PCR目的基因的引物
1.4 多肽的基本生物信息学分析通过NCBI(https://www.ncbi.nlm.nih.gov/protein/)在线网站查找多类物种的TALIN-1前体蛋白序列;采用Uniprot(http://www.uniprot.org/)蛋白数据库Blast方法确定该肽的位置及其与前体蛋白和结构域间的关系;使用ProtParam tool(https://web.expasy.org/protparam/)在线数据库分析该肽的理化性质特征。
2 结果
2.1 多肽301LARSLKT307的生物学信息通过NCBI在线网站查找出包括斑马鱼及人类在内多类物种的序列,发现在这些物种中,TALIN-1蛋白的该段多肽序列高度一致(图1A),这种进化上的高度保守性提示TALIN-1蛋白的该段序列肽,可能在生物的发育过程中起重要作用。利用质谱定量技术,对这条肽进行分析,结果见图1B。通过Uniprot在线网站查询得知,该条肽的前体蛋白TALIN-1主要位于细胞膜及细胞骨架中,该肽位于其前体蛋白的301~307氨基酸位点,在其前体蛋白的B41结构域内,该结构域的功能是与细胞膜相结合,在细胞膜的组装和稳定中起支撑和调节作用。这条肽处于该结构域中,可能可以发挥与之相同或相反的功能。通过ProtParam tool查找发现该多肽在真核生物中的半衰期是5.5 h,不稳定系数为59.21;亲脂系数(aliphatic index)为:125.71,亲水系数(grand average of hydropathicity)为-0.07,这提示该肽是脂溶性较亲水性强的多肽,易通过扩散或者胞吞的方式进入细胞内。
2.2 多肽对斑马鱼心包的影响为更进一步了解斑马鱼心脏发育情况,显微注射后利用立体显微镜记录下斑马鱼发育36、48和72 h各组的心脏的发育情况(图2)。研究表明PEP组的斑马鱼在36 h已开始出现轻微的心包水肿,随着时间的迁移,斑马鱼心包的水肿情况越来越明显。
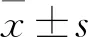
2.3 多肽对斑马鱼心率的影响心率是衡量心脏功能的重要指标,是衡量多肽对心脏发育影响的重要依据。分别计数36、48、72 h各组斑马鱼的心率,每组每个时间点计数至少10条斑马鱼。36 h斑马鱼心率WT组为(150.20±7.16)次/min、NC组为(150.00±8.84)次/min、PEP组为(87.20±15.14)次/min;48 h斑马鱼心率WT组为(143.67±6.15)次/min、NC组为(142.25±7.58)次/min、PEP组为(120.75±11.80)次/min;72 h斑马鱼心率WT组为(174.73±5.98)次/min、NC组为(171.18±5.98)次/min、PEP组为(161.73±10.44)次/min,具体的结果见图3。WT组与NC组斑马鱼胚胎心率差异无统计学意义,36、48和72 h的P值分别为0.96、0.62、0.12。但与WT组相比,PEP组各时间点的心率均呈下降趋势,差异有统计学意义,36、48、72 h的P值分别为5.82E-10、5.30E-06、1.02E-03。
2.4 原位杂交检测多肽对心脏环化的影响收集斑马鱼48 h的胚胎,利用cmlc2、amhc、vmhc这3种分别标记斑马鱼的心脏整体、心房和心室的探针,与斑马鱼胚胎原位杂交,显色后使得心脏的形态在立体显微镜下得以显示,以此来研究多肽处理对心房心室发育的影响。结果显示,WT组与NC组均能正常环化,心房心室呈S型,但PEP组心脏却未见明显环化(图4)。
2.5 qPCR检测多肽对心脏祖细胞分化的影响本研究对发育12 h的斑马鱼胚胎进行相关基因qPCR检测,包括祖细胞分化发育相关基因mef2c、nkx2.5和心脏房室发育相关基因amhc、vmhc。以WT组的各基因相对表达量为1,PEP组各基因的相对表达量amhc(0.37±0.05)、vmhc(0.248±0.072)、mef2c(0.092±0.014)、nkx2.5(0.56±0.127),各基因的表达出现不同程度的降低,P值分别为6.73E-04、1.85E-02、2.02E-05、1.08E-01,除nkx2.5,其余均小于0.05(图5),这说明多肽301LARSLKT307对于胚胎心脏发育的影响,从心脏祖细胞时期的细胞分化就已经有影响,但对于mef2c的影响作用强于对nkx2.5的影响。
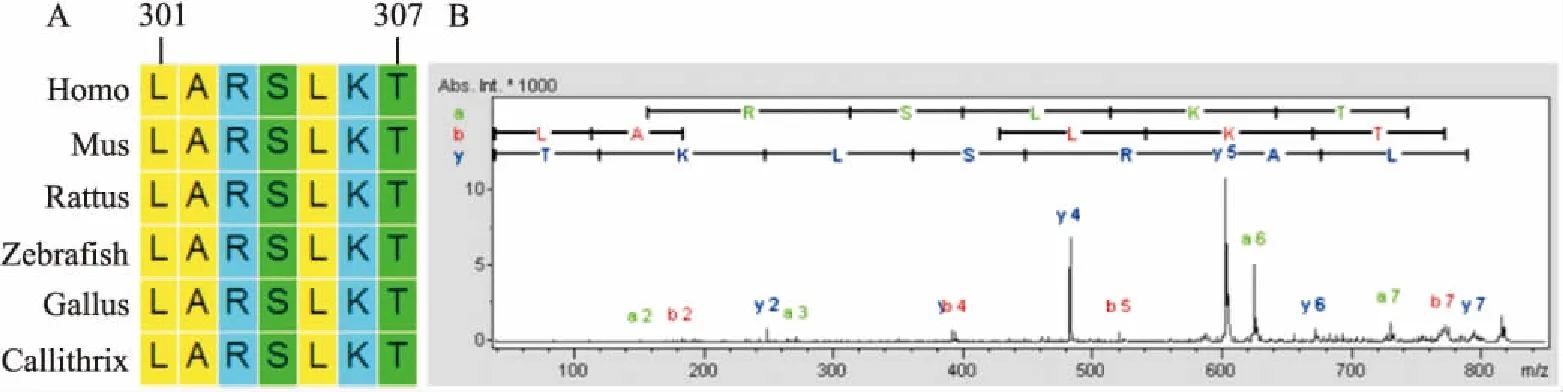
图1 多肽301LARSLKT307生物学基本特征分析
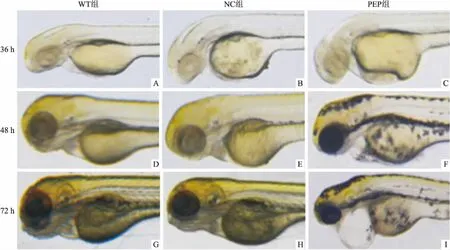
图2 多肽301LARSLKT307处理对斑马鱼心脏发育的影响 ×120
A、D、G:野生型斑马鱼发育的大体形态;B、E、H:对照多肽处理对斑马鱼发育大体形态的影响;C、F、I:实验多肽处理对斑马鱼心包水肿的影响
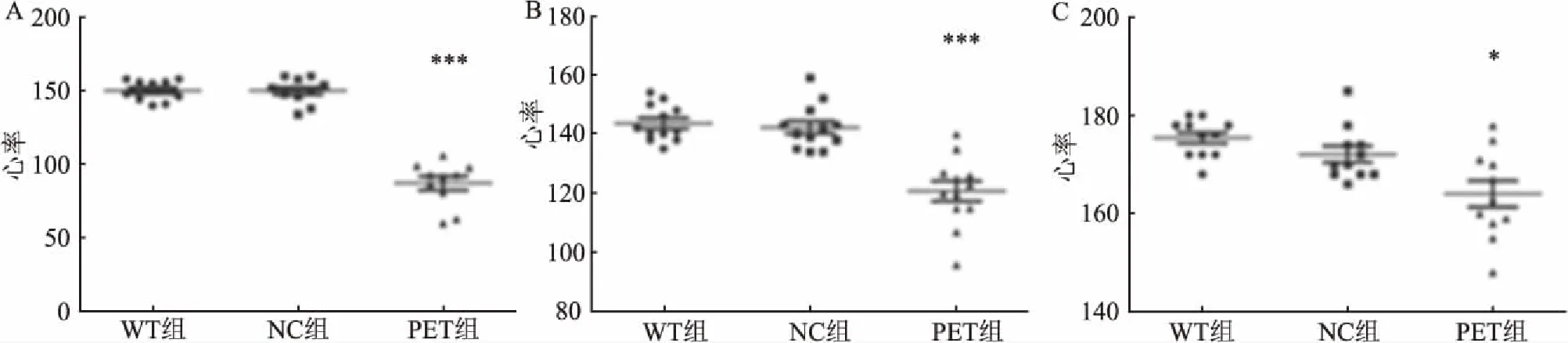
图3 多肽301LARSLKT307对斑马鱼心率的影响
3 讨论
多肽能够影响心脏的发育与功能,对于治疗和预测心血管疾病有着巨大的潜力。多肽301LARSLKT307是在法洛四联症心脏组织中发现的一条TALIN-1来源的多肽。TALIN-1是细胞黏附的关键蛋白,对于维持心脏Z-盘稳定和内皮完整性是必要的[6]。且这条多肽位于起支撑和调节细胞膜的组装和稳定作用的B41结构域中。多肽301LARSLKT307所处的前体蛋白及其结构域,对于心脏的功能及结构的影响均已有文献报道。但是由TALIN-1蛋白的结构域剪切所产生的多肽对于心脏的发育与功能是否存在影响,还没有相关研究。本课题组在斑马鱼发育1细胞期,通过显微注射构建多肽301LARSLKT307处理的斑马鱼胚胎实验模型。生物信息学分析显示这条多肽是脂溶性较强的多肽,易于进入细胞内,是多肽可能在细胞内发挥功能的前提条件。虽然这条多肽的半衰期为5.5 h,但斑马鱼的心脏发育是一个连续而协调的过程,造成的影响可能是长期而深远的。根据研究结果,PEP组的斑马鱼胚胎出现心率降低、心包水肿、心脏的环化及祖细胞的分化受到影响。这些都提示这条多肽能够影响斑马鱼心脏的发育及功能的行使。
心脏的泵血功能受心率及每搏输出量影响。本研究显示,与WT组及NC组比较,PEP组的斑马鱼出现心率下降的情况,差异有统计学意义。心包水肿会使得心包腔内压力增大,妨碍房室的舒张充盈,使得每搏输出量降低。心率降低与心包水肿综合作用,使得心脏每分搏出量更加降低,影响心脏泵血功能,说明多肽能够影响心脏的功能。
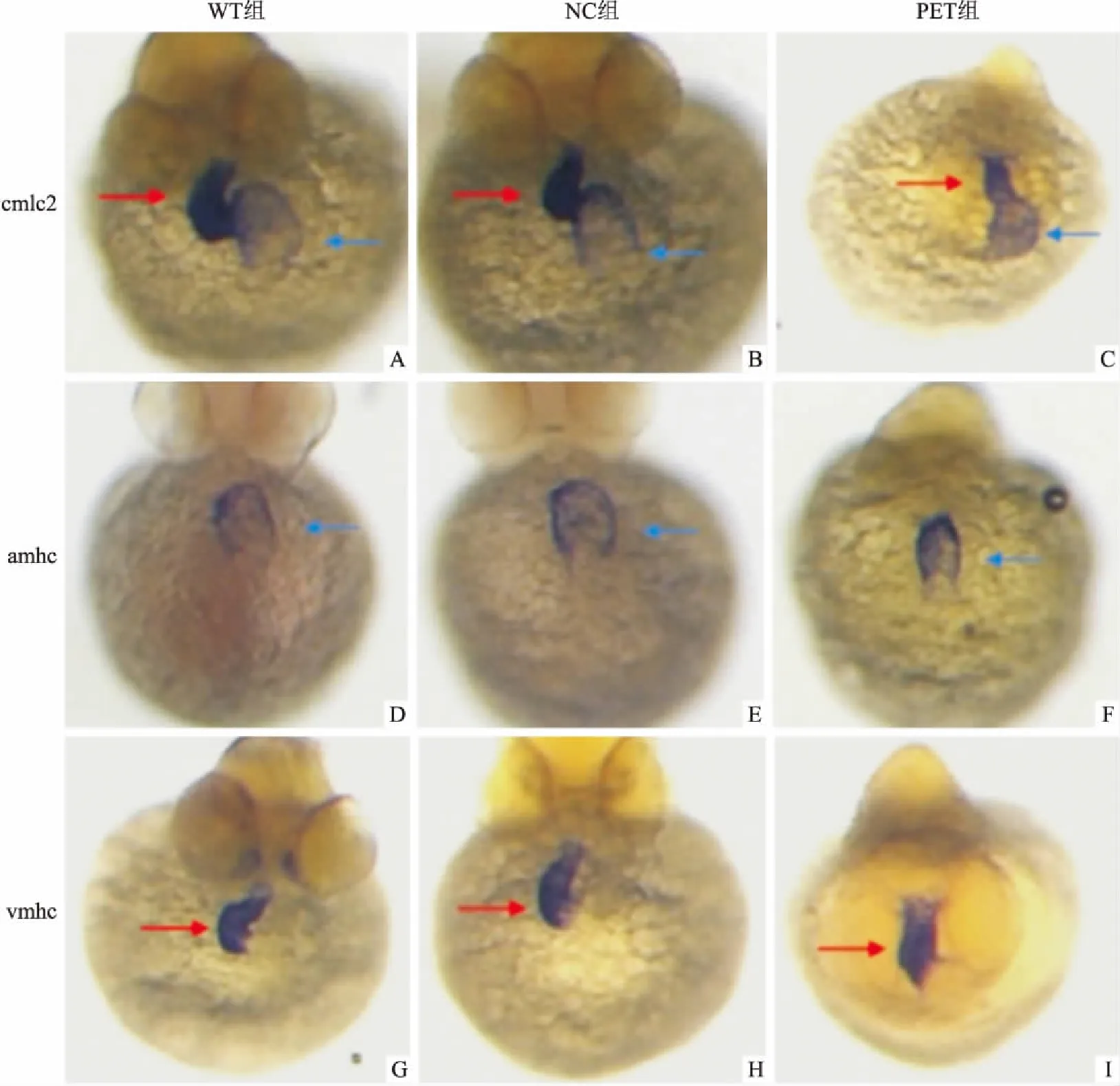
图4 原位杂交观察多肽注射对于心脏房室环化的影响 ×120

图5 qPCR检测多肽对12 h时斑马鱼胚胎心脏发育相关基因的影响
1:amhc;2:vmhc;3:mef2c;4:nkx2.5;与WT组比较:*P<0.05,***P<0.001
斑马鱼心脏的发育是一个复杂的过程,包括胚胎前端中轴两侧的侧板中胚层细胞(祖细胞)分化成心脏前体细胞、前体细胞向中轴迁移汇聚、融合成原始心管、房室分化完成、心脏环化和瓣膜的发生与成熟[7]。其中,心脏环化为多腔室器官的形成提供条件,是脊椎动物心脏发育过程中关键的形态发育事件,法洛四联症的出现与心脏的环化异常高度相关[8]。心脏环化异常可导致房室间隔发育延迟,动脉干未及时反向转动及位置异常,因而导致心腔和血管之间组装出现问题,这是法洛四联症出现的重要病理机制。原位杂交是一种应用标记探针与组织细胞中的待测核酸杂交,再应用标志物相关的检测系统,在核酸原有的位置将其显示出来的一种检测技术。本研究选用cmlc2、vmhc和amhc这些在斑马鱼心脏房室特异性表达的基因探针进行原位杂交,来观察心脏的发育。cmlc2是心肌轻链2型,特异性在整个心脏表达;vmhc是心室肌球蛋白重链基因,特异性在心室表达;amhc是心房肌球蛋白重链基因,特异性在心房表达,是心房肌的分化标志物。研究[5]表明正常斑马鱼胚胎在48 h心脏环化已经完成,心房心室呈S型。本研究显示胚胎发育48 h时,PEP组的斑马鱼心脏环化尚未完成,证实多肽301LARSLKT307能影响斑马鱼胚胎心脏的环化,说明该多肽对于心脏的结构也存在影响。
为了进一步深入了解多肽301LARSLKT307对心脏功能和结构影响的机制,本实验对心脏祖细胞分化发育相关基因mef2c、nkx2.5及房室发育相关基因amhc、vmhc进行检测。nkx2.5是前部侧板中胚层心脏祖细胞分化的标记基因[9]。mef2c是最早在心脏中表达的mef2家族基因,与nkx2.5一起促进心肌细胞的分化[10]。实验发现,PEP组中这些基因的表达较野生型组及NC组降低,说明多肽301LARSLKT307对于斑马鱼胚胎心脏房室发育的影响,是从心脏祖细胞时期就已经存在,且可影响心脏祖细胞的分化。祖细胞的分化程度降低可能是房室发育异常的原因,而心率的减慢及心脏环化的异常也可能与心脏祖细胞的分化受阻相关。
综上所述,法洛四联症来源的多肽301LARSLKT307能够在胚胎期显著抑制心脏的发育与功能,这可能是通过影响心脏祖细胞的分化所导致。本研究为深入探讨多肽在心脏发育及功能中的影响奠定了基础,同时也为先天性心脏病的早期诊断和治疗提供了新的靶点和思路。
