高产L-精氨酸谷氨酸棒状杆菌的构建
2019-06-11蔡柠匀张德志赵桂红徐庆阳
王 婷,蔡柠匀,张德志,赵桂红,徐庆阳,2,3,陈 宁,2,3*
(1.天津科技大学 生物工程学院,天津 300457;2.天津科技大学 代谢控制发酵技术国家地方联合工程实验室,天津 300457;3.天津科技大学 教育部工业发酵微生物重点实验室,天津 300457)
L-精氨酸(L-arginine)属于碱性氨基酸,是人体半必需氨基酸,其在生物体内具有重要的生理功能[1-5],如治疗心血管疾病、调节激素分泌、促进生殖系统发育、提高免疫力等,在食品、药品、化妆品行业广泛应用,市场需求量大。
L-精氨酸的生产方法主要有化学合成法和微生物发酵法[6]。化学法合成精氨酸过程复杂,会产生有毒物质污染环境,而微生物发酵法具有环保、反应条件温和和生产过程稳定的优点。随着谷氨酸棒状杆菌(Corynebacterium glutamicum)全基因组测序及基因功能注释的完善,通过基因工程手段定向改造C.glutamicum生产氨基酸越来越受重视。目前,已有许多菌株重构、改良菌株生产特性、提高L-精氨酸产量的相关报道。占米林[7]通过串联表达pntAB和ppnK基因对C.glutamicum SNK118关键辅酶进行调节,解除argR和farR反馈阻遏,L-精氨酸的积累量为67.01 g/L,糖酸转化率为0.35 g/g;PARK S H等[8]将C.glutamicum AR1中的阻遏蛋白基因argR和farR敲除后,L-精氨酸的积累量提高到61.9g/L;DOUW等[9]采用质粒过表达的方式在C.crenatum SYPA5-5中过表达关键基因argJ,使L-精氨酸的产量提高16.8%;IKEDA M等[10]敲除C.glutamicum ATCC 13032中的argR基因,过表达定点突变的argB基因,L-精氨酸产量增加到52.0 g/L。
本研究以一株高产L-精氨酸的诱变谷氨酸棒状杆菌AJC为出发菌株,采用基因组编辑技术[11],首先敲除阻遏蛋白ArgR和FarR,解除反馈阻遏;然后敲除乳酸脱氢酶编码基因ldh和整合鸟氨酸乙酰转移酶编码基因argJ,阻断乳酸合成途径和增加前体物的生成;最后敲除谷氨酸分泌蛋白编码基因NCgl1221和整合乙酰谷氨酸激酶编码基因argB,获得高产L-精氨酸C.glutamicum重组菌株。目前已报道的L-精氨酸生产菌株多是用质粒过表达关键基因的方式,但质粒的存在会造成菌株产酸稳定性差、抗生素残留及操作复杂的问题。因此本研究开发的无质粒高产氨基酸生产菌株将具有良好的应用价值。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
本研究所用菌株见表1。

表1 本研究所用菌株Table 1 Strains used in the study
1.1.2 引物
本研究所用引物序列见表2。

表2 本研究所用引物Table 2 Primers used in the study

续表
1.1.3 培养基
LB培养基:胰蛋白胨10 g/L,酵母粉5 g/L,NaCl 5 g/L,121℃灭菌20 min。
脑心浸液培养基(brian heart infusion,BHI):脑心浸液37.5 g/L,121℃灭菌20 min。
活化斜面培养基:蛋白胨10.0 g/L,牛肉膏10.0 g/L,酵母粉5.0 g/L,NaCl 2.5 g/L,琼脂20.0 g/L,玉米浆15.0 mL/L,pH 7.0~7.2,121℃灭菌20 min。
种子培养基:葡萄糖35.0g/L,玉米浆30.0mL/L,酵母粉5.0g/L,豆粕水解液20.0mL/L,KH2PO41.5g/L,MgSO4·7H2O 0.5 g/L,VB11.0 mg/L,FeSO4·7H2O 10 mg/L,MnSO4·H2O 10 mg/L,VH 0.2 mg/L,pH 7.0~7.2,121 ℃灭菌20 min。
发酵培养基:葡萄糖100.0 g/L,玉米浆35.0 mL/L,(NH4)2SO410.0 g/L,豆粕水解液25.0 mL/L,KH2PO42.0 g/L,MgSO4·7H2O 0.7 g/L,VB11.0 mg/L,FeSO4·7H2O 10 mg/L,MnSO4·H2O 10 mg/L,VH 0.1 mg/L,pH 7.0~7.2,121 ℃灭菌20 min。
BHIS复苏液:脑心浸液37.5 g/L,葡萄糖 5 g/L,115 ℃灭菌15 min。
1.1.4 试剂
Primer STARHS脱氧核糖核酸(deoxyribonucleic acid,DNA)polymerase(2.5 U/μL)、QuickCut限制性内切酶(120 U/μL):大连宝生物工程有限公司;Taq聚合酶链式反应(polymerasechainreaction,PCR)MasterMix、Clone ExpressRⅡOne Step Cloning Kit:南京诺维赞生物工程有限公司;质粒提取及DNA回收试剂盒:上海Omega Bio-tek公司;质粒pK18mobrpsl:本实验室保藏。
1.2 仪器与设备
Mastercycler nexus PCR仪、Eppendorf Eporator电击转化仪:德国Eppendorf公司;GL20A高速冷冻离心机:日本日立有限公司;UV200紫外可见波长检测器:美国Laballiance公司;Agilent 1200高效液相色谱(high performance liquid chromatography,HPLC)仪:安捷伦科技(中国)有限公司;SCD-II高纯水装置:美国Millipore公司。
1.3 方法
1.3.1 质粒构建与转化
以谷氨酸棒状杆菌基因组为模板,分别采用引物对ArgR-1和ArgR-2、ArgR-3和ArgR-4进行PCR扩增,再经重叠延伸PCR得到重叠DNA片段。使用限制性核酸内切酶Kpn I和Xba I对质粒pk18mobrpsl、重叠DNA片段进行酶切后,使用Clone ExpressRⅡOne Step Cloning Kit同源重组酶连接,获得重组质粒pk18mobrpsl-ΔargR。PCR扩增体系:5×PS Buffer 10 μL、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)mixture(10 mmol/L)4 μL、上下游引物各2μL、DNA模板约200 ng、HS酶(5 U/μL)0.5 μL、双蒸水(ddH2O)补充至50 μL。PCR扩增条件:95℃预变性5 min;98℃变性10 s,适当退火温度下退火15 s,72℃延伸适当时间(1min延伸约1kbp),30个循环;72℃再延伸10 min。
采用同样的方法和模板,构建重组质粒pk18mobrpsl-ΔfarR(farR的上下游同源臂引物为FarR-1和FarR-2、FarR-3和FarR-4)、pK18mobrpsl-Δldh::P tufargJ(ldh的上下游同源臂引物为LDH-1和LDH-2、LDH-7和LDH-8;P tuf和argJ的上下游引物分别为LDH-3和LDH-4、LDH-5和LDH-6)、pK18mobrpsl-ΔNCgl1221::P sodargB(NCgl1221的上下游同源臂引物为B-1和B-2、B-7和B-8;P sod和argB的上下游引物为B-3和B-4、B-5和B-6)。
采用CaCl2介导的化学转化法[12]将体外重组体系加至E.coli DH5α感受态细胞中,冰浴20 min,42℃热激1 min,加入900 μL的LB液体培养基,在37℃、220 r/min条件下复苏1 h,涂布于添加相应抗性的LB培养基平板中,37℃培养12 h,PCR鉴定后筛选正确转化子,将其转接至LB液体培养基(添加相应抗性),37℃过夜培养,收集菌体,按照质粒提取试剂盒说明书提取重组质粒。
1.3.2 重组菌株的构建
菌株基因组的编辑采用pK18mobrpsl无痕编辑系统[11]。采用电转化法将上述构建的重组质粒与谷氨酸棒状杆菌AJC感受态细胞混合后加入电转杯,冰浴20 min,电击,加BHIS复苏液,46℃水浴热激6 min,32℃、220 r/min条件下复苏2 h,涂布于添加相应抗生素的BHI培养基的平板,32℃过夜培养,通过菌株两轮单双交换,PCR鉴定后筛选获得重组菌株。
1.3.3 摇瓶发酵培养
使用斜面活化培养基,将菌体传代两次。取两环活化的菌体接种于种子培养基,装液量为30 mL/500 mL,32℃、220r/min条件下培养12h,OD600nm值约为15。再按10%(V/V)的接种量将种子液接种于发酵培养基,装液量为30mL/500mL,32℃、220 r/min条件下培养64 h,定时取样检测发酵液中L-精氨酸的含量。
1.3.4 发酵罐培养
将斜面活化的菌体接于装有60 mL种子培养基的1 L三角瓶中,32℃、220 r/min条件下培养16 h作为一级种子液。再将一级种子按10%的接种量接于装有种子培养基的二级种子罐(2 L)中,装液量为1.2 L/2 L,32℃、溶氧量20%~30%条件下培养至OD600nm值=14,作为二级种子液。按15%的接种量将二级种子接种于装有发酵培养基的5 L发酵罐中,装液量为3 L/5 L,发酵条件同二级种子罐;连续流加25%氨水,pH约7.0;按照一定的流加速率,补加80%的葡萄糖溶液,残糖量维持在1%~1.5%。
1.3.5 测定方法
菌体浓度的测定:在发酵过程中,定时取样、稀释后,使用紫外分光光度计测定其在波长600 nm处的吸光度值。
葡萄糖含量的测定[13]:使用生物传感仪测定葡萄糖含量。L-精氨酸[14]、L-谷氨酸[15]和乳酸[16]含量的测定:采用高效液相色谱法。
2 结果与分析
2.1 连续敲除基因argR和farR对L-精氨酸产量的影响
L-精氨酸的操纵子包含argCJBDFR和argGH两部分,阻遏蛋白ArgR[17]会结合到这两个操纵子上,降低这些基因的转录水平。此外,阻遏蛋白FarR[18]也会结合到arg的操纵子以及gdh基因的上游区域,导致基因表达量下降。为解除阻遏作用,增加L-精氨酸合成途径的通量,将基因argR和farR连续敲除,构建解除反馈阻遏的敲除菌株AJC-1和AJC-2,并以出发菌株AJC作为对照组,经摇瓶发酵64 h后,测定发酵液中L-精氨酸的含量和菌体的OD600nm值,结果见图1。

图1 菌株AJC、AJC-1和AJC-2的OD600 nm值及L-精氨酸产量Fig.1 OD600 nm value and L-arginine production of strain AJC,AJC-1 and AJC-2
由图1可见,与出发菌株AJC相比,菌株AJC-1和AJC-2的OD600nm值(38.5、37.0)分别降低3.8%、7.5%;L-精氨酸产量(28.1 g/L、30.3 g/L)分别提高6.4%和14.8%。结果表明,连续敲除基因argR和farR,重组菌株比出发菌株的生长略微变慢,但L-精氨酸的产量有了逐步提高。由此可见,解除出发菌株AJC的反馈阻遏作用后,促进了L-精氨酸的合成。
2.2 敲除基因ldh及强化关键基因argJ对L-精氨酸产量的影响
乳酸是L-精氨酸合成途径中的代谢副产物,乳酸的合成会消耗大量能量和前体物丙酮酸,降低L-精氨酸的产量。为了减少副产物的积累、加强主要代谢通路碳代谢流[19],削弱乳酸途径对L-精氨酸合成的关键前体丙酮酸的竞争,可通过敲除基因ldh[20]的方式解决。此外,亦可强化关键基因argJ的表达,提高L-谷氨酸到L-精氨酸的转化能力[21]。因此,在菌株ARG-2的基础上敲除ldh,同时在该位点整合L-精氨酸合成的关键基因argJ,获得的重组菌株ARG-3。以出发菌株AJC作为对照组,经摇瓶发酵64 h后,测定发酵液中的L-精氨酸含量、乳酸含量和菌体的OD600nm值,结果见图2。

图2 菌株AJC和AJC-3的OD600 nm值、L-精氨酸产量和乳酸含量Fig.2 OD600 nm value,L-arginine production and lactic acid content of strain AJC and AJC-3
由图2可见,与出发菌株AJC相比,菌株AJC-3的OD600nm值(37.0)、乳酸积累量(0.1 g/L)分别下降7.5%、97.7%,L-精氨酸产量(32.1 g/L)提高21.6%。说明敲除基因ldh阻断了乳酸途径,进而阻止了该副产物的合成。由此可见,强化关键酶的表达,减少副产物途径对碳源和前体物的消耗,对L-精氨酸的积累起到积极作用。
2.3 敲除基因NCgl1221及强化关键基因argB对L-精氨酸产量的影响
谷氨酸棒状杆菌中基因NCgl1221编码谷氨酸分泌蛋白[8]。为了减弱L-谷氨酸的胞外分泌,增加L-精氨酸发酵前体物的积累量,在菌株ARG-3的基础上敲除基因NCgl1221,同时在该位点整合L-精氨酸的关键基因argB,最终达到增加L-精氨酸产量的目的。因此,构建重组菌株ARG-4并进行摇瓶发酵,以出发菌株AJC作为对照组,经摇瓶发酵64 h后,测定发酵液中的L-精氨酸含量、L-谷氨酸含量和菌体的OD600nm值,结果见图3。
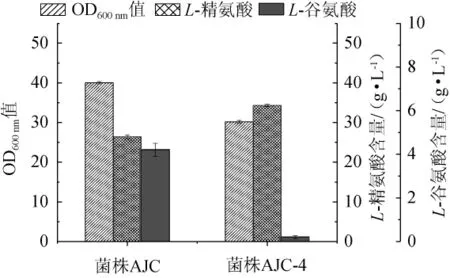
图3 菌株AJC和AJC-4的OD600 nm值、L-精氨酸产量和L-谷氨酸含量Fig.3 OD600 nm value,L-arginine production and L-glutamic content of strain AJC and AJC-4
由图3可见,与出发菌株AJC相比,菌株AJC-4的OD600nm值(30.2)和L-谷氨酸的积累量(0.2 g/L)分别下降24.5%、95.2%,L-精氨酸产量(34.3 g/L)提高29.9%。结果表明,敲除NCgl1221基因和过表达关键基因argB后,有效地减少了副产物积累和提高了关键基因的表达水平,进而提高了菌株的L-精氨酸产量。
2.4 谷氨酸棒状杆菌AJC和AJC-4的分批补料发酵
2.4.1 菌体的OD600nm值、残糖量和L-精氨酸产量的测定结果
为了进一步验证重组菌株AJC-4生产L-精氨酸的能力,以出发菌株AJC为对照,对两株菌进行分批补料发酵,菌体的OD600nm值、残糖量和L-精氨酸产量测定结果如图4所示。
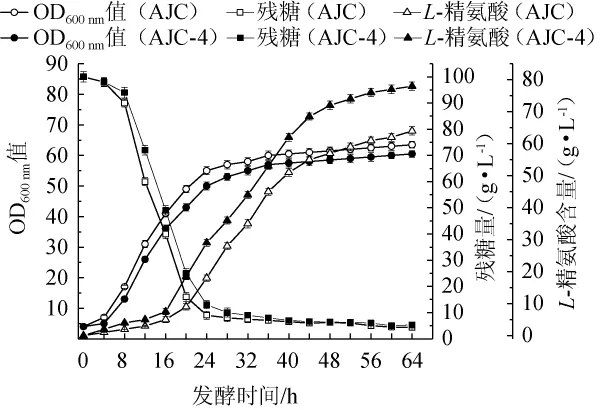
图4 分批补料发酵过程中菌株AJC和AJC-4的OD600 nm值、残糖量和L-精氨酸产量的测定结果Fig.4 Determination results of OD 600 nm value,residual sugar content and L-arginine production of strain AJC and AJC-4 during fed-batch fermentation processes
由图4可知,分批补料发酵过程中,对照菌株AJC和重组菌株AJC-4的OD600nm值、残糖量和L-精氨酸产量的变化趋势基本相同。菌体的对数生长期为0~24 h,之后菌体的生长趋于稳定;发酵0~24 h,葡萄糖含量快速下降,说明处于对数生长期的菌体需要获取大量的碳源,消耗大量的葡萄糖,满足自身快速生长的需要;发酵24 h后,残糖量<2.0%,然后通过流加80%的葡萄糖溶液,始终控制残糖量在1.0%~1.5%。在发酵前期(0~20 h),菌体处于生长阶段,L-精氨酸产量非常少,当菌体生长接近稳定期后,L-精氨酸的产量开始快速积累,在发酵64 h时,菌株AJC和AJC-4的L-精氨酸的产量均达到最大值,分别为64 g/L、78 g/L。然而,菌株AJC-4的OD600nm值始终低于出发菌株AJC,说明菌株在进行基因组编辑后,一定程度上影响了菌株的生长;重组菌株AJC-4消耗葡萄糖的速度明显慢于出发菌株AJC,说明改造后菌株可减少碳源的消耗;重组菌株AJC-4的L-精氨酸产量(78.0g/L)较出发菌株AJC(64.0g/L)提高了21.9%。此外,在菌株正常生长的情况下,重组菌株AJC-4的糖酸转化率为0.38 g/g,高于出发菌株AJC(0.32 g/g),提高了18.8%。
2.4.2 乳酸和L-谷氨酸含量的测定结果
菌株AJC、AJC-4在5 L发酵罐中分批补料发酵64 h后,测定发酵液中的乳酸和L-谷氨酸的积累量,结果如图5所示。
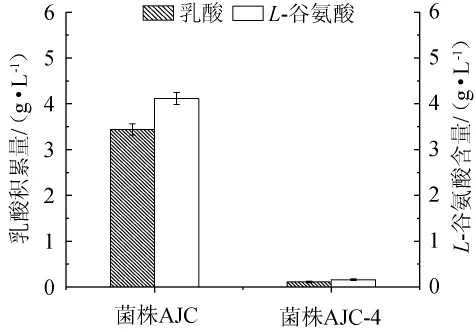
图5 分批补料发酵过程中菌株AJC和AJC-4的副产物积累量Fig.5 By-product accumulation of strain AJC and AJC-4 during fed-batch fermentation processes
由图5可知,在敲除ldh和NCgl1221基因后,乳酸和谷氨酸的分泌几乎降为零。说明成功阻断乳酸合成途径和谷氨酸分泌蛋白的合成,有效地消除了副产物的积累和分泌。
3 结论
本研究以产L-精氨酸的诱变菌株谷氨酸棒状杆菌AJC为出发菌株,通过基因敲除和基因整合,阻断副产物乳酸和L-谷氨酸的积累,构建了一株L-精氨酸高产菌株AJC-4。菌株AJC-4经分批补料发酵64 h后,L-精氨酸产量和糖酸转化率分别为78.0 g/L和0.38 g/g,较出发菌株AJC分别提高21.9%、18.8%;副产物乳酸和L-谷氨酸积累量分别为0.11g/L、0.16 g/L,较出发菌株AJC分别降低96.8%、96.1%。选育生产稳定和产酸能力强的生产菌株具有巨大的工业生产应用潜力。
