南山牧场牛乳中具有抑菌活性乳酸菌的筛选及鉴定
2019-06-11吴诗敏雷文平游善兵宋艳菲刘成国
吴诗敏,雷文平,2,周 辉,2,游善兵,吴 霓,宋艳菲,刘成国,2*
(1.湖南农业大学 食品科技学院,湖南 长沙 410128;2.湖南农业大学 食品科学与生物技术湖南省重点实验室,湖南 长沙 410128;3.湖南南山牧业有限公司,湖南 城步 422599)
随着消费者食品安全意识的增强,研究开发安全的生物性抑菌剂具有十分重要的意义。近年来研究发现,某些乳酸菌菌株具有抑菌活性,能产生抑菌物质,抑制各种致病菌的生长,可作为天然的生物防腐剂用于食品中,提高食品品质,保障食品的安全性[1]。
乳酸菌(lactic acid bacteria,LAB)为一般认为安全(generally recognized as safe,GRAS)微生物,被广泛应用于食品工业中[2-3]。其中,乳酸乳球菌(Lactococcal lactis)是乳酸菌的一个重要菌属,广泛应用于乳制品,已被列入欧洲食品安全局建立的安全资格认证(qualified presumption of safety,QPS)清单[4]。辛灵莹[5]从乳酸乳球菌发酵液中成功提取出具有抗氧化能力的胞外多糖,该胞外多糖可提高小鼠血液和主要脏器的抗氧化酶活性,对衰老小鼠有很好的保护作用。研究表明,某些乳酸乳球菌可产乳酸菌素,即此类细菌代谢过程中通过核糖体合成机制产生的一类具有抑菌活性的多肽或蛋白质类物质,其除了具有能被人体内的蛋白酶降解、不在体内蓄积等优点之外,还具有较好的稳定性及适合工业化生产的特点,因而在开发食品天然防腐剂领域有广阔的应用前景[6-7]。倪萍等[8]从土壤中分离出一株具有较宽抑菌谱的乳酸乳球菌,对冷却猪肉具有明显的保鲜效果,可显著减少其腐臭味。目前国内针对乳酸菌菌种的筛选主要集中在平原牧场或北方高原地区,而对中国南方高海拔地区具有抑菌性的乳酸乳球菌的研究报道较少。
湖南南山牧场被誉为“南方的呼伦贝尔”,为亚热带山地季风湿润气候,夏无酷暑,冬无严寒,空气新鲜,土壤、大气、水质无任何污染和公害,极适宜微生物生长繁殖[9]。本研究拟从湖南省南山牧场的鲜奶中分离筛选产细菌素乳酸菌,采用形态观察及分子生物学技术对菌株进行鉴定,并对细菌素的成分及pH、温度、NaCl耐受性进行研究,旨在分离筛选出能在食品中添加的,具有抑菌作用的乳酸菌。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
鲜牛奶:南山牧业有限公司不同挤奶站的贮藏罐;李斯特菌(Listeria):湖南农业大学食品科技学院实验室提供。
1.1.2 试剂
M17固(液)体培养基:青岛海博生物技术有限公司;过氧化氢酶(2 000~5 000 U/mg):上海瑞永生物科技有限公司;胃蛋白酶(3000~3500U/g)、胰蛋白酶(≥50000U/g):国药集团化学试剂有限公司;木瓜蛋白酶(≥800 U/mg):上海陆广生物科技有限公司;碱性蛋白酶(≥200 U/mg):江苏锐阳生物科技有限公司;NaOH、NaCl、磷酸盐缓冲液:均为国产分析纯试剂;革兰氏染色液:广东环凯微生物科技有限公司。细菌脱氧核糖核酸(deoxyribonucleic acid,DNA)基因组提取试剂盒、pfu高保真聚合酶、琼脂糖凝胶回收试剂盒:天根生化科技(北京)有限公司。
1.2 仪器与设备
GZ-400-S恒温培养箱:韶关市广智科技设备有限公司;SW-CJ-2D双人单面垂直净化工作台:苏州净化有限公司;LDZX-50KBS立式压力蒸汽灭菌器:上海中安医疗器械厂;601超级恒温水浴锅:金坛市医疗仪器厂;TG16-WS台式高速离心机:湖南湘仪实验室仪器开发有限公司;牛津杯(内径6.0 mm、外径7.8 mm、高10.0 mm):上海新睿生物科技有限公司;Tprofessional standard 96 Gradient聚合酶链式反应(polymerase chain reaction,PCR)仪:德国Biometra公司;BH-2光学显微镜:日本Olympus公司。
1.3 方法
1.3.1 乳酸菌的分离
在无菌的条件下,取25 mL鲜牛奶样品加入225 mL无菌生理盐水中,振荡均匀,以10倍系列稀释,稀释度为10-1~10-6。分别取不同稀释度的稀释液涂布于M17固体培养基,37℃培养48 h。挑取典型乳酸菌菌落进行革兰氏染色,选取革兰氏阳性菌,分别接种于装有5 mL M17液体培养基的试管中,37℃静置培养24 h,将乳酸菌编号后于M17固体培养基上三代划线纯化,保存待用。
1.3.2 具有抑菌特性乳酸菌的分离筛选
将划线纯化后保存的菌株接种于装有5 mL M17液体培养基的试管中,37℃静置培养24 h。发酵液经8 000 r/min离心3 min,取上清液。
采用牛津平板法测定菌株是否具有抑菌活性[10]:将活化后的李斯特指示菌与加热融化的固体培养基混匀,使菌落终浓度至107CFU/mL,倾注约15 mL于无菌平皿中,待培养基凝固后,放入牛津杯,取200 μL上清液加入牛津杯,4℃条件下扩散4 h后,37℃条件下培养10 h,观察抑菌圈。采用十字交叉法测量抑菌圈直径,以未接种的培养基上清液作为空白对照,重复3次。当抑菌圈直径≥4.0 mm视为有抑菌作用[11-13]。
1.3.3 具有抑菌特性乳酸菌的鉴定
形态观察:将筛选后得到的菌株接种于M17固体培养基,37℃静置培养24 h,观察菌落形态,并进行革兰氏染色,在光学显微镜下观察细胞形态。
分子生物学鉴定:挑选具有抑菌特性的菌株接种于M17液体培养基,在37℃条件下静置培养24 h,取菌液1 mL,10 000 r/min离心2 min,弃上清液,收集菌体。采用DNA提取试剂盒提取DNA,以其为模板,对菌株的16S rDNA进行PCR扩增。PCR扩增体系:引物27F 1 μL,引物1492R 1 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)1μL,pfu Buffer 5μL,pfu酶0.25μL,加双蒸水(ddH2O)至50 μL。PCR扩增条件:98℃预变性5min;95℃变性35 s,55℃退火35s,72℃延伸1min,35个循环;72℃再延伸4 min。PCR扩增产物经0.8%琼脂糖凝胶电泳进行检测[14]。PCR产物经纯化后送至上海生工生物工程有限公司进行测序。测序结果在美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据库中进行Blast搜索,选取同源性较高的模式菌株,采用MEGA5.0中的邻接(neighbor joining,NJ)法构建系统发育树。
1.3.4 抑菌物质成分的初步鉴定
为进一步确定菌株所产抑菌物质的成分,发酵液经离心后,采用1 mol/L NaOH溶液调节上清液的pH至6.5~7.0,经0.22μm滤膜过滤去除菌体及杂质,得到无细胞发酵上清液。将无细胞发酵上清液通过以下几种方式进行处理:上清液中加入终质量浓度为5.0mg/mL的过氧化氢酶,于30℃水浴锅中温浴2 h,进行灭酶处理[15];向上清液中分别加入终质量浓度为1.0 mg/mL的胃蛋白酶、胰蛋白酶、木瓜蛋白酶和碱性蛋白酶,调节pH至各酶的最适作用范围,30℃水浴2 h后取出,再将pH调至6.5~7.0,确定其所产抑菌物质是否为多肽或蛋白质类物质。
取200 μL上述处理后的发酵上清液于牛津杯中,测量抑菌圈直径,重复3次。
1.3.5 pH对抑菌物质活性的影响
采用1 mol/L HCl和1 mol/L NaOH调节上清液pH值至2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0,上清液经0.22 μm滤膜过滤去除菌体及杂质后,以不同pH条件下未处理的无细胞发酵上清液作为空白对照,通过牛津杯平板法检测不同pH值作用后上清液的抑菌活性[16]。
1.3.6 温度对抑菌物质活性的影响
发酵上清液分别在37℃、60℃、80℃、100℃、121℃的温度条件下处理20 min,上清液经0.22 μm滤膜过滤去除菌体及杂质后,以25℃放置20 min处理的无细胞发酵上清液作为空白对照,冷却后通过牛津杯平板法检测不同温度处理后上清液的抑菌活性。
1.3.7 抑菌物质耐盐性的测定
发酵上清液中分别加入体积分数2%、4%、6%、8%、10%的1mol/LNaCl溶液,30℃水浴2h后取出,上清液经0.22μm滤膜过滤去除菌体及杂质后,以不加NaCl的无细胞发酵上清液作为空白对照,通过牛津杯平板法检测不同浓度盐处理后上清液的抑菌活性。
1.3.8 数据处理
每组试验结果以平均数±标准差(x¯±S)表示。运用Excel软件进行数据统计分析,以P<0.05水平为差异显著。
2 结果与分析
2.1 鲜牛奶中乳酸菌的分离结果
鲜牛奶样品中乳酸菌的分离结果见表1。

表1 乳酸菌的筛选结果Table 1 Screening results of lactic acid bacteria
由表1可知,从3个不同奶站的鲜牛奶样品中共分离得到28株乳酸菌,其中从鸡爪坪奶站分离出9株、比武冲奶站分离出11株、种牛队奶站分离出8株。分别编号为A11~A19、B11~B21、C11~C18。
2.2 具有抑菌活性乳酸菌的筛选结果
采用牛津杯平板法测定28株乳酸菌对李斯特菌的抑制效果,结果见表2。由表2可知,菌株A13、A18、B12、B16、B18、C11、C15均具有抑菌圈,其中菌株C15的抑菌圈直径最大,为6.17 mm,对李斯特菌的抑制效果最好。因此,选择菌株C15作为后续试验所用菌。
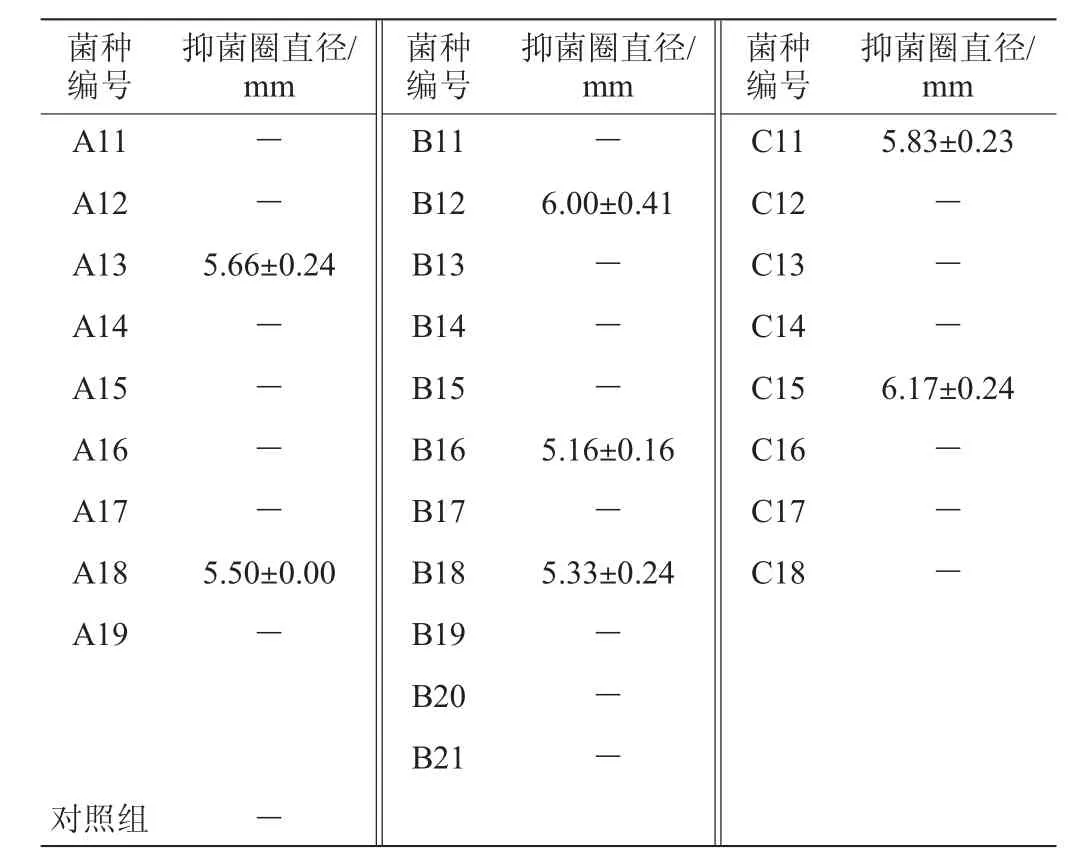
表2 具有抑菌活性乳酸菌的筛选结果Table 2 Screening results of lactic acid bacteria with bacteriostatic activity
2.3 菌株C15的鉴定
2.3.1 菌株C15的形态学鉴定
菌株C15的菌落形态及细胞形态见图1。

图1 菌株C15的菌落(A)和细胞(B)形态Fig.1 Colonial(A)and cell(B)morphology of strain C15
由图1A可知,菌株C15的菌落呈圆形凸起状、中等大小、微白色、表面光滑、边缘整齐、直径为(3±1)mm,菌落背面为黄色;由图1B可知,菌株C15的细胞为球形或卵圆形,单生或成对出现,成链状或无链状,革兰氏染色结果为阳性,因此,初步判定菌株C15为乳球菌属(Lactococcus)。
2.3.2 菌株C15的分子生物学鉴定
以菌株C15的总DNA为模板进行PCR扩增,PCR扩增产物碱基长度约1 409 bp,与目的碱基长度一致。PCR扩增产物经测序分析并构建系统发育树,结果见图2。
由图2可知,菌株C15与乳酸乳球菌(Lactococcal lactis)聚于一支,同源性达99%。因此,结合菌株C15的形态特征,将菌株C15鉴定为乳酸乳球菌(Lactococcal lactis)。

图2 基于16S rDNA基因序列菌株C15的系统发育树Fig.2 Phylogenetic tree of strain C15 based on 16S rDNA gene sequences
2.4 抑菌物质成分的初步确定结果
乳酸菌发酵上清液对李斯特菌有抑制作用,其抑菌活性物质可能是代谢合成的细菌素;也可能是酸性末端产物如乙酸、乳酸和其他有机酸的干扰;乳酸菌代谢产生的过氧化氢也可以抑制细菌的生长,尤其是抑制革兰氏阴性细菌的生长[17]。因此,需对菌株C15所产的抑菌物质成分进行确定。上清液分别经不同处理后的抑菌效果见表3。
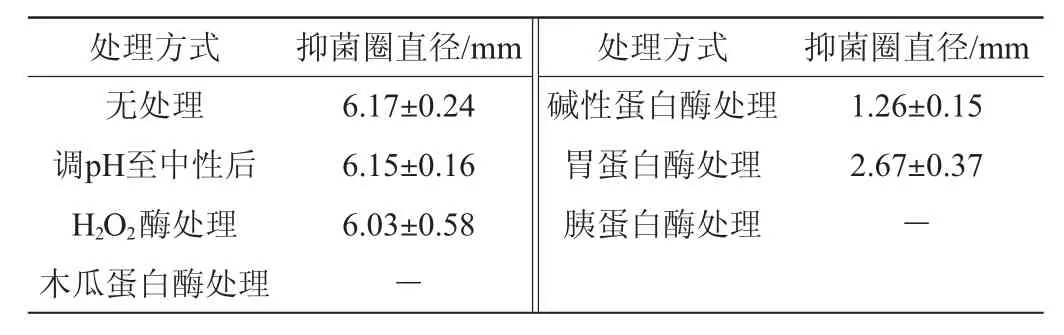
表3 抑菌物质成分初步鉴定结果Table 3 Preliminary identification results of bactericidal substance components
由表3可知,与无处理组(6.17 mm)相比,菌株C15发酵上清液在调pH至中性以及去除H2O2后,其抑菌直径无明显变化(P>0.05),说明酸和H2O2不是起主要抑菌作用的因素;经过胰蛋白酶和木瓜蛋白酶处理后,菌株C15发酵上清液失去抑菌活性,说明上述两种酶可使菌株C15所产的抑菌物质失活;发酵上清液经碱性蛋白酶和胃蛋白酶处理后仍具有抑菌活性,抑菌圈直径分别为1.26 mm、2.67 mm,但抑菌活性明显下降(P<0.05),即使上清液pH调回中性,其活力仍没有恢复。因此,可初步判定该菌株所产的抑菌物质为一种蛋白类或多肽类物质,这与唐春梅等[16,18]的研究结果相一致。此抑菌物质可被人体内的蛋白酶降解而不在体内残留,具有较高的安全性。
2.5 不同条件对抑菌物质活性的影响
2.5.1 pH对抑菌物质活性的影响
菌株C15发酵上清液经不同pH处理后,其对李斯特菌抑菌效果见图3。
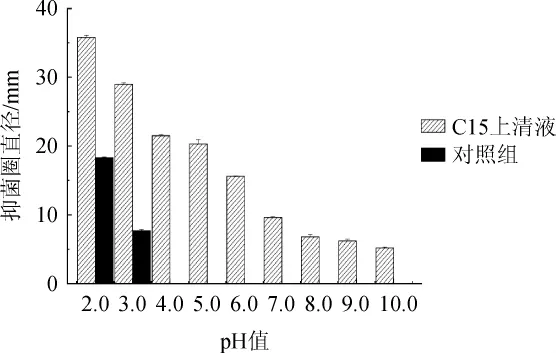
图3 pH值对菌株C15发酵液中抑菌物质抑菌活性的影响Fig.3 Effect of pH on the activity of antibacterial substances in the fermentation broth of strain C15
由图3可知,当pH为2.0~5.0时,抑菌活性普遍较强,抑菌圈直径为19.9 mm~35.7 mm,与对照组18.25 mm(pH=2.0)、7.75mm(pH=3.0)相比有显著差异(P<0.05);当pH为7.0~10.0时,上清液的抑菌圈直径均<9.3 mm;分析原因可能是在碱性条件下,pH值改变导致抑菌物质的蛋白质空间结构发生改变,使其活性降低。结果表明,菌株C15发酵上清液在酸性条件下活性较强,在中性及碱性条件下活性较弱,与大多数乳酸菌产的细菌素特性相似[19]。LÜ X等[20]研究发现,分离自中国传统发酵蔬菜中的乳酸菌所产的乳杆菌素MXJ32A能够抑制多种食源性致病菌,且具有很好的pH值耐受性和热稳定性。
2.5.2 温度对抑菌物质活性的影响
菌株C15的发酵上清液经不同温度处理后对李斯特菌的抑菌效果见图4。
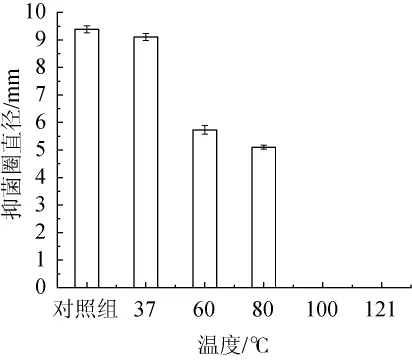
图4 温度对菌株C15发酵液中抑菌物质抑菌活性的影响Fig.4 Effect of temperature on the activity of antibacterial substances in the fermentation broth of strain C15
由图4可知,随着温度的升高,菌株C15发酵液中抑菌物质的抑菌活性逐渐下降,分析原因可能是高温使蛋白质或多肽失活,导致其所产抑菌物质的抑菌活性下降。发酵上清液经60℃处理20 min后,抑菌活性为对照组的61.96%;当处理温度为80℃时,抑菌圈直径为5.10 mm,抑菌活性为对照组的54.35%;当处理温度为100℃和121℃时,无抑菌圈,说明高温使菌株C15发酵上清液中抑菌物质失去抑菌活性。因此,菌株C15可适用于巴氏热杀菌处理后的鲜奶和其他无需高温处理的食品。
2.5.3 NaCl对抑菌物质活性的影响
发酵上清液经不同浓度的NaCl处理后对李斯特菌的抑菌效果见图5。
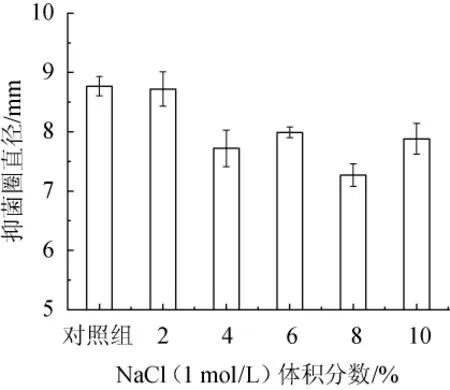
图5 1 mol/L NaCl体积分数对菌株C15发酵液中抑菌物质抑菌活性的影响Fig.5 Effect of NaCl(1 mol/L)concentration on the activity of antibacterial substances in the fermentation broth of strain C15
由图5可知,随着NaCl浓度的升高,菌株C15发酵上清液的抑菌活性逐渐减弱。当1 mol/L NaCl体积分数为2%时,抑菌圈直径对照组减少0.1 mm,说明菌株抑菌活性无显著变化(P>0.05);当1 mol/L NaCl体积分数为8%时,抑菌活性最低,抑菌圈直径为7.30 mm;当1 mol/L NaCl体积分数继续增加至10%时,抑菌圈直径为7.60 mm,分析原因可能是NaCl浓度过高,该环境自身对李斯特菌有抑制作用。结果表明,菌株C15发酵液中的抑菌物质在NaCl浓度较高条件下仍具有抑菌活性。因此,该抑菌物质具有良好的耐盐性。
3 结论
本研究从湖南南山高山牧场的鲜牛奶中共分离出28株乳酸菌,其中7株对李斯特菌具有抑菌活性,且菌株C15的抑菌能力最强,抑菌圈直径为6.17mm。通过形态观察和分子生物学技术,菌株C15被鉴定为乳酸乳球菌(Lactococcallactis),其所产的抑菌物质成分被初步判定为蛋白类或多肽类物质,该抑菌物质在酸性及中性条件下稳定,有较好的热稳定性和耐盐性,由于蛋白质类物质可被人体消化降解,不产生不良反应,安全性高,在食品工业中具有广泛应用前景。菌株C15所产具体抑菌物质及其抑菌谱还有待进一步研究,为开发天然、高效的生物防腐剂提供有价值的菌种资源。
