有机氮源对L-色氨酸发酵的影响
2019-06-11杜丽红徐庆阳尚永崇
杜丽红,张 震,徐庆阳*,陈 宁,尚永崇
(1.天津科技大学 生物工程学院,天津 300457;2.代谢控制发酵技术国家地方联合工程实验室,天津 300457;3.天津市氨基酸高效绿色制造工程实验室,天津 300457)
L-色氨酸属于芳香族氨基酸,是8种必需氨基酸之一[1]。因色氨酸对人和动物的生长发育、新陈代谢起着重要作用,已被广泛用于医药、食品与饲料等行业[2-5]。
随着生物技术的发展,利用微生物发酵法生产色氨酸得到全面推广[6-7]。微生物发酵法具有原料价格低廉、工艺控制简单、产品质量可靠等优点[8]。直接发酵法生产色氨酸离不开高产色氨酸的微生物菌株,但色氨酸合成途径复杂且受多种调控机制的调节[9-10],生产水平较低,很难在短时间内有较大突破,而发酵条件优化也逐渐受到人们关注,找到菌株的最适培养条件可发挥菌株的最大潜能。但随着发酵工业的快速发展,发酵法生产L-色氨酸对培养基营养成分和发酵调控的合理性提出了更高的要求[11]。优良的L-色氨酸生产菌株、合理的培养基组成和适当的发酵调控策略有利于提高L-色氨酸的产酸水平[12]。在培养基成分中,以富含各种氨基酸及其他营养物质的酵母粉作为氮源,被广泛应用于色氨酸的生产,黄静等[13]通过对多种有机氮源进行实验探究,确定了酵母粉为最适大肠杆菌发酵生产色氨酸的最佳氮源,但是酵母粉也含有一些蛋白质、色素等杂质,容易造成产酸波动[14-15],从种类繁多的酵母粉中选择出最适菌株的工作也很重要;氨基酸粉更多的是作为饲料添加剂使用,作为氮源应用于微生物发酵的研究还在起步阶段[16-17],应用于色氨酸发酵的研究还鲜见报道;氯化胆碱则可为细胞提供不稳定甲基,促进细胞生长代谢[18-19]应用于异亮氨酸发酵时[20],不仅可提高产量,亦可提高糖酸转化率。
本实验选择不同的有机氮源进行组合,并对其添加时间或添加量进行了研究,以期解决色氨酸发酵过程中遇到的各种问题。为提高大肠杆菌(Escherichia coli)TRP03积累色氨酸的能力,对酵母粉的种类进行了最优选择;为避免菌株因氮源切换(速效氮源被利用完毕,细胞开始分解有机氮源进行利用)而出现的细胞生长停滞期,尝试在培养基中添加氨基酸粉和氯化胆碱;为解决菌体早衰,提高中后期菌体活力,选择添加酵母粉、蛋氨酸和谷氨酰胺,并对添加时间进行了摸索,希望提高后期细胞产酸能力,进一步提高色氨酸产量。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
大肠杆菌(Escherichia coli)TRP03:天津科技大学代谢工程研究室。
斜面培养基:葡萄糖1 g/L,蛋白胨10 g/L,牛肉膏5 g/L,酵母粉5 g/L,NaCl 2.5 g/L,琼脂25 g/L,pH 7.0~7.2。
种子培养基:葡萄糖30 g/L,酵母粉6 g/L,(NH4)2SO41 g/L,KH2PO4g/L,柠檬酸0.5 g/L,MgSO4·7H2O 1.5 g/L,FeSO4·7H2O 2.8mg/L,维生素B1(vitamin B1,VB1)0.2mg/L,生物素 1 mg/L,MnSO4·H2O 1.2 mg/L,pH 7.0~7.2。
发酵培养基:葡萄糖10 g/L,酵母粉3 g/L,(NH4)2SO41 g/L,KH2PO44 g/L,柠檬酸2 g/L,MgSO4·7H2O 2 g/L,VB11.5 mg/L,FeSO4·7H2O 30 mg/L,生物素1 mg/L,MnSO4·H2O 10 mg/L,pH 7.0~7.2。
上述培养基均在115℃灭菌15 min。
1.1.3 化学试剂
葡萄糖:西王药业有限公司邹平分公司;(NH4)2SO4、K2HPO4·3H2O、MgSO4·7H2O、FeSO4·7H2O、NaOH:天津市光复科技发展有限公司;柠檬酸、MnSO4·H2O:国药集团化学试剂有限公司;氨基酸粉、蛋氨酸:上海阿拉丁生物科技有限公司;氯化胆碱:上海瑞永生物科技有限公司;酵母粉[Springer 0805(总氮11.3%总氨基酸58.0%)、Springer 0820(总氮11.8%总氨基酸61.4%)、Springer 2006(总氮10.3%总氨基酸41.36%)、Springer0203(总氮10.6%总氨基酸52.3%)、Springer 1203(总氮11.0% 总氨基酸54.3%)、NucelR889PA(总氮11.5%总氨基酸60.1%)、Springer 0835(总氮11.5%总氨基酸59.5%)、Springer LP0021(总氮10.0%~12.5%总氨基酸52%~62%)]:法国BioSpringer有限公司;LP0021酵母提取物:英国OXOID公司;氨基酸粉:山东恩沐生物有限公司;实验室所用化学试剂均为分析纯或生化试剂。
1.2 仪器与设备
LRH-250-A生化培养箱:广东省医疗器械厂;5 L离位灭菌发酵罐:上海保兴生物设备工程有限公司;LDZH-100KBS立式压力蒸汽灭菌器:上海申安医疗器械厂;V-1200型可见分光光度计:上海美谱达仪器有限公司;SBA-40E生物传感仪:山东省科学院研究所;UltiMate 3000高效液相色谱仪:美国Thermo Scientific公司;TCDA 161485活细胞在线检测仪:英国ABER公司;MQD-A3R高精度三层叠加式振荡培养箱:上海旻泉仪器有限公司。
1.3 方法
1.3.1 培养方法
位于北京市海淀区上庄镇白水洼路附近的有机蔬果园,自2002年创办至今,占地面积已达300亩。园内拥有11个日光温室,最多时每天可产出蔬果几十种,取名良之悦品。
菌株活化:于甘油管中取一环菌液涂布于一代斜面培养基中,置于37℃培养箱中静置培养12 h,于一代斜面培养基中取一环菌体活化于二代斜面培养基中,置于37℃培养箱中静置培养12 h。
菌悬液制备:将200 mL去离子水装于500 mL圆底烧瓶,121℃灭菌20 min,在无菌间将灭菌的去离子水倒入已活化好菌体的斜面培养基中,接种环将全部菌体轻轻刮起,再倒入圆底烧瓶中。
摇瓶培养方法:取一环菌体置于斜面培养基中37℃培养12 h,将活化好的菌株转接于种子培养基中,装液量为30 mL/250 mL,200 r/min、37℃摇床振荡培养12 h,然后按10%接种量转接于发酵培养基中,继续37℃、200 r/min培养发酵24 h,测定发酵液中目的产物L-色氨酸含量。发酵过程中,苯酚红为pH指示剂,控制pH值为7.0~7.2左右。
5 L离位灭菌发酵罐培养方法:种子培养基与摇瓶振荡培养基成分相同,取适量无菌水于斜面培养基中,用接种环将菌体轻轻刮起制成菌悬液,接入种子培养基中,控制pH值为7.0左右,发酵温度37℃,溶氧25%~35%,待细胞OD600nm值达到10~12。按15%~20%接种量接入新鲜的发酵培养基,发酵过程中通过流加氨水(NH4OH)来控制pH 7.0左右,发酵温度37℃,溶氧25%~35%之间;当培养基中的葡萄糖消耗完之后,流加800 g/L葡萄糖溶液,保证发酵培养基中的葡萄糖质量浓度在0.1~5.0 g/L;发酵周期36 h。
1.3.2 测定方法
生物量的测定:通过生物传感仪测量波长600 nm处的吸光度值(OD600nm)来监测细胞的生长;葡萄糖含量测定:通过生物传感仪实时测定发酵液中的葡萄糖浓度;活细胞检测:使用活细胞在线检测仪。
L-色氨酸测定:采用高效液相色谱法,其色谱条件为:采用Gemini C18色谱柱(4.6 mm×150 mm,5 μm),流动相为体积比2∶98的乙腈-水混合液,流速控制在1 mL/min,检测波长278 nm,温度为40℃。
2 结果与分析
2.1 不同酵母粉对L-色氨酸生产的影响
为提高菌株TRP03生产色氨酸的能力,选择了8种不同的酵母粉,分别是Springer 0805、Springer 0820、Springer 2006、Springer 0203、Springer 1203、Nucel R 889PA、Springer 0835和LP0021酵母提取物进行了摇瓶发酵实验,每组设定3个平行实验,实验室常用的酵母粉为LP0021酵母提取物,将此组作为对照组。摇瓶发酵24 h后,对菌体OD600nm值和L-色氨酸积累进行了测定,结果如图1所示。

图1 不同氮源对菌体生长(A)和L-色氨酸产量(B)的影响Fig.1 Effects of different nitrogen sources on cell growth(A)andL-tryptophan production(B)
由图1可知,8组实验中,第2组耗氨、耗糖速率最快,综合两项指标来看,其余6组均与对照组无太大差异,说明相应氮源效果与对照组相当。发酵结束时,第2组OD600nm值为29.8,比对照组高8.31%,色氨酸平均产量为10.25 g/L,比对照组高25.77%,并且两个指标均为第8组中最高,同时氮源Springer 0820中,总含氮量为11.8%,与其他酵母粉相差不大,但是总氨基酸含量61.4%,明显高于其他酵母粉含量,因此,Springer 0820酵母粉更容易被菌体吸收利用,有利于菌体生长和产酸,适合被用作E.coli TRP03的发酵培养基氮源。
2.2 氨基酸粉和氯化胆碱的添加对L-色氨酸生产的影响
上述摇瓶实验中,确定了最佳酵母粉为Springer 0820后,进行了5 L发酵罐发酵性能实验,结果发现,在菌体发酵前期,溶氧缓慢回升,应该是速效氮源被细胞利用完毕,迟效氮源没有及时被细胞分解利用,细胞生长受到影响,同时在该阶段中细胞生产色氨酸的能力也随之下降。为解决该问题,选择在培养基中添加富含各种氨基酸能快速被细胞利用的氨基酸粉和可作甲基供体的氯化胆碱,分别在发酵培养基中添加1.5 g/L、2.0 g/L、2.5 g/L的氨基酸粉,同时以不添加氨基酸粉的发酵菌株为对照组,发酵过程中菌体生长情况和L-色氨酸产量结果见图2;分别在发酵培养基中添加0.2 g/L、0.5 g/L、0.8 g/L的氯化胆碱,同时以未添加氯化胆碱组为对照组,发酵过程中菌体生长情况和L-色氨酸产量结果见图3;同时添加氨基酸粉和氯化胆碱,配比分别为氨基酸粉1.5g/L和氯化胆碱0.5 g/L,氨基酸粉2.0 g/L和氯化胆碱0.5 g/L,氨基酸粉2.0 g/L和氯化胆碱0.2 g/L,同时以不添加氨基酸粉和氯化胆碱组为对照组,菌体生长情况和L-色氨酸积累见图4。

图2 不同氨基酸粉添加量对菌体生长(A)和L-色氨酸产量(B)的影响Fig.2 Effects of different addition of amino acid powder on cell growth(A)and L-tryptophan production(B)
由图2A和2B可知,在1.5~3.0h时,对照组在该阶段的细胞生长几乎处于停滞状态,L-色氨酸积累速率为0.289g/(L·h);当氨基酸粉添加量在1.5 g/L时,细胞生长仍较缓慢,趋势与不添加氨基酸粉基本相同,说明该阶段的细胞二次生长现象没有得到缓解;当氨基酸粉添加量为2 g/L时,细胞生长速率得到明显缓解,2.5 h后,细胞进入正常生长状态,同时,L-色氨酸生产速率为0.428 8 g/(L·h),较对照组提高近50%,但是在1.5~2.5 h,细胞生长仍较缓慢,表明氨基酸粉添加为2 g/L时,不能完全避免因氮源替换带来的二次生长现象;当氨基酸粉添加量为2.5 g/L时,产L-色氨酸速率为0.397 8 g/(L·h),说明氨基酸粉添加量>2 g/L后,没有继续提升L-色氨酸产量。结果表明,氨基酸粉最佳添加量为2 g/L,很大程度上解决了细胞生长迟缓的情况。同时,纵观整个发酵过程,氨基酸粉的添加一定程度上加速了细胞的生长,当添加量<2 g/L时,虽然细胞生长加快,但同时菌体衰亡也较对照组提前了1~2 h,当添加量提高至≥2 g/L时,细胞衰亡提前了3~4 h,但是L-色氨酸最终产量为39.12 g/L,较对照组提高了8.28%。

图3 不同氯化胆碱添加量对菌体生长(A)和L-色氨酸产量(B)的影响Fig.3 Effects of different addition of choline chloride on cell growth(A)and L-tryptophan production(B)
由图3A和3B可知,在发酵1.5~3.0 h内,氯化胆碱添加量为0.2 g/L时,细胞生长仍较缓慢;当氯化胆碱添加量提升至0.5 g/L时,细胞生长情况得到明显改善,2 h后细胞进入快速生长阶段,随着细胞快速生长,L-色氨酸积累速率也得到快递提升,但是1.5~2 h,细胞仍处于生长停滞状态;当氯化胆碱添加量继续提升至0.8 g/L时,细胞生长状态没有进一步得到改善,二次生长现象没有完全消除。在整个发酵过程中,3个实验组细胞生长速度较对照组均不同程度加快,但是也使得细胞衰亡有不同程度提前,此外,L-色氨酸积累得到提升,但是添加量>0.5 g/L之后,L-色氨酸生产会明显低于添加量为0.5 g/L的实验组。
由图4A和4B可知,在发酵时间1.5~3.0 h,添加配比为氨基酸粉1.5 g/L、氯化胆碱0.5 g/L和氨基酸粉2.0 g/L、氯化胆碱0.2 g/L时,很大程度上提高了细胞生长速率,细胞停滞生长时间缩小为0.5 h,L-色氨酸积累也得到提高;当添加配比为氨基酸粉2.0 g/L和氯化胆碱0.5 g/L时,细胞处于持续生长状态,细胞停滞生长阶段得到完全解除,同时色氨酸持续积累,积累速率较对照组提高了4倍左右,因此,确定氨基酸粉2.0 g/L和氯化胆碱0.5 g/L为最佳添加配比。在整个发酵过程中,3个实验组在4 h进入了快速生长阶段,较对照组提前了2h,最佳配比下,最高菌体量(OD600nm值)可达92,较对照组提高了13.88%,L-色氨酸最终积累44.21g/L,较对照组提高22.22%,较其他两个实验组提高12.82%,但是,在20 h后,细胞不再继续生长,产酸速率缓慢降低。
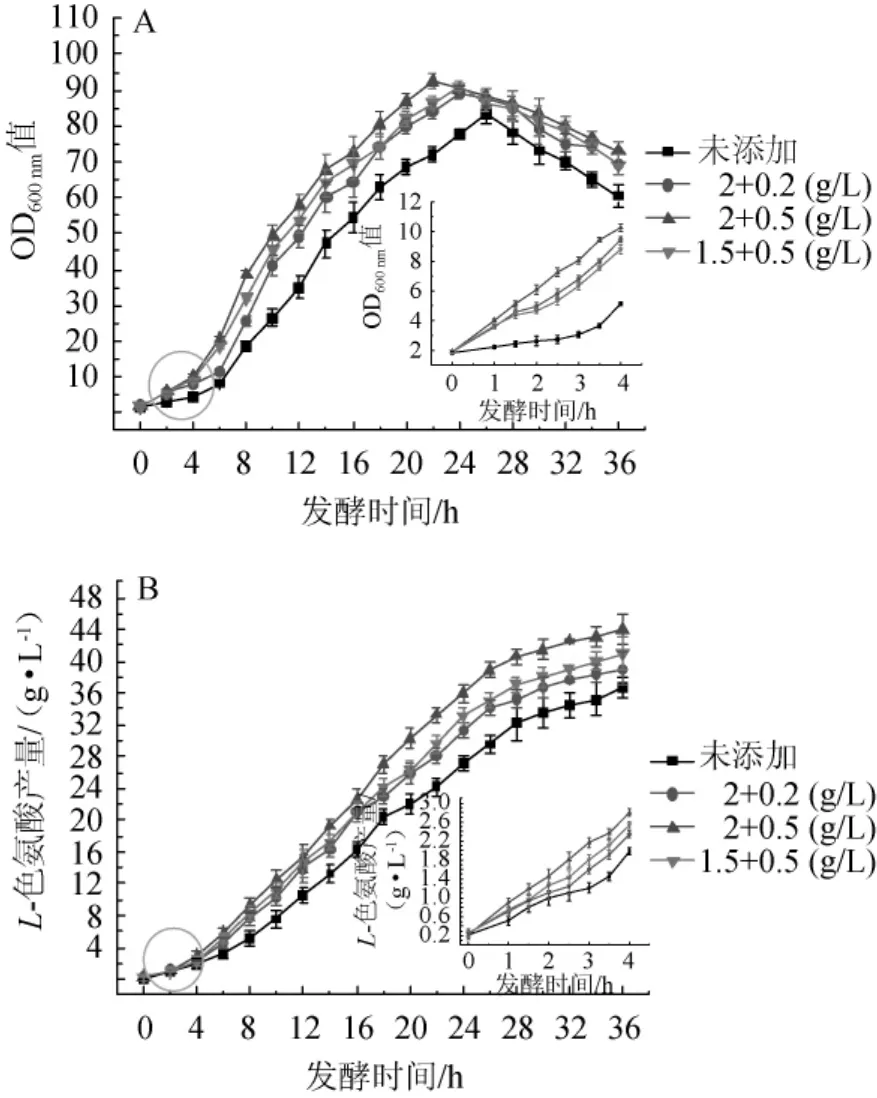
图4 不同组合的氨基酸粉和氯化胆碱的添加对菌体生长(A)和L-色氨酸产量(B)的影响Fig.4 Effects of different combinations of amino acid powder and choline chloride on cell growth(A)and L-tryptophan production(B)
氨基酸粉和氯化胆碱二者的单独添加均可在一定水平上解决细胞二次生长的问题,而同时添加则可以完全避免二次生长,结果符合预期。
2.3 酵母粉、蛋氨酸和谷氨酰胺的流加对L-色氨酸发酵的影响
为缓解细胞衰亡,菌体活力降低和产酸速率下降等现象,选择在发酵不同时期流加酵母粉、蛋氨酸和谷氨酰胺(质量浓度均为1 g/L)混合液,蛋氨酸为胞内重要的甲基供体,谷氨酰胺则为色氨酸合成的前体物之一,通过流加混合液,及时满足胞内各种反应所需的氨基酸、甲基及色氨酸合成所需的前体,希望在解决菌体活力下降问题的同时,进一步提高L-色氨酸产量。混合液的流加时间选择发酵6h、10h、14h,流加方式选择随糖流加,流加速率为0.01g/L,流加至20 h停止流加。并以不流加酵母粉、蛋氨酸和谷氨酰胺菌株(解除二次生长现象的菌株)为对照组,对细胞生长、色氨酸产量、活细胞数进行了分析,结果见图5。
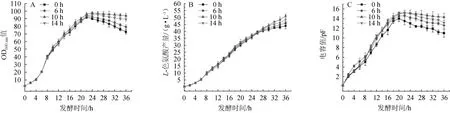
图5 不同时期的酵母粉、蛋氨酸和谷氨酰胺添加对菌体生长(A)、L-色氨酸产量(B)和活细胞数(C)的影响Fig.5 Effects of yeast powder,methionine and glutamine addition at different stages on cell growth(A),L-tryptophan production(B)and viable cell count(C)
由图5可知,在6 h补加混合营养物时,发酵前期,菌体生长和L-色氨酸积累有微量提高,菌体衰亡延迟了2 h,L-色氨酸产量在46 g/L左右,22 h后,活细胞数虽然在下降,但是较对照组有了明显改善;在14 h添加混合营养物时,菌体衰亡得到进一步改善,因活细胞数的增加,L-色氨酸产量得到进一步提高,达48 g/L,较对照组提高了9.09%;添加时间为10h时,在发酵20h后,虽然菌体量没有进一步生长,但是趋于平稳状态,活细胞数也得到稳定,最终活细胞数较对照组提高了30.18%,较其他两组提高了近8.85%,在菌体活力得到改善的条件下,L-色氨酸最终可积累51.23 g/L,较对照菌株提高了16.43%,较14 h添加混合营养物时的L-色氨酸积累量提高了6.73%。
3 结论
本研究通过优化有机氮源、不同时期添加不同营养物质逐步改善了细胞生长状态,L-色氨酸积累得到提升。选择Springer 0820为氮源时,菌株生长和L-色氨酸产量均得到提升,利用5 L生物反应器进行发酵,在培养基中同时添加氨基酸粉2.0 g/L,氯化胆碱0.5g/L时,可完全解除细胞因氮源切换造成的停滞期,同时最终L-色氨酸可积累44.21g/L,较对照组提高20.85%,在发酵10 h流加酵母粉、蛋氨酸和谷氨酰胺,明显改善了细胞的衰亡问题,24 h后,电容值持续稳定在14 pF,意味着活细胞数没有出现明显下降趋势,同时L-色氨酸生产速率维持在1.15 g/(L·h),最终L-色氨酸产量在51.23 g/L,较未经任何优化的菌株提高41.91%。
