出芽短梗霉固态发酵啤酒糟制备阿魏酰低聚糖和膳食纤维工艺研究
2019-06-11卜雯丽李凤伟丁霄霄商曰玲余晓红
卜雯丽,李凤伟,王 杰,丁霄霄,商曰玲,余晓红*
(1.江苏大学 食品与生物工程学院,江苏 镇江 212013;2.盐城工学院 海洋与生物工程学院,江苏 盐城 224051)
啤酒糟(brewer"s spent grain,BSG)俗称麦糟,是由麦芽和大米、淀粉等经过糊化、糖化后,所分离出来的不溶性残渣物,约占啤酒生产过程中所产的总副产物的85%[1-2],其主要成分是蛋白质和膳食纤维,并含有0.4%左右的阿魏酸[3],营养价值丰富。阿魏酸主要通过酯键、醚键与阿拉伯糖及阿拉伯木聚糖等物质交联。阿魏酰低聚糖(feruloyl oligosaccharides,FOs)是低聚糖中不同位置上的糖羟基与阿魏酸羧基酯化形成的一类化合物,因此,兼具阿魏酸和低聚糖这两种物质的生理功能,且阿魏酸酯低聚糖能溶于水,具有双亲媒性和非离子属性,渗透性强,容易进入人体线粒体而发挥抗氧化作用[4]。众所周知,膳食纤维(dietary f i ber,DF)在许多生理过程和疾病预防中扮演一个重要的角色,啤酒糟又是一个宝贵的膳食纤维资源[5]。但如今很多企业直接将啤酒糟用来饲养动物或排放入河,长期以来,不仅会使得动物对啤酒糟不易消化、吸收,还会使得生态环境变得更加恶劣,同时也造成了啤酒糟的大量浪费[6]。因此,如何合理有效的利用啤酒糟,已成为啤酒厂等工业所面临的的重大难题。啤酒糟是微生物发酵的良好基质,我国是一个啤酒生产大国,2016年底我国生产啤酒达4 506万t,与此同时也产生了大量的啤酒糟。出芽短梗霉(Aureobasidium pullulans)又名出芽茁霉,为半知菌类短梗霉属,是一类与酵母有密切关系的食安性真菌[7-8]。出芽短梗霉生长迅速,培养数日就可生长成熟。研究表明,其生长过程中可生成木聚糖酶、淀粉酶、蛋白酶、纤维素酶等[9-12]。其中半纤维素酶可水解原料的细胞壁多糖,生成FOs;淀粉酶和蛋白酶水解原料中的淀粉、蛋白质为其生长提供营养,并将其转变为真菌多糖和菌体纤维,增加可溶性膳食纤维(soluble dietary fiber,SDF)来源。同时,直接将产木聚糖酶的微生物应用于FOs制备中,使微生物发酵产酶过程与酶解木聚糖获得FOs的过程合二为一,可省去酶制剂生产中的分离纯化步骤及不溶性膳食纤维(insoluble dietary fiber,IDF)的制备步骤,降低生产成本,提高FOs和DF的产率。因此,利用出芽短梗霉发酵制备FOs和DF具有广阔的应用前景[13-14]。
本实验以啤酒糟为原料,出芽短梗霉为发酵菌株,采用固态发酵制备具有生理功能的阿魏酰低聚糖和膳食纤维,通过单因素试验和正交试验,确定发酵培养基的最优配方。在此基础上,对接种量、发酵时间和温度进行单因素试验,并利用响应面法优化出芽短梗霉发酵啤酒糟的工艺条件,以期为啤酒加工副产物啤酒糟的广泛应用提供一条新的途径。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和原料
出芽短梗霉(Aureobasidiumpullulans):本实验室保存;啤酒糟:盐城啤酒中试实验室提供。
1.1.2 化学试剂
葡萄糖:上海中试化工总公司;磷酸氢二钾:广东汕头市西陇化工厂;维生素B2(vitamin B2,VB2):上海士峰生物科技有限公司;木聚糖:上海阿拉丁试剂有限公司;尿素、甘氨酸、四硼酸钠、亚硫酸钠(Na2SO3):生工生物工程股份有限公司;琼脂粉:国药集团化学试剂有限公司。所有化学试剂均为分析纯或生化试剂。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基[15]:马铃薯200g,葡萄糖20g,琼脂20g,蒸馏水1000 mL。
固体发酵培养基:啤酒糟20 g,木聚糖5%,尿素3%,磷酸二氢钾(KH2PO4)0.5%,VB20.01%,蒸馏水40mL,pH自然。
采用高压蒸汽灭菌,灭菌温度为121℃,时间15~20min。
1.2 仪器与设备
BXM-30R立式压力蒸汽灭菌器:上海博讯实业有限公司;80-1台式离心机、BS-2F振荡培养箱:金坛市杰瑞尔电器有限公司;FA1104电子天平:上海舜宇恒平科学仪器有限公司;UV752N紫外可见分光光度计:上海佑科仪器仪表有限公司;SW-CJ-1D无菌操作台:江苏通泽器械有限公司;DNP电热恒温培养箱:上海金宏实验设备有限公司。
1.3 试验方法
1.3.1 培养方法
将啤酒糟放入烘箱中于60℃烘干,粉碎至啤酒糟的颗粒径度大小为60目,装袋,密封,备用。
将马铃薯葡萄糖琼脂(PDA)斜面培养基放入28℃恒温培养箱观察2 d,没有杂菌则可以进行接种;在PDA斜面培养基上接种出芽短梗霉,于恒温培养箱中28℃培养7 d,待长满斜面后,将菌种接入马铃薯葡萄糖液态培养基中,在28℃、180 r/min条件下摇床培养3 d进行活化培养,即为种子液。
按12%(V/V)的接种量取出芽短梗霉的种子液接入到装有固体发酵培养基的锥形瓶中,每种同样条件下做3个平行试验,置于28℃条件下培养4 d。
1.3.2 分析方法
(1)阿魏酰低聚糖含量的测定
在YUAN X等[16]的研究基础上稍作调整,称取干燥后的固态发酵样品0.5 g,用10倍50 mmol/L的柠檬酸盐-磷酸盐缓冲液(pH5.0)在28℃、250 r/min条件下摇床振荡培养60 min。结束后,离心(4℃,10 000 r/min,15 min),取上清液0.1mL,与0.9mL的0.1mol/L硼砂-甘氨酸缓冲溶液(pH10.0)混合,分别在波长345 nm和375 nm处测定混合溶液的吸光度值。根据如下的数据可推算出FOs的浓度。
阿魏酸的摩尔吸光系数ε"345nm=19 662 L/(mol·cm),ε"375nm=7 630 L/(mol·cm);
阿魏酰低聚糖的摩尔吸光系数ε345nm=23064L/(mol·cm),ε375nm=31 430 L/(mol·cm)
C=(ε"345nm×A375nm-ε"375nm×A345nm)×b/(ε"345nm×ε375nm-ε345nm×ε"375nm)
式中:C为阿魏酰低聚糖浓度,mol/L;b为比色皿厚度,cm;A345nm为波长345 nm处的吸光度值;A375nm为波长375 nm处的吸光度值。
(2)不溶性膳食纤维(IDF)测定[17-18]
发酵样品于60℃烘箱中干燥至恒质量,取发酵样1.00g,置平底烧瓶中,加15 mL去离子水,90℃水浴30 min,淀粉酶、蛋白酶酶解后过滤,加75 mL中性洗涤剂溶液,再加0.05 g无水Na2SO3,电炉加热,5~10 min内煮沸,移至电热板上,保持微沸1 h,用10 mL丙酮冲洗残渣,于耐酸玻璃砂芯漏斗中抽滤至干,移至烘箱内,110℃保持4 h,取出冷却至室温,称质量。
(3)可溶性膳食纤维(SDF)测定[19]
取测定不溶性膳食纤维时第1次过滤的滤液,加入4倍体积分数为95%的乙醇,于4℃放置8 h后,离心,收集沉淀,无水乙醇洗涤离心2次,再加丙酮洗涤离心1次,105℃烘至恒质量,称质量。
(4)总膳食纤维
总膳食纤维(total dietary fiber,TDF):可溶性膳食纤维与不可溶性膳食纤维之和。
(5)可溶性膳食纤维含量
可溶性膳食纤维含量:可溶性膳食纤维占总膳食纤维的百分比(SDF/TDF×100%)。
1.3.3 发酵培养基组分优化
考察木聚糖(3%、4%、5%、6%、7%)、尿素(1%、2%、3%、4%、5%)和磷酸二氢钾(0、0.5%、1.0%、1.5%、2.0%)添加量对制备FOs和可溶性膳食纤维含量的影响,在单因素试验结果的基础上,设计L9(34)正交试验优化选出碳源、氮源和无机盐的最适添加量。
1.3.4 响应面法优化发酵条件[20]
利用最优的发酵培养基组分,考察接种量(4%、8%、12%、16%、20%)、发酵时间(2、4 d、6 d、8 d、10 d)和发酵温度(26℃、28℃、30℃、32℃、34℃)3个因素对FOs含量及可溶性膳食纤维含量的影响。以单因素试验得到的结果为基础,依据Box-Behnken试验设计的原理,以FOs含量及可溶性膳食纤维含量为响应值,进行3因素3水平的试验设计。用Design-Expert version 8.0.6软件设计试验因素水平及编号如表1所示,每组实验重复3次。

表1 Box-Behnken试验设计因素与水平Table 1 Factors and levels of Box-Behnken experiments design
2 结果与分析
2.1 发酵培养基组分优化试验
2.1.1 培养基组分优化单因素试验
考察木聚糖(3%、4%、5%、6%、7%)、尿素(1%、2%、3%、4%、5%)和磷酸二氢钾(0%、0.5%、1.0%、1.5%、2.0%)添加量对FOs和可溶性膳食纤维含量的影响,结果见表2。

表2 不同培养基组分添加量对阿魏酰低聚糖含量及可溶性膳食纤维含量的影响Table 2 Effect of different medium compositions addition on feruloyl oligosaccharides content and soluble dietary fiber content
由表2可知,随着木聚糖、尿素及KH2PO4这3种培养基组分添加量的增加,FOs含量及可溶性膳食纤维含量先增加后减小;当木聚糖、尿素及KH2PO4添加量分别为6%、4%和1.0%时,FOs含量及可溶性膳食纤维含量最高;当木聚糖>6%、尿素>4%、KH2PO4>1.0%之后,FOs含量及可溶性膳食纤维含量开始呈下降趋势。因此,本实验选择木聚糖添加量(5%、6%、7%)、尿素添加量(3%、4%、5%)、KH2PO4添加量(0.5%、1.0%、1.5%)作为进一步正交试验的因素水平。
2.1.2 培养基组分优化正交试验
以上述单因素试验结果为基础,以木聚糖(A)、尿素(B)和KH2PO4(C)添加量为评价因素,以FOs含量及可溶性膳食纤维含量为评价指标,进行L9(34)正交试验,正交试验结果与分析见表3,方差分析见表4。
由表3可知,3种培养基组分对FOs含量影响的主次顺序依次是:木聚糖>尿素>KH2PO4,对可溶性膳食纤维含量影响的主次顺序依次为:尿素>KH2PO4>木聚糖。综合分析,以k值选择最优培养基组分组合为A2B2C2,即木聚糖6%、尿素4%、KH2PO41.0%。在此最佳培养基组分条件下进行3次验证试验,FOs含量为31.15 μmol/L,可溶性膳食纤维含量为21.56%。由表4可知,木聚糖和尿素对FOs产量有显著影响(P<0.05),而KH2PO4对固态发酵啤酒糟产FOs影响不显著(P>0.05);尿素对可溶性膳食纤维含量也有显著影响(P<0.05)。

表3 培养基组分优化正交试验结果与分析Table 3 Results and analysis of orthogonal experiments for medium composition optimization

续表
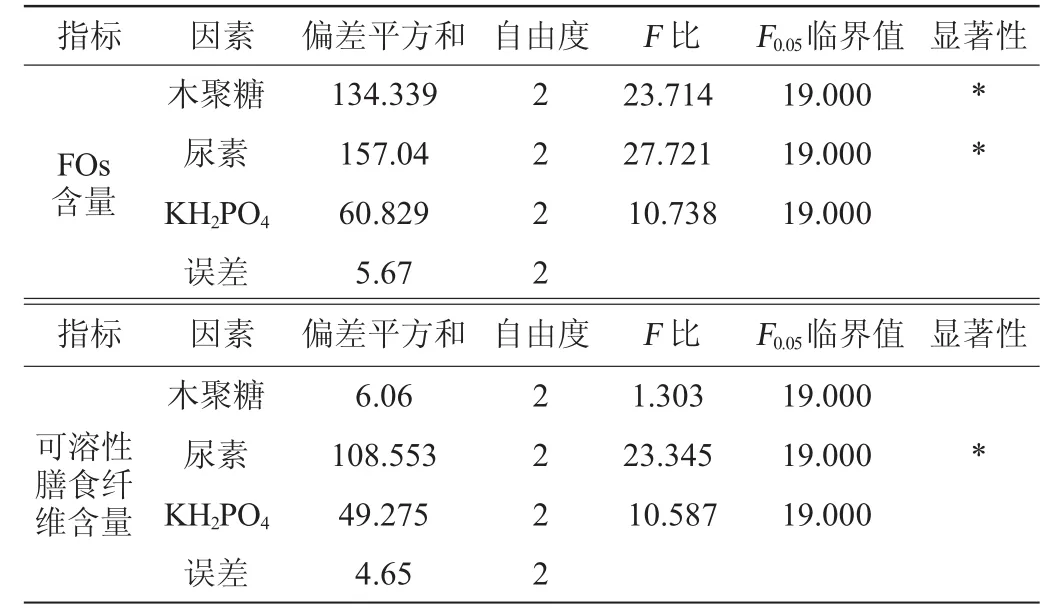
表4 以阿魏酰低聚糖含量及可溶性膳食纤维含量为评价指标的正交试验结果方差分析Table 4 Variance analysis of orthogonal experiments results based on feruloyl oligosaccharides content and soluble dietary fiber content
2.2 发酵条件优化单因素试验
2.2.1 接种量对FOs含量及可溶性膳食纤维含量的影响
在最佳培养基组分的基础上,考察不同接种量对FOs含量及可溶性膳食纤维含量的影响,结果见表5。
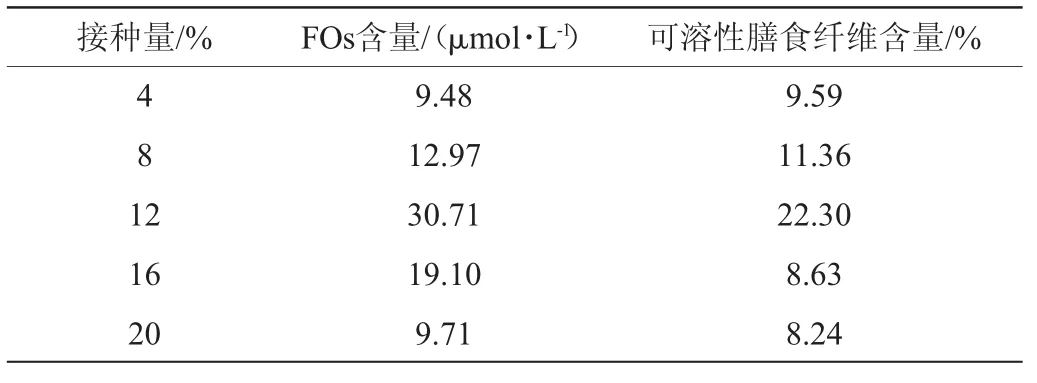
表5 接种量对阿魏酰低聚糖含量及可溶性膳食纤维含量的影响Table 5 Effect of inoculum on feruloyl oligosaccharides content and soluble dietary fiber content
由表5可知,随着接种量增加,发酵后啤酒糟基质中FOs含量及可溶性膳食纤维含量呈现先增加后减少的趋势,接种量为12%时,两项指标均达到最大值,分别为30.71μmol/L和22.30%。接种量较小时,出芽短梗霉生长过程中的延滞期太长,在发酵周期内菌种没有充分生长。接种量较大时,会导致出芽短梗霉生长过快,大量消耗营养物质,使得营养物质不断减少,而去利用FOs和膳食纤维供其生长。因此,接种量12%为宜。
2.2.2 发酵时间对FOs含量及可溶性膳食纤维含量的影响
考察不同发酵时间对FOs含量及可溶性膳食纤维含量的影响,结果见表6。

表6 发酵时间对阿魏酰低聚糖含量及可溶性膳食纤维含量的影响Table 6 Effect of fermentation time on feruloyl oligosaccharides content and soluble dietary fiber content
由表6可知,在2~4 d的发酵时间内,FOs含量及可溶性膳食纤维含量均呈现增加趋势,在第4天达到最大值,分别为30.71 μmol/L和22.30%,发酵时间>4 d之后,FOs含量及可溶性膳食纤维含量不断下降,这种结果可能是因为一开始随着时间的增加,出芽短梗霉分泌的阿魏酸酯酶的含量增加,但是到达一定的时间之后,出芽短梗霉所利用的营养物质不断减少,转而去利用FOs和膳食纤维供给其生长,进而会造成FOs含量及可溶性膳食纤维含量的下降。因此,发酵时间4 d为宜。
2.2.3 发酵温度对FOs含量及可溶性膳食纤维含量的影响
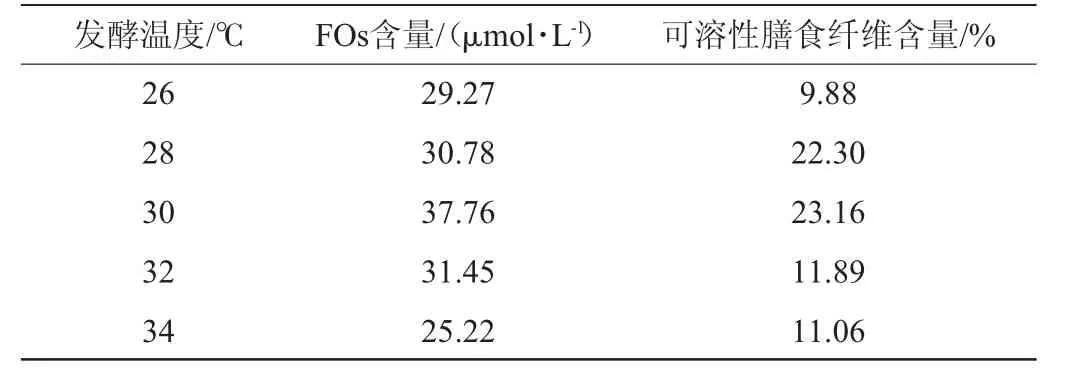
表7 发酵温度对阿魏酰低聚糖含量及可溶性膳食纤维含量的影响Table 7 Effect of fermentation temperature on feruloyl oligosaccharides content and soluble dietary fiber content
由表7可知,随着发酵温度从26~30℃逐渐升高,FOs含量及可溶性膳食纤维含量逐渐增加;当发酵温度为30℃时,出芽短梗霉发酵啤酒糟得到的FOs含量及可溶性膳食纤维含量均达到最大值,分别为37.76μmol/L和23.16%;发酵温度>30℃之后,两者含量减少。因此,发酵温度30℃为宜。
2.3 发酵条件优化响应面试验
2.3.1 响应面试验设计及结果
以单因素试验得到的结果为基础,运用Design-Expert version 8.0.6软件,以FOs含量(Y1)及可溶性膳食纤维含量(Y2)为响应值,以接种量、发酵时间及发酵温度为因变量,进行Box-Behnken 3因素3水平响应面试验设计,对出芽短梗霉固态发酵啤酒糟制备FOs和膳食纤维的工艺条件进行优化,结果见表8。
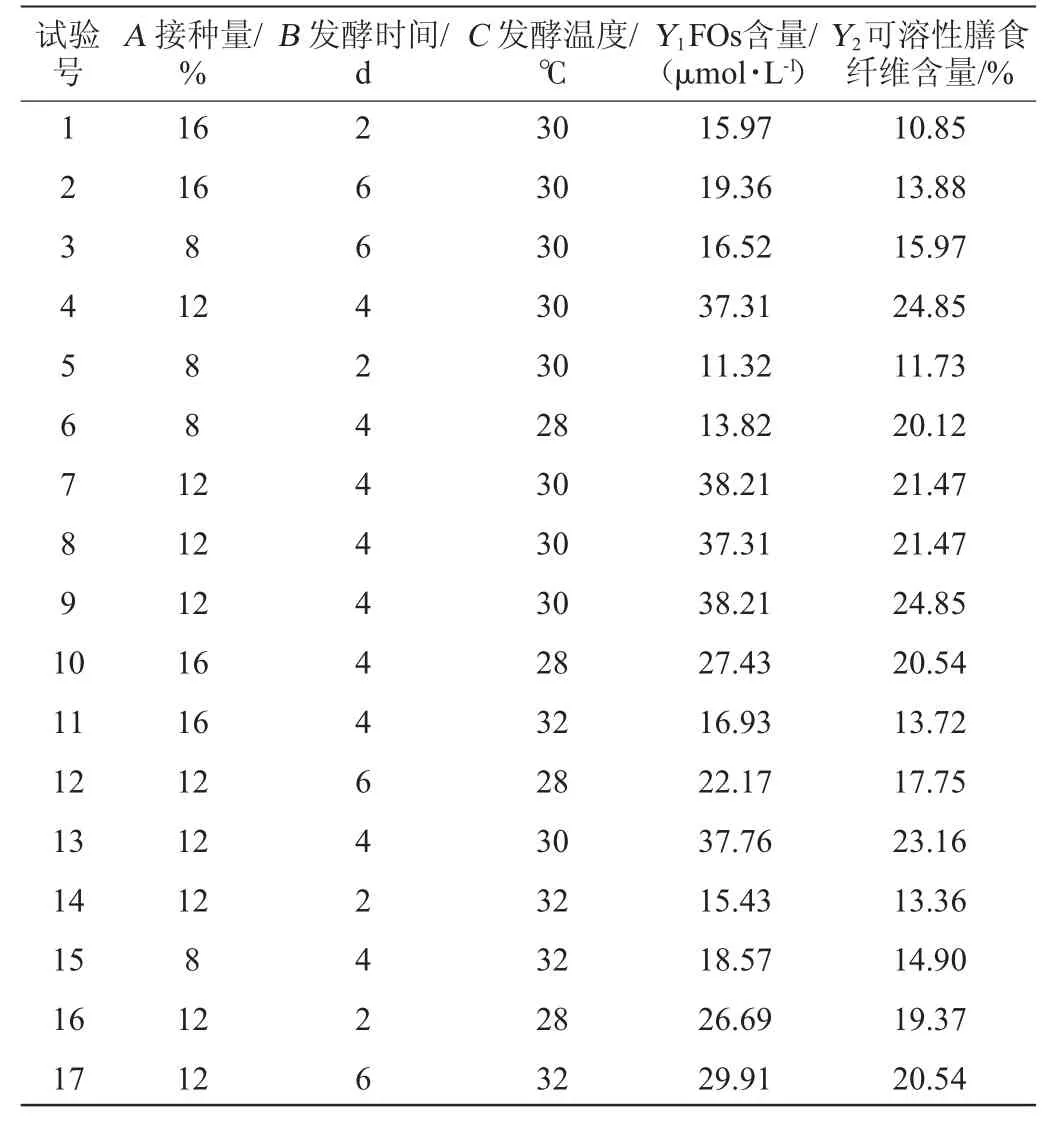
表8 发酵条件优化Box-Behnken试验设计及结果Table 8 Design and results of Box-Behnken experiments for fermentation conditions optimization
2.3.2 模型的建立及显著性检验
通过Design-Expert软件对表3中的数据进行多元回归拟合,计算回归系数,可以得到FOs含量(Y1)对接种量(A)、发酵时间(B)和发酵温度(C)的多项回归方程:

可溶性膳食纤维含量(Y2)对接种量(A)、发酵时间(B)和发酵温度(C)的多项回归方程:
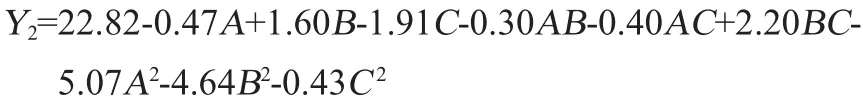
回归模型方差分析见表9。由表9可知,回归方程模型P<0.0001,表明模型具有极显著性;两个失拟项P=0.0658>0.05,P=0.403 2>0.05,说明失拟项均不显著,表明回归模型是合适的,可以用来分析和预测固态发酵制备FOs和膳食纤维的发酵条件。一次项接种量、发酵时间对FOs的含量影响极显著(P<0.01),发酵温度对FOs的含量影响显著(P<0.05),发酵时间、发酵温度对可溶性膳食纤维含量的影响显著(P<0.05)。接种量与发酵温度以及发酵时间与发酵温度交互作用对FOs的含量影响极显著(P<0.01)。
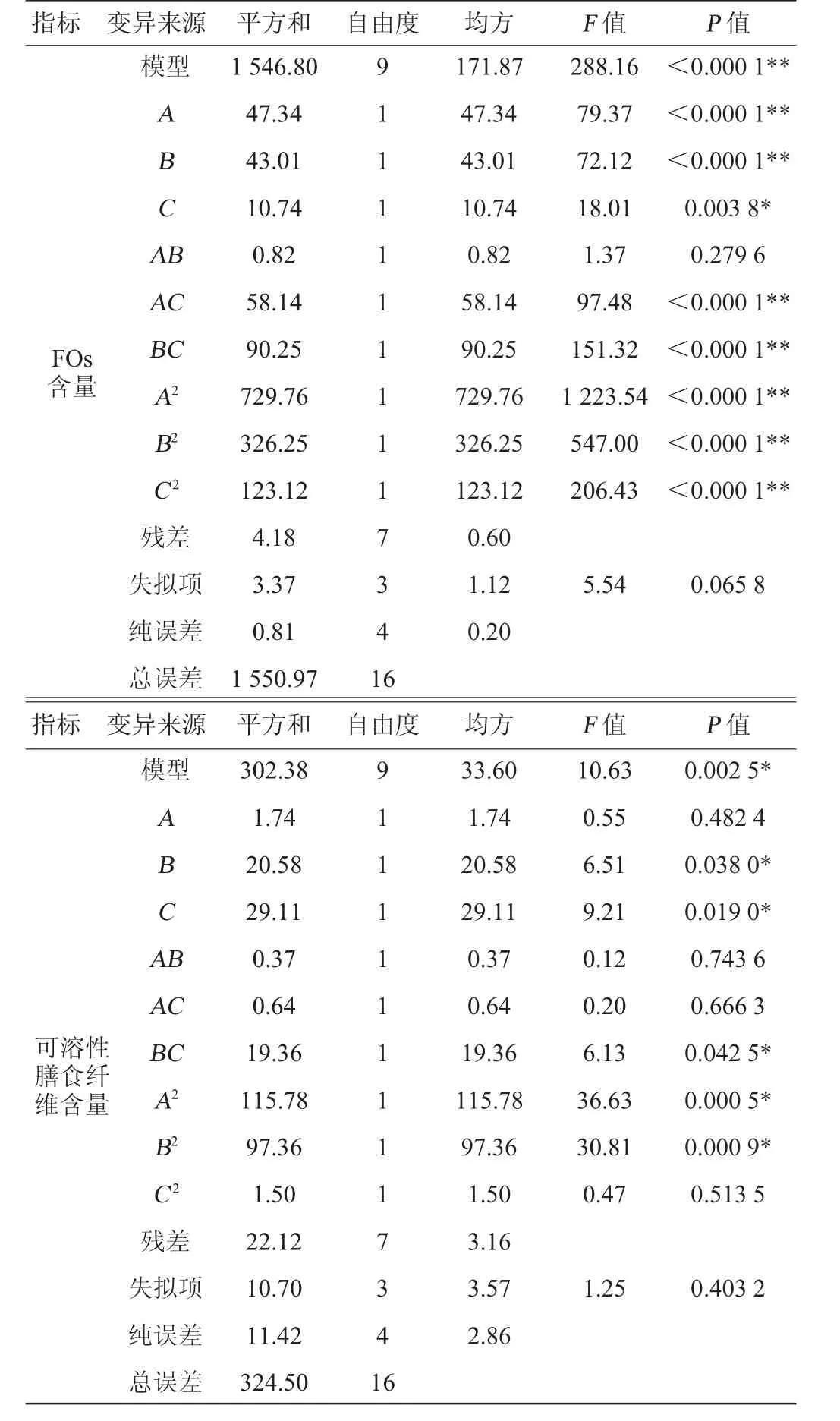
表9 回归模型方差分析Table 9 Variance analysis of regression model
2.3.3 响应面优化分析
固定其中的一个因素,利用软件Design-Expert做另外两个因素交互作用的曲面图,确定接种量、发酵时间及发酵温度对FOs含量及可溶性膳食纤维含量的影响,结果见图1。
由图1可知,3个因素都是随着因素水平数值增大响应值增大,当响应值达到极值后,随着因素水平的增大,响应值逐渐减小。分析可知,接种量和发酵温度两个因素交互作用对FOs含量的影响极显著;发酵温度和发酵时间两个因素交互作用对FOs含量影响极显著;发酵温度和发酵时间两个因素交互作用对可溶性膳食纤维含量的影响显著。结果与表9方差分析结果一致。
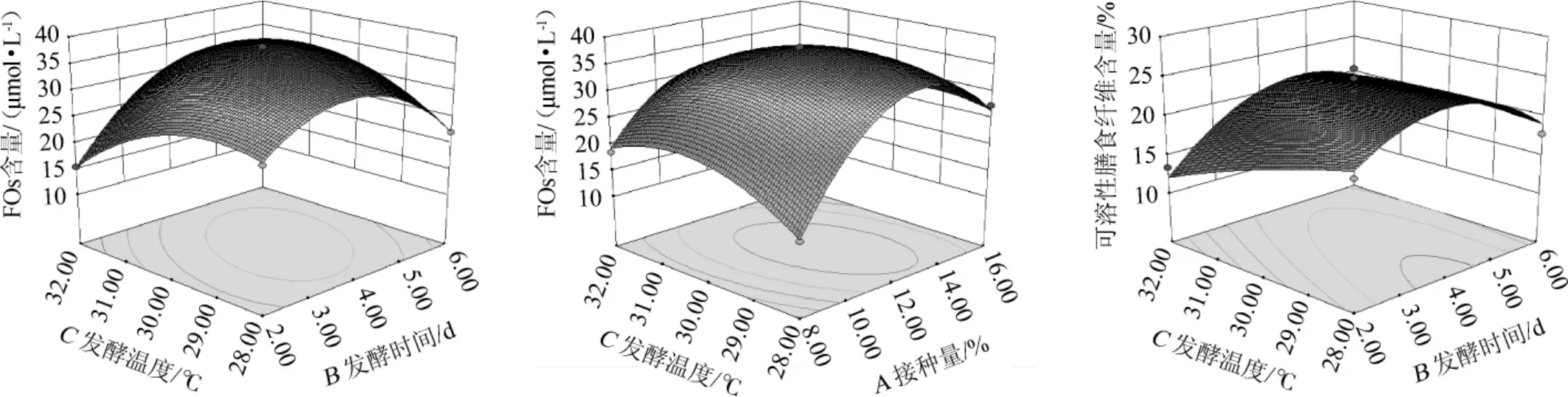
图1 接种量、发酵时间和发酵温度的交互作用对阿魏酰低聚糖含量和可溶性膳食纤维含量影响的响应面和等高线Fig.1 Response surface plots and contour line of effects of interaction between inoculum,fermentation time and temperature on feruloyl oligosaccharides content and soluble dietary fiber content
由Design-Expert Version8.0.6软件得出FOs和可溶性膳食纤维制备的最佳发酵工艺条件为:接种量为12.26%,发酵时间为4.12 d,发酵温度为29.27℃。为了便于实际操作,将上述优化发酵工艺条件修正为:接种量为12%,发酵时间为4 d,发酵温度为29℃。在此优化条件下进行3次验证试验,FOs含量为37.67 μmol/L,可溶性膳食纤维含量为23.76%。与模型预测的FOs含量37.76 μmol/L,可溶性膳食纤维含量23.16%基本一致,说明响应面法得到的FOs和可溶性膳食纤维发酵工艺条件是可行的。
3 结论
本试验采用正交实验法优化了啤酒糟固态发酵培养基组分的添加比例,然后在接种量、发酵时间、发酵温度3个单因素试验的基础上,采用响应面法优化了啤酒糟固态发酵制备FOs和膳食纤维的发酵条件。正交试验得出培养基组分添加比例分别为木聚糖6%、尿素4%和磷酸二氢钾1%。通过单因素及响应面试验得到出芽短梗霉发酵啤酒糟的最佳发酵条件为接种量12%、发酵时间4 d和发酵温度29℃。在此优化条件下,FOs的含量达到了37.67 μmol/L,可溶性膳食纤维含量高达23.76%。本研究结果为啤酒糟的高效利用提供了理论依据。
