泛素E3连接酶TRIM10在心肌细胞缺氧/复氧损伤的作用及机制
2019-06-10陈东侯翠柳来松肖雪王筱筱王红霞
刘 洋 陈东 侯翠柳 来松 杨 慧 肖雪 王筱筱 田 翠 王红霞
缺血性心脏病是世界范围的最主要死因[1],而再灌注损伤是缺血性心脏病发生最主要的原因,如何保护心脏对抗再灌注损伤对心脏病学家来说是一种挑战。心肌缺血-再灌注损伤是指心肌组织在缺血基础上恢复血流后组织损伤没有减轻反而加重甚至发生不可逆性损伤的现象。虽然心肌缺血-再灌注的机制尚未完全被阐明,目前的研究认为心肌细胞的凋亡为再灌注损伤发病机制中的一个重要环节[2]。细胞凋亡是指由体内外因素触发细胞内预存的死亡程序而导致的细胞死亡过程[3]。研究已证实凋亡可以由特异的泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)来调控,其介导的凋亡在心力衰竭、缺血-再灌注损伤等心血管疾病中,起着关键性作用[4-5]。
UPS系统由泛素、泛素活化酶E1、泛素结合酶E2、泛素-蛋白连接酶E3、26S蛋白酶体和去泛素化酶等组成[6]。真核生物体内,80%~90%的蛋白被UPS系统特异性识别降解。UPS不仅是蛋白质降解的重要机制,还参与炎症、细胞增殖与分化、信号转导、转录调控、受体胞吞、免疫应答、细胞凋亡等重要生命过程的调节[7-8]。其中,泛素E3连接酶(如CHIP、MDM2等)负责特异性识别底物蛋白,参与心肌缺血-再灌注损伤的发生。
TRIM家族是一个近年来发现并且受到重视的含RING结构域的E3连接酶。目前发现的TRIM家族蛋白有60多种[9],参与调控凋亡、细胞周期、分化、细胞对病毒的反应等诸多重要的生命过程。例如MID1基因的突变会导致先天性的Opitz综合征[10]、TRIM25可诱导视黄酸诱导型基因-I的泛素化,对引发宿主抗病毒先天免疫至关重要[11];TRIM59可通过调节细胞周期的进程促进前列腺癌的细胞增殖等[12]。TRIM10是TRIM家族的成员之一,同样具有E3连接酶的功能,主要参与红系细胞的终末分化,对造血功能、细胞凋亡均具有重要的调节作用[13]。本实验室前期研究发现TRIM10参与了心肌肥大的发生[14],但是TRIM10在心肌细胞缺氧/复氧损伤中的作用尚不清楚。
本实验在原代培养的心肌细胞中,转染siRNATRIM10敲低和转染Ad-TRIM10过表达TRIM10,复制心肌细胞H/R模型(缺氧30 min,复氧24 h),观察心肌细胞氧化应激、细胞凋亡以及相应蛋白表达的情况,探讨TRIM10在心肌细胞缺氧/复氧损伤中的作用及其机制。
材料与方法
1.实验动物 SD大鼠,新生乳鼠(出生24 h之内)由北京维通利华有限公司提供。所有研究工作均遵守美国国立卫生研究院(NationalInstitutesof-Health,NIH)制定的《实验动物管理及使用指南》并经首都医科大学实验动物管理委员会批准。
2.主要试剂及仪器 TUNEL、DHE染色试剂盒购自瑞士Roche公司;过表达腺病毒Ad-TRIM10和Ad-GFP由汉恒生物公司合成;siRNA-TRIM10、siRNA-Scramble由中原生物有限公司合成。Lipofectamine 2000购自Invitrogen;DMEM/F12培养基和胎牛血清购自Gibco;TRIM10、GAPDH、BAX、p-JNK/JNK、p-P38/P38、p-ERK/ERK抗体及兔源II抗购于美国Cell Signaling Technology公司。
3.主要方法 (1)原代心肌细胞培养及转染:提取SD大鼠乳鼠心肌细胞,放入含15%胎牛血清的DMEM/F12培养基中贴壁培养24 h,饥饿6~8 h后,转 染Ad-TRIM10和Ad-GFP(50 nmol/L,1∶1 000)过表达内源性TRIM10或用Lipofectamine 2000转 染siRNA-TRIM10和siRNA-Scramble(20 nmol/L,1∶1 000)敲低内源性TRIM10表达。48 h后,给予缺血Buffer处理30 min,再将细胞培养液更换为含有ITS、CDlipid及10%BSA无血清的DMEM/F12培养基继续培养细胞24 h收取细胞用于后续实验。
(2)细胞TUNEL染色 4%多聚甲醛固定细胞15 min,PBS洗3 min,3次,0.1%Tritonx-100室温封闭通透15 min,PBS洗3 min,3次,加入罗氏TUNEL染色试剂,37℃避光孵育60 min,PBS洗3 min,3次,抗荧光淬灭剂封片。用Nikon Labophot 2显微镜进行采图(×200),选择6~8个视野,应用Image J软件统计每个视野细胞核数目及凋亡细胞数,凋亡细胞占总细胞数的比值即为凋亡百分数。
(3)细胞DHE染色 用4%多聚甲醛固定细胞15 min,PBS洗3 min,3次,室温封闭通透15 min,PBS洗3 min,3次,DHE工作液滴染,37℃避光孵育30 min,PBS洗3 min,3次,抗荧光淬灭剂封片。用Nikon Labophot 2显微镜进行采图(×200),选择6~8个视野,应用Image J软件统计每个视野细胞核数目及发生氧化应激的细胞数,氧化应激细胞占总细胞数的比值即为氧化应激百分数。
(4)Western blot实验 用蛋白RIPA(PMSF∶RIPA=1∶100)裂解液120μL冰上裂解细胞15 min,用细胞刮刀收取至1.5 mL EP管中,细胞破碎仪裂解细胞后离心(4℃、12 000 r/min)10 min,吸取上清,BCA法测蛋白浓度,取40~50μg总蛋白进行SDS-PAGE,然后将蛋白电转至PVDF膜。用5%脱脂牛奶室温封闭1 h,I抗4℃孵育过夜,次日洗涤10 min,3次。用II抗孵育膜1 h,洗涤15 min,4次,ECL显影。
4统计学方法 统计分析使用SPSS19.0软件进行。每个指标进行3次以上独立重复实验,所得计量数据均以均数±标准误表示,均数组间比较采用单因素方差分析方法.以P<0.05为差异有统计学意义。
结 果
1.H/R处理上调心肌细胞TRIM10蛋白表达H/R处理对TRIM10蛋白表达的变化。结果显示:与对照组相比,H/R处理后6 h或24 h上调心肌细胞中TRIM10蛋白的表达,且在24 h差异有统计学意义(图1)。
2.敲低TRIM10减轻H/R诱导ROS的产生、而其过表达则加重以上变化 首先我们检测siRNATRIM10和Ad-TRIM10转染的效率,结果显示:siRNA-TRIM10明显下调TRIM10的表达(下降了60%,图2 A),而Ad-TRIM10转染效率为90%(图2B);进一步观察敲低或过表达TRIM10对H/R诱导的心肌细胞中ROS产生的影响,结果发现敲低TRIM10明显减少H/R诱导的ROS的产生(图2C),而过表达TRIM10进一步增加H/R诱导的ROS的产生(图2D)。
3.敲低TRIM10减轻H/R诱导的心肌细胞凋亡并下调BAX蛋白的表达、而其过表达则加重以上变化 与Control组相比,H/R明显增加TUNEL染色阳性细胞数,敲低TRIM10减轻H/R诱导的细胞凋亡(图3 A);而过表达TRIM10则加重H/R诱导的细胞凋亡(图3C)。进一步我们检测了促凋亡蛋白BAX的表达,结果显示:与Control组相比,H/R组明显上调心肌细胞BAX蛋白的表达,敲低TRIM10下调H/R诱导的BAX蛋白表达(图3B)、而过表达TRIM10则加重了以上变化(图3D)。
4.敲低TRIM10减轻H/R处理诱导的JNK和P38MAPK蛋白的磷酸化水平,而对ERK蛋白的磷酸化水平无影响 与Control组相比,H/R明显增加JNK、P38MAPK、ERK蛋白的磷酸化;而敲低TRIM10减轻H/R诱导的P38MAPK、JNK蛋白的磷酸化,而对ERK的磷酸化水平无影响(图4)。
5.过表达TRIM10增加H/R处理诱导的JNK和P38MAPK蛋白的磷酸化水平,而对ERK蛋白的磷酸化水平无影响 与Control组相比,H/R明显增加JNK、P38MAPK、ERK蛋白的磷酸化;而过表达TRIM10增加H/R诱导的JNK、P38MAPK蛋白的磷酸化,而对ERK的磷酸化水平无影响(图5)。
讨 论

图1 原代SD大鼠乳鼠心肌细胞不同时间培养后TRIM10蛋白的表达(n=5)

图2 敲低或过表达TRIM10对H/R诱导的ROS产生的影响 A:原代SD鼠乳鼠心肌细胞培养24 h TRIM10蛋白的表达,B:原代SD大鼠乳鼠心肌细胞培养24 h,荧光显微镜观察绿色细胞阳性数, C-D:DHE染色检测细胞氧化应激情况(n=5)。注:与对照组比较,*P<0.05;与H/R组比较,#P<0.05
本实验研究发现缺氧/复氧(H/R)损伤增加心肌细胞中TRIM10蛋白的表达,提示TRIM10参与心肌缺氧/复氧损伤的发生。敲低TRIM10减轻H/R诱导的氧化应激和细胞凋亡的发生,并下调BAX蛋白的表达。而过表达TRIM10,加重H/R诱导以上的改变。进一步我们又探讨了TRIM10参与以上作用的机制,发现敲低TRIM10明显降低了H/R诱导的心肌细胞中p-JNK和p-P38MAPK的水平,而对p-ERK的表达无影响,提示TRIM10可能通过激活JNK/P38MAPK通路来诱导细胞凋亡的发生进而加重心肌细胞缺氧/复氧损伤。
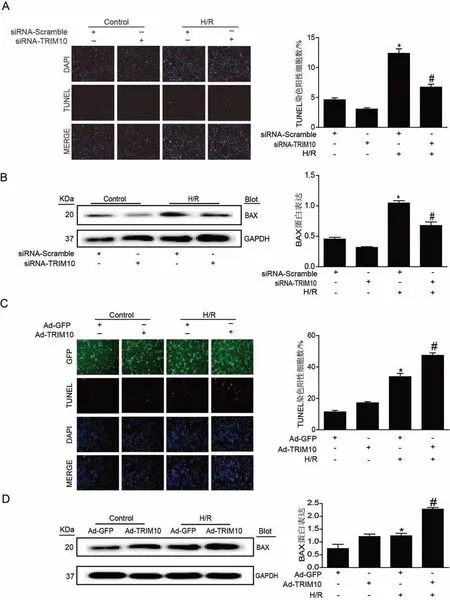
图3 敲低或过表达TRIM10对H/R诱导的心肌细胞凋亡的影响 A:TUNEL染色检测敲低TRIM10对H/R诱导的心肌细胞凋亡的影响(n=5),B:WB检测敲低TRIM10对H/R诱导的促凋亡蛋白BAX表达的影响(n=5),C:TUNEL染色检测过表达TRIM10对H/R诱导的心肌细胞凋亡的影响(n=5),D:WB检测过表达TRIM10对H/R诱导的促凋亡蛋白BAX表达的影响(n=5)。注:与对照组比较,*P<0.05;与H/R组比较,#P<0.05

图4 敲低TRIM10对H/R诱导的JNK、P38MAPK、ERK蛋白磷酸化水平的影响(n=5) 注:与对照组比较,*P<0.05;与H/R组比较,#P<0.05
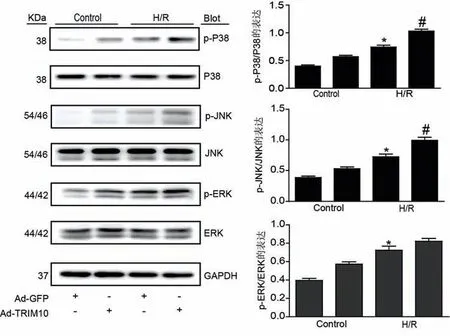
图5 过表达TRIM10对H/R诱导的JNK、P38MAPK、ERK蛋白磷酸化水平的影响(n=5) 注:与对照组比较,*P<0.05;与H/R组比较,#P<0.05
文献报道TRIM家族在调节细胞增殖、分化、个体发育、肿瘤及细胞凋亡等多种生物学过程发挥重 要的作用。比如TRIM45可与膜转运家族蛋白SLC25A3以及热休克家族蛋白DNAJB6发生相互作用,通过阻断钙调磷酸酶介导心肌肥厚的发生。肌肉特异性TRIM家族蛋白MG53是心脏缺血预处理(ischemic preconditioning,IPC)的组成部分,MG53表达下调可加重心肌缺血-再灌注损伤并取消IPC保护作用,而过表达MG53可减弱缺氧和H2O2诱导的心肌细胞死亡,其作用机制为MG53依赖的caveolin-3与磷脂酰肌醇3激酶的相互作用和随后再灌注损伤补救激酶通路的激活[15]。TRIM10为TRIM家族成员之一,具有TRIM家族所共有的结构域,具有E3连接酶的结构和功能。研究表明TRIM10可调节胚胎发育、红系细胞生成以及成年小鼠的红细胞分化与增殖。本研究发现敲低TRIM10可减少H/R诱导的ROS的产生和心肌细胞的凋亡,而过表达则加重以上改变,说明TRIM10参与了心肌细胞缺氧/复氧的发生。
近些年研究发现细胞凋亡是心肌发生缺血-再灌注损伤重要的环节之一[16],而丝裂原活化的蛋白激酶(mitogen-activated protein kinases,MAPKs)信号途径介到了心肌凋亡的发生。MAPKs存在于所有生物体内的大多数细胞内,是真核生物细胞重要的信号转导通路,与细胞的增殖、存活、分化和凋亡等密切相关。其主要家族成员主要包括ERKs,JNKs和p38MAPKs。目前的研究证实P38、JNK的激活参与了心肌细胞促凋亡的过程[17]。Kasier等的研究发现,p38MAPK的激活或过度表达p38MAPK基因均使缺血-再灌注引起的心肌细胞凋亡明显增加,心功能降低[18]。抑制JNK活性后能够保护心肌损伤,减小心梗面积和细胞凋亡[19]。本实验研究发现敲低TRIM10可减轻H/R诱导的P38MAPK、JNK蛋白的磷酸化水平,提示TRIM10可能是通过激活P38MAPK和JNK信号转导通路诱导细胞凋亡从而促进心肌细胞缺氧/复氧损伤的发生。
总之,本实验研究发现泛素E3连接酶TRIM10可加重H/R诱导的心肌细胞氧化应激、细胞凋亡进而参与心肌细胞缺氧/复氧损伤的发生,其机制可能为通过激活P38MAPK和JNK通路所介导,但是仍需要在基因敲除和过表达小鼠模型中进一步验证TRIM10的作用及其靶分子。
