两种结核分枝杆菌培养法在结核小鼠感染模型实验中的应用对比
2019-06-05刘志昊穆大业占玲俊章晓联
刘志昊,穆大业,占玲俊*,章晓联*
(1. 武汉大学基础医学院免疫学系,病毒学国家重点实验室,湖北省过敏及免疫相关疾病重点实验室和医学研究院,武汉 430071;2. 中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021)
结核病已成为全球第九大死因,持续威胁人类健康。据世界卫生组织(World Health Organization, WHO)报告,2017年全球结核病新发病例数约为 1000 万例,新增 55.8 万例利福平耐药结核病,其中82%是耐多药结核病,给结核的防治带来极大的障碍[1]。
早诊断、早治疗尤其是有效治疗是防治结核病的关键,因此WHO近年来不断推动结核的快速诊断、药敏实验(drug susceptibility testing,DST)快速检测和新药及短程化疗方案的开发[2]。目前结核的诊断和药敏实验包括以基因检测为基础的检测法和培养法,其中培养法是WHO推荐的金标准法。尽管现在以基因检测为基础的检测方法可在2~24 h内获得诊断和一二线药物药敏实验结果[3-5],但基于基因检测的方法无法判定菌的存活,且对某些重要二线药物耐药分子的认知不足,基因检测法的应用有局限,培养法在结核的诊断与DST与临床治疗方案制定中仍有重要作用[6]。临床样本的培养中多项研究均证明BACTEC MGIT 960系统培养和传统L-J培养法检测结果具有高度的可比性和一致性[7-8],然而BACTEC MGIT 960从操作标准化与检测时间上均优于L-J培养法,故BACTEC MGIT 960培养在临床上在结核诊断和一二线药物药敏实验中应用逐步增多[9]。
在结核动物模型的体内药物和疫苗效果评价的最主要的判断指标之一是检测组织荷菌量[10-12],目前采用L-J或7H11培养法进行菌落计数,通过菌落计数结果分析判断药物或疫苗在动物模型中是否有效,而BACTEC MGIT 960仅用于体外新药的最小抑菌浓度(minimum inhibitory concentration,MIC)[13-14]或临床痰标本的药敏测定,较少应用于结核感染动物模型中荷菌量检测。因此,本研究通过BACTEC MGIT 960培养法与L-J培养法检测结核模型对照小鼠和利福平(rifampin,RIF)治疗后结核感染小鼠模型中的荷菌量变化,以比较两种方法在小鼠结核动物模型中组织荷菌量的精确性和吻合度,以期将BACTEC MGIT 960培养系统用于结核药物和疫苗早期效果评价从而快速获得结果。
1 材料和方法
1.1 实验材料
1.1.1 菌株
结核分枝杆菌标准株H37Rv(菌株编号93009)由中国药品生物制品检定所提供。
1.1.2 实验动物
6~8周龄SPF级C57BL/6雌性小鼠36只,体重17~19 g,购自北京维通利华实验动物技术有限公司[SCXK (京) 2016-0006]。动物的饲养与实验在中国医学科学院医学实验动物研究所生物安全3级实验室(国卫ABSL3-059)进行,在感染前1周,将动物放入生物安全3级实验室适应。实验动物的使用得到了中国医学科学院医学实验动物研究所实验动物使用与管理委员会的批准(批准号:ZLJ17002),在实验动物饲养和实验过程中严格按照3R原则设计、开展动物实验。
1.2 主要试剂与仪器
分枝杆菌中性罗氏培养管购自中国珠海贝索生物技术有限公司;细菌超声分散计数仪购自中国广东体必康生物科技有限公司;BACTEC MGIT 960全自动分枝杆菌培养仪及相关试剂购自BD公司;NanoZoomer S60明场荧光切片扫描仪(日本)。
1.3 实验方法
1.3.1 实验分组
实验分为两组,MGIT960组和L-J培养组,每种方法均用于检测结核小鼠模型和RIF治疗后小鼠结核模型中组织荷菌量,感染的模型对照和RIF治疗小鼠各18只。
1.3.2 菌液制备
将种子批结核分支杆菌标准株H37Rv置于中性罗氏培养培养,收获培养4周的结核分枝杆菌,无菌过滤制成单细胞悬液,用细菌超声分散计数仪分散均匀后制备攻击用菌悬液,浓度为1.0×107CFU(colony forming units,菌落形成单位)/mL。
1.3.3 动物感染和取材
每只小鼠尾静脉注射100 mL H37Rv菌液感染C57BL/6小鼠,菌液浓度为1×107CFU/mL[15]。感染7 d后,将小鼠随机分为RIF治疗组与感染对照组,RIF治疗组按每天20 mg/kg治疗4周,感染对照组注射等量的PBS。无菌条件下4周后小鼠脱颈椎处死,解剖肺、脾、肝组织进行荷菌量的检测和病理分析。
1.3.4 靶器官组织荷菌量检测
取左侧肺组织,脾头三分之一及肝腹背部的小叶,加入1 mL生理盐水进行组织研磨匀浆。
(1)L-J培养:将匀浆液用生理盐水按照1∶10的比例进行梯度稀释,分别取1∶100、1∶1000、1∶10 000三个稀释梯度稀释液50 L,接种于分支杆菌中性罗氏培养管进行培养,每个梯度接种3管,培养3至4周进行菌落计数[15]。
(2)BACTEC MGIT 960培养:按照BACTEC MGIT 960全自动分支杆菌系统操作指南要求,取1:10稀释的研磨液0.5 mL接种于BACTEC MGIT 7H9培养管中,加入0.8 mL添加剂,放入BACTEC MGIT 960全自动分枝杆菌培养仪中培养,每日观察培养结果,记录出现阳性结果的最早时间称为报阳时间(time to positive,TTP)[16]。
1.3.5 病理学检测
无菌条件下将剩余肺、脾、肝组织于4%多聚甲醛中固定,经脱水、浸蜡、包埋,切成5 μm切片后行HE染色,观察各组织病变情况。
1.4 统计学方法
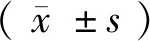
2 结果
2.1 BACTEC MGIT 960全自动分枝杆菌培养仪培养结果
RIF治疗组肺、肝及脾组织报阳时间分别为(187.11±10.20) h、(347.22±12.70) h、(276.39±13.09) h,模型对照组肺、肝及脾报阳时间分别为(142.50±11.70) h、(251.67±16.63) h、(230.28±7.22) h(表1)。RIF治疗组脏器报阳时间均长于感染对照组,差异有显著性(P< 0.001)(图1),说明RIF治疗组小鼠脏器菌量较少即RIF能在小鼠体内能抑制结核分支杆菌。
2.2 分支杆菌中性罗氏培养管培养结果
RIF治疗组肺、肝及脾组织菌落数分别为(5.15±0.15) log10CFU、(3.30±0.23) log10CFU、(3.40±0.25) log10CFU,模型对照组肺、肝及脾菌落数分别为(5.90±0.25) log10CFU、(3.88±0.31) log10CFU、(4.15±0.30) log10CFU(表2)。RIF治疗组脏器菌落数均少于感染对照组,差异有显著性(P< 0.001)(图2),说明RIF治疗组小鼠脏器菌量较少即RIF能在小鼠体内能抑制结核分支杆菌。

表1 小鼠靶器官组织研磨液BACTEC MGIT 960培养结果
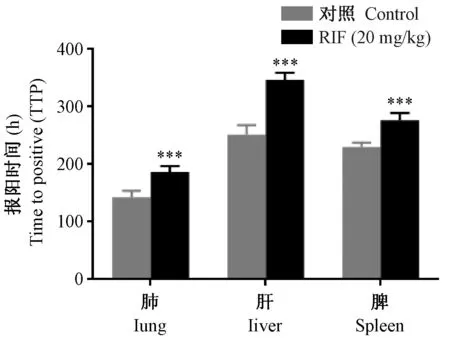
图1 960培养系统靶器官荷菌量比较Figure 1 Comparison of bacterial loading counts in the target organs by 960 culture system
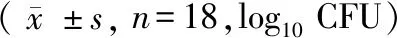
表2 小鼠靶器官组织研磨液罗氏培养基结果Table 2 Results of the culture of mouse target organ tissues by L-J culture
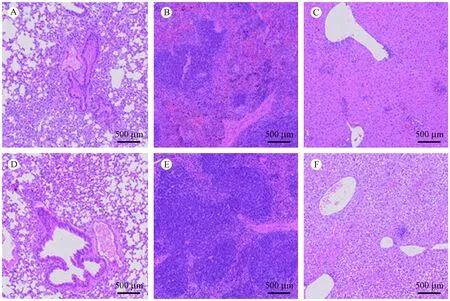
注:A、B、C为对照组肺、脾、肝;D、E、F为RIF治疗组肺、脾、肝。图3 小鼠结核模型中治疗组与感染对照组肺脾肝病理变化图(HE染色,× 50)Note. A, B, C, Lung, spleen, and liver tissues in the control group. D, E, F, Lung, spleen, and liver in the treatment group.Figure 3 Pathological changes in the lung, spleen, and liver in the treatment group and infection control group in the mouse tuberculosis model. HE staining
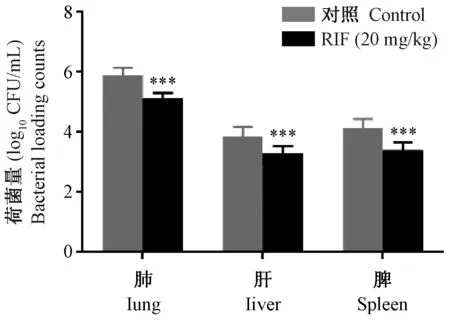
图2 罗氏培养法靶器官荷菌量比较Figure 2 Comparison of bacterial loading counts in target organs by L-J plate culture
2.3 小鼠组织病理变化
小鼠感染结核菌4周后,肺组织出现多处炎症反应,呈实变趋势,其中肺泡壁增厚,肺泡腔被淋巴细胞等炎症细胞填充,RIF治疗后肺泡结构多数较完整,仅有小面积肺泡被炎症细胞浸润。模型小鼠的脾白髓被结核肉芽肿病变破坏,可见炎症细胞的聚集,RIF治疗后白髓结构相对完整,炎症细胞聚集较少。模型小鼠肝出现多个散在小肉芽肿样病变,RIF治疗后病变较轻,仅出现少量肉芽肿样病变及轻度肝细胞水肿。病理结果说明RIF治疗组小鼠肺、脾、肝病变均较轻,即RIF在小鼠体内能抑制结核分支杆菌。如图3所示。
3 讨论
在药效评价和疫苗评价中,通过分析动物模型中组织荷菌量是前期评判药物治疗效果的主要方法,采用罗氏培养基培养法进行菌落培养是常用方法之一[17-18]。然而,L-J培养法由于耗时长,操作繁琐需要新的替代方法。
BACTEC MGIT 960虽然具有培养时间短、操作标准化、工作量较小的优点,用于结核分支杆菌临床检测及药敏实验等定性分析,但较少在动物模型中应用。在抗结核新药AZD5847、PA-824组合疗法临床试验中,采用BACTEC MGIT 960、固体培养法同时培养受试者痰标本,根据标本TTP与CFU结果判断药物早期杀菌活性(early bactericidal activity,EBA),两种培养方法结果一致[16,19]。因此,本实验参考此方法,通过建立小鼠急性结核感染模型,用两种方法同时评估结核模型小鼠及RIF治疗的小鼠组织荷菌量,验证两种方法在模型应用中的一致性,从而探索将MGIT 960运用于结核小鼠动物模型中结核药物和疫苗效果的快速评估。
本实验结果显示,小鼠感染结核后,虽无明显的临床表现,但是组织病变和菌培养结果证实,结核感染模型构建成功。其中MGIT 960和L-J培养两种方法均显示:RIF治疗后肺、脾、肝3个靶器官组织培养结果与模型小鼠培养结果相比,差异均有显著性,两种培养方法结论一致,并且MGIT 960全自动分枝杆菌培养培养时间125~354 h(即平均239 h)远低于罗氏培养基法4周(672 h)培养时间,3个靶器官在模型和RIF治疗后之数值差异更大,较传统罗氏培养法组间差异区分度高,在药效或疫苗评价中优势更明显。
综上所述,BACTEC MGIT 960培养法可运用于结核感染动物模型中荷菌量的检测,且与L-J培养法相比具有培养周期短、区分度高的优势,有望应用于结核药物和疫苗效果的快速评估。
