CRISPR/Cas9系统介导Slc6a6基因敲除大鼠的繁殖与鉴定
2019-06-05仝慧慧齐浩铭莫丽冬范维佳徐立霞么秀华夏一鸣黄慧玲
仝慧慧,齐浩铭,王 辰,莫丽冬,范维佳,徐立霞,么秀华, 夏一鸣,黄慧玲*
(1. 天津医科大学,天津 300070;2. 天津市环湖医院,天津市神经外科研究所, 天津市脑血管与神经变性重点实验室,天津 300350)
牛磺酸(taurine,Tau)是一种含硫氨基酸,能调节细胞渗透压,防止细胞内钙超载,减少自由基产生,改善细胞膜的通透性,防止细胞肿胀变形[1-2],是婴儿中枢神经系统发育期间的重要营养因子,有增强突触传递,缓解中风、癫痫、神经退行性疾病症状等神经保护作用[3-4]。Tau主要是由细胞膜上的牛磺酸转运体(taurine transporter,TauT,Slc6a6,序列参考号:NC_005103.4)转运至细胞内,以维持细胞内Tau的高浓度,TauT是由621个氨基酸残基组成的大小约74×103的蛋白质,包含12个跨膜螺旋区。在急性损伤发生后,细胞内的Tau可调节脑细胞渗透压,改善神经元肿胀。本课题组前期实验证实,颅脑创伤后,脑水含量和水通道蛋白4的表达升高,Tau可以使其下调,改善神经元损伤等[5]。
为研究Tau缺乏对机体的影响,研究人员通常选用补充TauT抑制剂如β-丙氨酸等干扰Tau吸收的方法制作动物模型,但是这种一过式的抑制牛磺酸摄入的方法,短暂且不稳定,故急需一种更稳定有效的方法构建该动物模型。近几年发展的CRISPR/Cas9技术可以敲除特定基因位点,有靶向精确度高、实验周期短,无物种限制,且比ZFN、TALEN技术易操纵[6-8]等优势,得以推广。
本研究利用CRISPR/Cas9系统,首次建立Slc6a6基因敲除大鼠模型(TauT-/-大鼠),并进行繁殖和鉴定,为进一步研究Tau对大鼠神经系统疾病模型的影响,提供可靠而稳定的基因工程模型,为阐明Tau对相关疾病的治疗作用等探究工作奠定基础。
1 材料和方法
1.1 实验动物
本实验所需野生型大鼠均选用SPF级SD大鼠,体重240~260 g,购自北京华阜康生物科技股份有限公司[SCXK (京) 2014-0004];TauT+/-大鼠委托中国医学科学院医学实验动物研究所构建,得到F0代2只(雌雄各1只)[SCXK京2013-0002],本课题组对TauT+/-大鼠进行饲养、配笼繁殖,并对纯合TauT-/-大鼠进行鉴定筛选,Slc6a6基因表达鉴定实验所用大鼠:纯合子(TauT-/-大鼠)、阴性(TauT+/+大鼠)、野生型大鼠(WT大鼠)均为2月龄SPF级雄性大鼠,每组各6只,体重240~260 g。饲养和繁殖均在中国医学科学院放射医学研究所屏障环境中进行[SYXK (津) 2014-0002],其温度、相对湿度、换气次数、明暗周期等均符合中华人民共和国国家标准(GB14925-2010)。本研究中涉及的全部动物实验方案,均参考中国医学科学院放射医学研究所实验动物伦理委员会有关实验动物使用的相关规定,满足实验动物福利要求,并遵照实验动物使用的3R原则给予人道关怀。相关动物实验伦理审查证明编号为:DWLL-20180916和DWLL-20180917。
1.2 主要试剂与仪器
Cas9 mRNA合成试剂盒T7 Ultra kit (美国Ambion公司,AM1345)、sgRNA的体外转录试剂盒MEGA shortscript Kit (美国Ambion公司,AM1345)、EasyPure Genomic DNA kit(北京全式金生物技术有限公司,EE101-12)、Genstar 2× Taq PCR StarMix with Loading Dye(深圳辉诺生物科技有限公司,A112-10)、RNA simple Total RNA kit、RT-PCR kit(天根生化科技(北京)有限公司,DP419、KR118、FP205),DAB显色剂(美国Sigma公司,D8001),TauT抗体(E-10)(美国Santa Cruz Biotechnology公司,sc-166640),IgG抗体-Fab段-HRP多聚体(德国Leica公司,通用型),兔抗小鼠辣根过氧化物酶标记二抗、β-actin二抗(北京中杉金桥生物技术有限公司,bs-10966R、ZB2301),β-actin一抗(北京博奥森生物科技有限公司,bs-0061R)。显微注射仪(日本尼康公司,TE2000U)、凝胶成像系统(英国Syngene公司,Gene Genius)、ABI一代测序仪(美国ABI公司,3500)、低温高速离心机(美国Beckman公司,J2-21)、Mini-PROTEAN Tetra Cell电泳系统、Mini Trans-Blot Cell型转膜系统(美国Bio-Rad公司,1658033、1703930)、荧光定量PCR仪(瑞士Roche 公司,LC480)、徕卡全自动免疫组化仪(德国Leica公司,BOND-Ⅲ),显微镜(日本Olympus公司,BX3-CBH)。
1.3 实验方法
1.3.1 TauT-/-大鼠的构建和繁殖
TauT-/-大鼠模型,是采用CRISPR/Cas9基因编辑技术,针对TauT基因第5外显子,选择2个不同sgRNA的作用靶点,合成两对寡聚核苷酸链(Rat-Slc6a6-gRNA1-up:TAGGCCCCTTTGTCCCACAGAC和Rat-Slc6a6-gRNA1-down:AAACGTCTGTGGGACA AAGGGG;Rat-Slc6a6-gRNA2-up:TAGGGACAGACC CTGTCTCTGG和Rat-Slc6a6-gRNA2-down:AAACCC AGAGACAGGGTCTGTC),经退火,连入BsaI酶切回收的pUC57-sgRNA表达载体,同时构建Cas9表达载体(pST1374-NLS-flag-linker-Cas9,Addgene ID: 44758)。经测序验证构建的载体序列无误后,分别由DraⅠ、AgeⅠ酶切、抽提纯化,经体外转录获得Cas9 mRNA和sgRNA,将其混合,调整浓度Cas9 mRNA(20 ng/μL) 和sgRNA(10 ng/μL)后,通过显微注射法注射到SD大鼠受精卵的雄性胞核和细胞质中,再植入假孕大鼠体内,繁殖得到 founder 大鼠(F0 代)。
将F0代阳性大鼠与野生型SD大鼠合笼,得到F1代杂合子(TauT+/-大鼠),再选择F1代TauT+/-大鼠与野生型SD大鼠合笼以扩充体系,得到TauT+/-F2代大鼠,F2代TauT+/-大鼠自交后,得到TauT+/+,TauT+/-和Tau-/-三种F3代基因型大鼠。
1.3.2 基因组提取、扩增和测序
利用CRISPR/Cas9系统,将包括Slc6a6基因第五外显子的共约390 bp的片段靶向敲除,通过基因型鉴定,分析新生大鼠的基因分型。将出生10-12 d左右的大鼠,采用剪趾法编号,并提取大鼠基因组DNA,经PCR 扩增靶序列,鉴定所用上游引物:5’-TCATTGTCCTGTCCCCACTTCTT-3’,下游引物:5’-TCCTCATCTGACAGTTAAAGAATCTAAGG-3’。PCR的体系和条件参见Genstar试剂盒说明书。结果判断依据:阴性TauT+/+是一条带:702 bp,杂合子TauT+/-含有两条带,分别为702 bp和312 bp,纯合子TauT-/-是一条带:312 bp。
提取F1代TauT+/-、F3代TauT+/+和TauT-/-的基因组,经PCR扩增,由上海生物工程公司测序后,再与F0代比对,以确定 CRISPR/Cas9 介导的基因敲除情况。
1.3.3 Real-time PCR检测TauT-/-和TauT+/+大鼠脑组织中Slc6a6的表达
选取TauT-/-、野生型(WT)和TauT+/+大鼠雄性各6只,提取大脑组织总RNA,反转录后,real-time PCR检测Slc6a6 mRNA表达。Slc6a6基因引物序列:上游5’-GAGGTCATCATAGGCCAGTAC-3’;下游5’-GTACACATTCAGGAGGGACAC-3’,扩增产物为120 bp。以GAPDH为内参:上游5’-AACTCCCATT CTTCCACC-3’;下游5’-ACCACCCTGTTGCTGTAG-3’。扩增产物为100 bp。PCR反应体系:10 μL的2× SYBR Green Mix,上下游引物(10 μmol/L)各1 μL,1 μL的cDNA,补充ddH2O至20 μL。PCR反应条件:95℃预变性5 min,94℃变性15 s,60℃退火15 s,72℃延伸15 s,40个循环,最后72℃延伸5 min。TauT、GAPDH的退火温度分别是60℃和55℃。样本目的基因的相对表达量计算公式为:相对表达量=2-△△Ct[△Ct=Ct1-Ct2;Ct1:样品目的基因的临界循环数;Ct2:样品管家基因的临界循环数。△△Ct=每组△Ct值-(对照组△Ct的平均值)]。
1.3.4 Western blot技术检测TauT-/-和TauT+/+大脑组织中TauT蛋白表达
选取TauT-/-和TauT+/+大鼠雄性各6只,麻醉处死,提取大脑组织,匀浆后,提取并测定总蛋白浓度,等质量上样,进行SDS-PAGE电泳,70 V,40 min,120 V,90 min。300 mA湿转120 min,5%脱脂奶粉封闭2 h,加入Santa Cruz TauT一抗(1∶200)、β-actin一抗(1∶1000),4℃孵育过夜,次日洗膜,孵HRP标记的二抗(1∶1000)常温孵育2 h,洗膜3次。加入显影剂,于成像系统进行图像采集。样本中目的蛋白的相对表达量是目的蛋白条带与内参β-actin 蛋白条带灰度值的比值。
1.3.5 免疫组化检测TauT-/-和TauT+/+大脑组织TauT蛋白的表达
心脏灌注TauT-/-和TauT+/+大鼠后,取脑组织,放入10%中性福尔马林溶液,固定24 h之后,脱水,包埋制成蜡块,4 μm切片,68℃烤箱烤片,再利用Leica BOND-Ⅲ全自动免疫组化仪进行常规染色程序:脱蜡、水化、封闭、孵育TauT一抗 (1∶100)、冲洗、孵育二抗、冲洗、DAB染色、苏木精复染,脱水透明、封片,光学显微镜下观察,图像采集、分析结果。
1.4 统计学方法
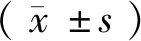
2 结果
2.1 大鼠的构建和繁殖情况
利用CRISPR/Cas9系统进行目的基因敲除,使Slc6a6基因发生移码突变,并提前产生了终止密码子,使翻译提前终止,造成蛋白功能障碍(图1)。
历时约15个月, F1和F2代共繁育出23窝,F1~F3代总计184只,F3代出现纯合子,该代纯合率约为20.59%。F3代TauT+/+:TauT+/-:TauT-/-的比例约为1∶2.57∶1.28,近似满足孟德尔遗传定律。繁殖过程中,成年鼠死亡14只,死亡率约为7.61%。F1~F3代大鼠繁殖情况见表1,多组F2代TauT+/-大鼠自交情况统计见表2。
2.2 基因型鉴定和测序结果
F0代TauT+/-大鼠与野生SD大鼠杂交,得到F1 代TauT+/-和TauT+/+大鼠,F1 代TauT+/-与野生大鼠杂交继续扩充体系,F2后代TauT+/-自交,F3代出现TauT-/-大鼠。基因型鉴定结果如图2: TauT-/-:一条带,312 bp;TauT+/-:两条带,为702 bp和312 bp。TauT+/+/ WT:一条带,702 bp。
测序比对结果显示, TauT-/-或TauT+/-(包含的缺失链)的基因缺失位点,如图3A。TauT-/-和TauT+/+大鼠序列比对和靶点敲除情况,如图3B、3C。TauT+/+基因型大鼠和TauT-/-基因型大鼠序列相差约390 bp,缺失靶点上下游序列对应一致。
由基因型鉴定和测序结果可知:包含TauT-/-大鼠的第5外显子的390 bp碱基被敲除,并发生重组修复。
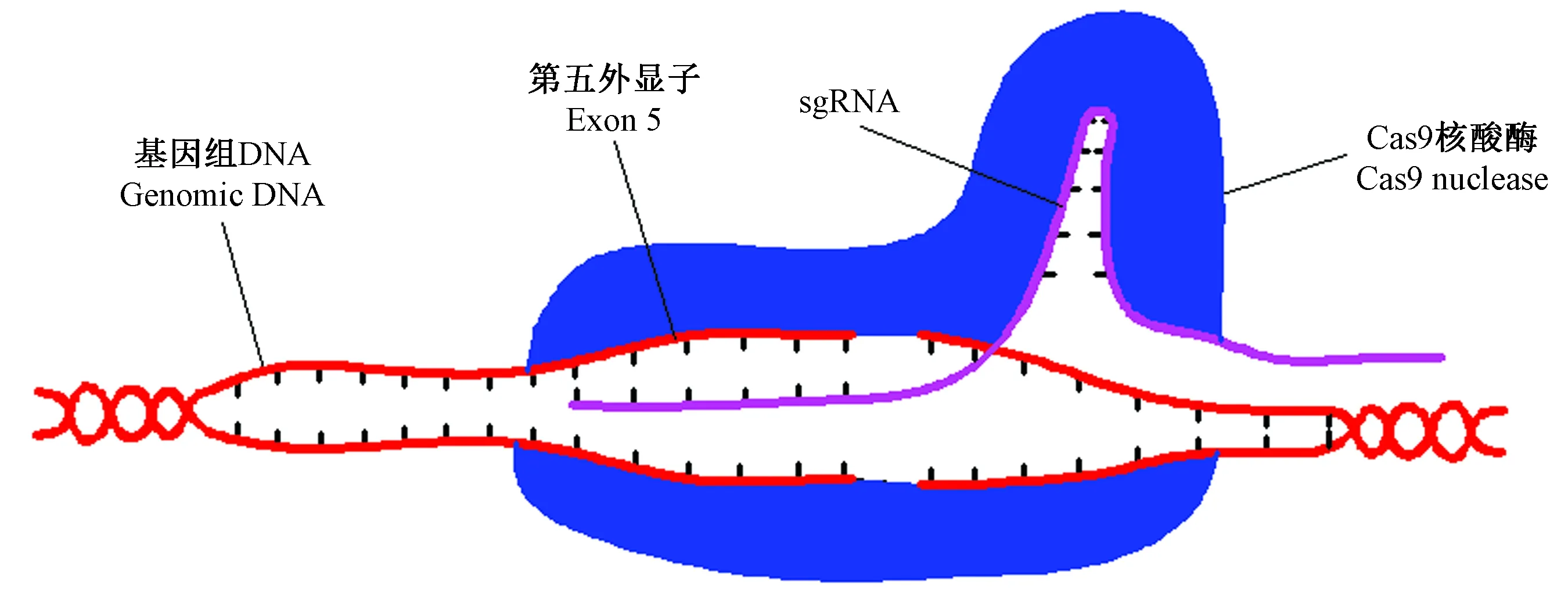
图1 利用CRISPR/Cas9技术敲除Slc6a6第五外显子的示意图Figure 1 Schematic diagram of the knockout of the fifth exon of Slc6a6 by CRISPR/Cas9 technology

表1 F1~F3代大鼠繁殖情况
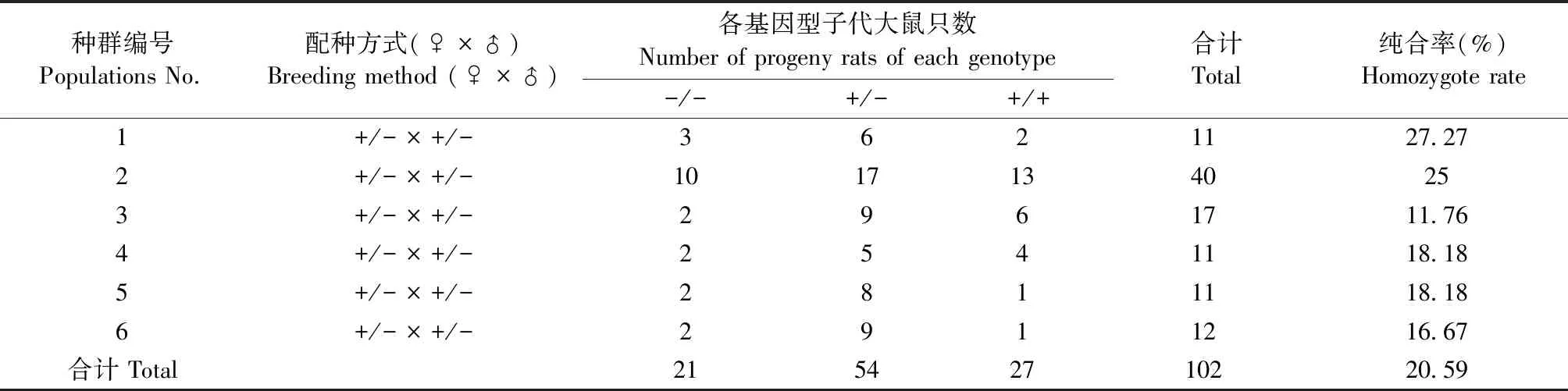
表2 F2代不同种群大鼠的繁育结果
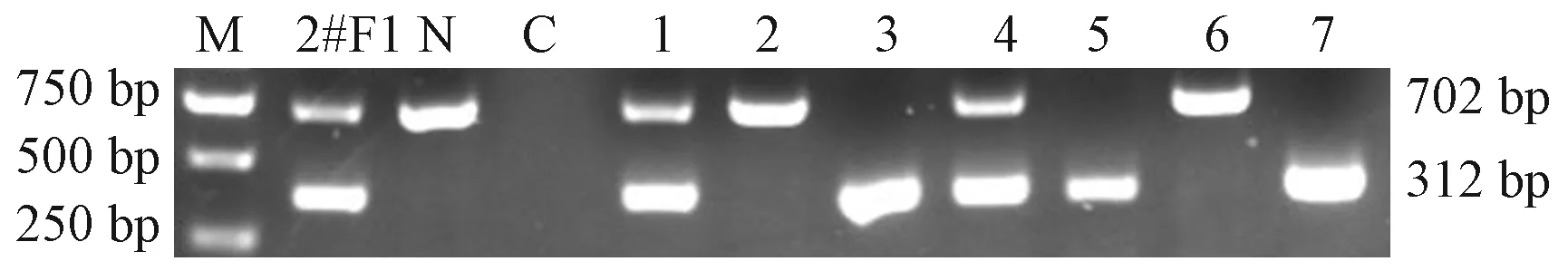
注:M:DNA分子量标记;2#F1:TauT+/-;C:空白对照;N:WT;孔道3、5、7:TauT-/-大鼠;孔道2、6:TauT+/+大鼠;孔道1、4:TauT+/-大鼠。图2 部分大鼠基因型PCR鉴定结果Note. M, DNA molecular weight marker; 2#F1, TauT+/-; C, Blank control; N, Wild type; Lanes 3, 5, and 7: TauT-/- rat; Lanes 2 and 6: TauT+/+ rat; Lanes 1 and 4: TauT+/- rat.Figure 2 Results of genotype identification of the rats by PCR
2.3 Real-time PCR检测TauT-/-和TauT+/+大鼠脑组织Slc6a6的表达
TauT-/-大鼠和同窝TauT+/+大鼠脑组织Slc6a6 mRNA表达结果显示:TauT-/-大鼠脑组织Slc6a6 mRNA几乎不表达(如图4C)。

注:A:TauT-/-大鼠测序结果,在“TTTG”碱基中间敲除了约390 bp;B: TauT-/-和TauT+/+大鼠序列比对结果,TauT-/-缺失390 bp;C:TauT+/+和TauT-/-大鼠碱基序列对比,矩形框区域为包含TauT第5外显子的靶序列,划线部分为Cas9核酸酶切割目的序列后重组修复随机添加的序列。图3 目的基因测序比对结果Note. A, The results of TauT-/- rat sequencing that have about 390 bp bases knocked out in the middle of “TTTG”. B, The results of TauT-/- and TauT+/+ rat sequence alignment: TauT-/- was missing about 390 bp. C, Base sequence comparison between TauT+/+ and TauT-/- rats: the rectangular box region is the target sequence containing the Tau5 exon 5 after Cas9 nuclease cleaves the sequence of interest. The underlined portion is the recombinantly added sequence.Figure 3 Results of target gene sequencing comparisons
2.4 Western blot技术检测TauT-/-和TauT+/+大鼠脑组织TauT蛋白的表达
蛋白免疫印迹实验结果表明,TauT-/-组大鼠大脑中TauT蛋白表达量与TauT+/+组大鼠相比,显著降低(如图4A、4B)。
2.5 TauT-/-和TauT+/+大鼠脑组织免疫组化结果
观察TauT-/-大鼠和TauT+/+大鼠两组皮层和海马区TauT蛋白表达的情况。如图5可见,TauT-/-大鼠的海马和皮层区细胞膜上基本无TauT蛋白表达,而TauT+/+鼠的海马和皮层区细胞膜上有TauT蛋白表达,表明Slc6a6基因的敲除导致TauT-/-大鼠脑组织TauT蛋白基本不表达。
3 讨论
在研究人类中枢神经系统疾病方面,大鼠与人更为接近,在生理、行为、代谢方面比小鼠更有优势[9]。大鼠广泛被用于:奖励和惩罚实验、神经官能症等高级神经活动的研究。由于构建和繁殖基因敲除大鼠比小鼠困难,2010年才建立了第一个基于胚胎干细胞的p53基因敲除大鼠模型。据报道[10-12]:自2003年CRISPR/Cas9系统发明以来,已有超过30种不同的转基因大鼠实验模型被用于神经科学、内分泌学和癌症等领域。目前,仅有关于TauT-/-小鼠模型的研究,对于Slc6a6基因敲除的大鼠模型及其有关的病理生理研究尚无文献报道。
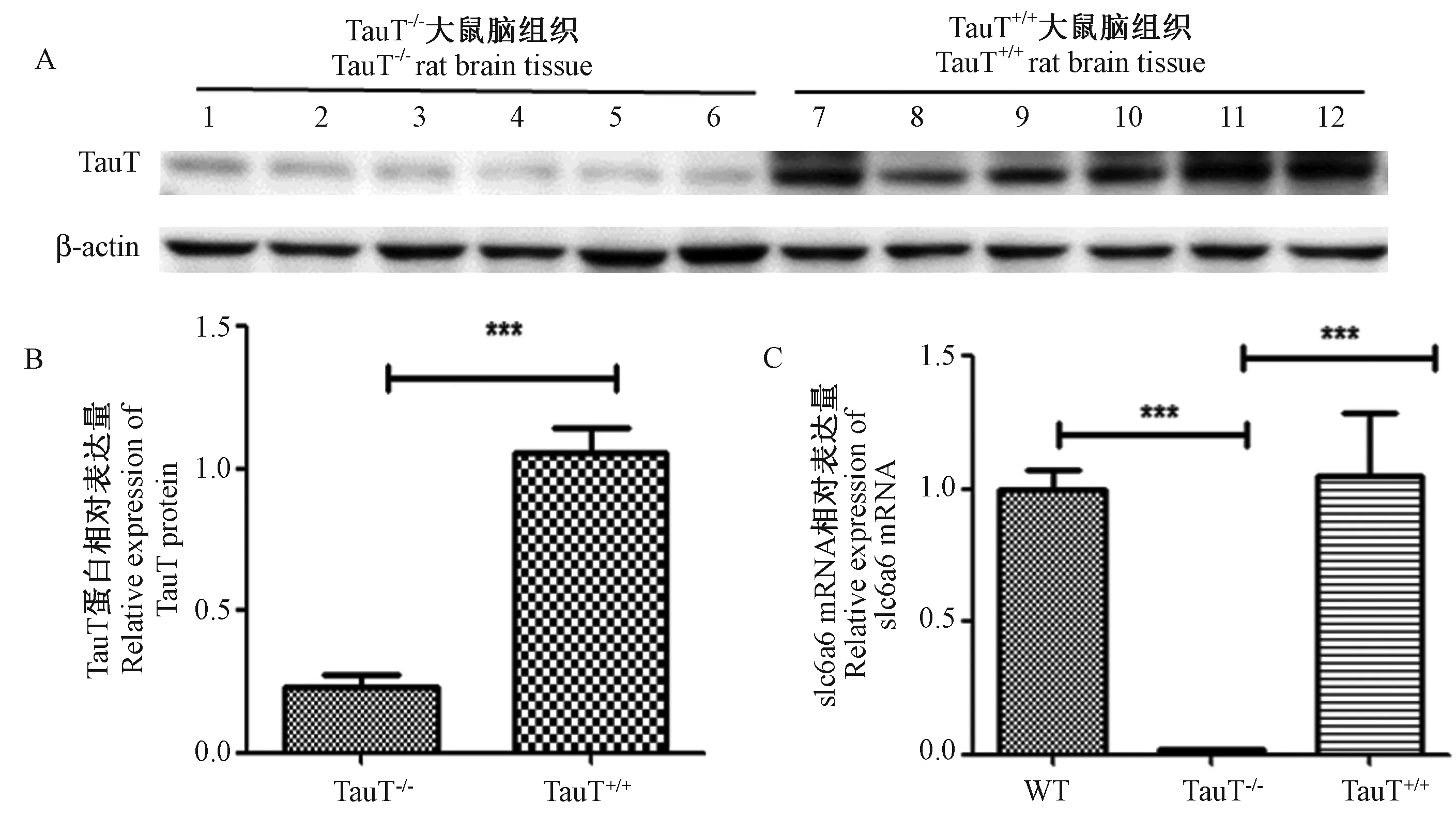
注:A: TauT-/-组与TauT+/+组TauT蛋白表达情况(n=6);B:TauT-/-组与TauT+/+组TauT蛋白表达相对定量分析,*** P < 0.001(n=6);C:TauT+/+组、WT组分别与TauT-/-组Slc6a6 mRNA表达相对定量分析比较,*** P< 0.001(n=6)。图4 不同基因型大鼠脑组织TauT蛋白和Slc6a6 mRNA表达的情况Note. A, TauT protein expression in the TauT-/- and TauT+/+ groups (n=6). B, Relative quantitative analysis of TauT protein expression in the TauT-/- and TauT+/+ groups.***P< 0.001 (n=6). C, Slc6a6 mRNA expression in the TauT+/+ and WT groups was compared with the TauT-/- group.***P< 0.001 (n=6).Figure 4 Expression of Slc6a6 mRNA and TauT protein in the brains of different genotypes of rats
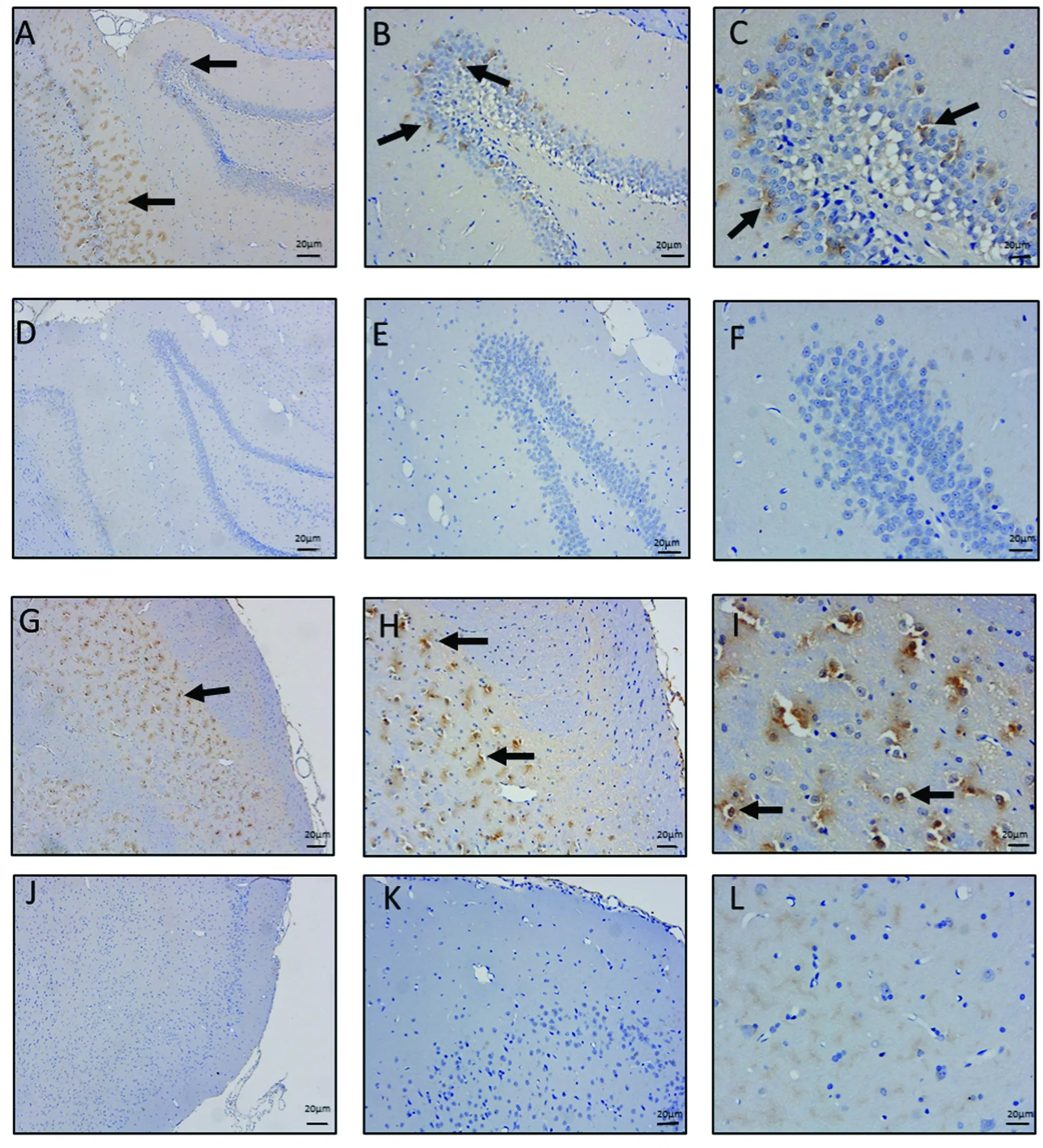
注:A、B、C:TauT+/+大鼠海马(分别为× 40、× 100、× 200);D、E、F:TauT-/-大鼠海马(分别为× 40、× 100、× 200);G、H、I:TauT+/+大鼠皮层(分别为× 40、× 100、× 200);J、K、L:TauT-/-大鼠皮层(分别为× 40、× 100、× 200)。箭头所示为TauT表达位置举例。标尺=20 μm。图5 TauT-/-与TauT+/+鼠脑部皮层和海马区附近的免疫组化结果比较Note. A, B, and C, the TauT+/+ rat hippocampus (× 40, × 100, and × 200, respectively). D, E, and F, the TauT-/- rat hippocampus (× 40, × 100, × 200, respectively). G, H, and I, the TauT+/+ rat cortex (× 40, × 100, × 200, respectively). J, K, and L, the TauT-/- rat cortex (× 40, × 100, × 200, respectively). The arrows show examples of TauT expression positions.Bars=20 μm.Figure 5 Comparison of immunohistochemistry results between TauT, TauT-/- and TauT+/+ rat brain, cortex, and hippocampus
本课题组委托中国医学科学院医学实验动物研究所,经专业技术人员精心设计,选择了具有较低脱靶概率的靶点,利用CRISPR/Cas9技术,基于Slc6a6的第5外显子,构建了TauT+/-大鼠模型。我们后续对TauT+/-大鼠进行饲养、配笼繁殖、鉴定筛选出TauT-/-大鼠,该模型大鼠Slc6a6基因的第5外显子被敲除,产生移码突变,翻译提前终止。基因型鉴定结果显示:F3代的TauT-/-大鼠的电泳结果与最初引进的TauT+/-大鼠电泳结果中的短链大小一致;同时,测序结果证实:TauT-/-大鼠的第5外显子成功被敲除。F3代TauT-/-缺失的片段和F0代杂合子的短链缺失片段一致。从繁殖情况来看,TauT-/-大鼠出生后,能够存活,为基因和蛋白水平的鉴定实验提供了条件。F3代的TauT+/+:TauT+/-:TauT-/-三种基因型大鼠的比例约为1∶2∶1,符合孟德尔遗传定律,因此该TauT-/-大鼠不具有胚胎致死性。初步统计,性别相同、月龄相近的TauT-/-大鼠比TauT+/+大鼠的体重低,这与Heller-Stilb等[13]发现TauT-/-小鼠的体重比野生小鼠低的结果一致。同期,观察到少量TauT-/-大鼠有性情稍暴躁、行动稍迟缓等现象,对此我们会继续保持关注。Ito等[13-14]通过同源重组技术敲除胚胎干细胞中TauT的第1或2-5个外显子,构建了TauT-/-小鼠,也发现TauT-/-模型小鼠体重降低,同时,心脏功能异常,运动能力降低[15-16]。Rikimaru等[17]也证明了TauT-/-大鼠线粒体的整体功能不如TauT+/+大鼠,关于TauT-/-大鼠线粒体功能受损情况,我们后期也将开展相关实验研究。
本研究中RT-PCR实验结果显示:TauT-/-大鼠脑部Slc6a6 mRNA几乎不表达,基因测序也显示TauT第5外显子完全敲除,其TauT蛋白表达量显著低于TauT+/+大鼠,免疫组化结果显示TauT-/-大鼠皮层和海马区附近几乎没有TauT蛋白表达,表明Slc6a6基因敲除大鼠模型构建成功。同时,海马齿状回区域细胞体积有收缩的现象,这可能与文献所报道Tau可诱导小鼠海马和纹状体突触传递增强有关[18]。.但本实验中, TauT-/-组大鼠Western blot结果仍显示有少量蛋白表达。推测产生该现象的原因是不同抗原和抗体存在一定的交叉反应(非目的蛋白可能含有能与目的蛋白抗体结合的抗原表位):(1)用CRISPR/Cas9系统敲除了第5外显子后,发生移码突变,提前产生终止密码子,造成翻译提前终止,形成无功能的肽链或蛋白,相应的肽链或蛋白可能会与原有完整蛋白的抗体产生非特异性结合;(2)理论上,敲除某个外显子碱基序列后,剩余核酸序列若含有ATG等起始密码子,其后的编码序列还会翻译出一段氨基酸序列,但这段序列不具备原有蛋白质的功能[19-21]。无论是利用传统的ES细胞打靶还是利用近些年发展起来的基因编辑手段,除非个别比较小的基因会选择全基因敲除,大部分情况下,都是选择上游的外显子或特定的功能区域外显子敲除,造成移码突变或者是特定功能区丧失,用于研究基因缺失和功能的关系。
综上,本研究应用CRISPR/Cas9系统定向敲除大鼠Slc6a6基因第5外显子,成功构建TauT-/-大鼠模型并稳定遗传,为探究牛磺酸预防和治疗神经系统疾病的相关机制研究,提供良好的大鼠模型。
