前列腺癌人源性异种移植裸鼠模型的建立与治疗
2019-06-05谭邓旭赵宁宁张彩勤师长宏
陈 薛,谭邓旭,赵宁宁,赵 勇,张彩勤,白 冰,师长宏, *
(1. 成都医学院基础医学院,成都 610500;2. 第四军医大学实验动物中心,西安 710032)
前列腺癌在病程的不同阶段表现出相当大的异质性,包括不同患者之间肿瘤分类和组织学特征的差异,以及同一患者不同病灶之间的生长速度和转移能力的差异,因此,需根据每个患者的实际情况选择适当的治疗方案[1-2]。目前,迫切需要模拟前列腺癌多样性和进展的动物模型进行临床前研究。利用新鲜的肿瘤标本建立的病人异种移植(patient-derived xenograft, PDX)模型可有效展示前列腺癌的异质性,用于药物筛选和发病机制研究展示出良好的应用前景,可为前列腺癌临床治疗提供理论依据。本文针对前列腺癌的临床特征,成功建立了激素敏感型和去势抵抗型前列腺癌PDX模型,并对其治疗效果进行了研究。
1 材料和方法
1.1 实验动物
6~8周龄雄性裸鼠35只,体重约20~22 g,由常州卡文斯实验动物有限公司提供[SCXK (苏) 2016-0010],饲养于空军军医大学(第四军医大学)实验动物中心SPF级屏障设施中[SYXK (陕) 2014-001],动物房环境温度和相对湿度分别维持在22℃~26℃和40%~60%,饲料及饮用水均经无菌处理,允许自由摄食和饮水。伦理审查及肿瘤标本:根据西京医院医学伦理委员会批准的方案,在获得患者本人及其家属知情同意后使用患者肿瘤标本及临床资料,批准编号:2015432;本研究所有动物实验均通过了空军军医大学(第四军医大学)实验动物福利及伦理委员会批准,编号:17013。
1.2 主要试剂与仪器
基质胶(美国BD公司);苏木精和伊红染色液(北京雷根(Leagene)生物技术有限公司);SP Rabbit HRP Kit(DAB)试剂盒(北京康为世纪生物科技有限公司);Anti-Prostate Specific Antigen抗体和Anti-Androgen Receptor 抗体(Abcam);组织基因组DNA提取试剂盒(天根生化科技(北京)有限公司)。多西他赛注射液(Docetaxel, DCTX, 商品名称:泰索帝/Taxotere)购自赛诺菲(杭州)制药有限公司。十一酸睾酮软胶囊(商品名:安特尔,40 mg/粒)购自N.V.Organon(The Netherlands)。
移植用手术器械(上海医疗器械有限公司,中国),普通离心机(Eppendorf,德国),高速分散机(IKA,德国),电子游标卡尺(Masterproof,德国),电子天平(赛多利斯科学仪器有限公司,中国),显微镜(Olympus,日本),电热恒温水槽(上海精宏实验设备有限公司,中国)。
1.3 实验方法
1.3.1 PDX模型的建立和STR分析
前列腺癌患者术后标本经病理学家评估后剔除脂肪和坏死组织,然后切成大小1~3 mm3的肿瘤碎片,与适量基质胶混合后移植小鼠右侧背部皮下,同时在另一侧皮下包埋一粒十一酸睾酮软胶囊(40 mg/粒)。待肿瘤生长至约800 mm3时,异氟烷麻醉裸鼠,取出肿瘤组织并将一部分肿瘤传代到新的裸鼠皮下。每一阶段均收集肿瘤样品并冷冻或包埋于石蜡中用于后续实验,连续传代3次,确定PDX模型建立成功。提取肿瘤组织中的基因组DNA,送西京医院司法鉴定中心进行STR分析(short tandem repeat profiling)。实验过程中严格遵守实验动物使用的3R原则给予人道主义关怀。
1.3.2 实验分组及治疗
选取激素敏感型(D17225)和去势抵抗型(C40019)两种不同类型的前列腺癌PDX模型进行后续研究。待皮下肿瘤生长至80~100 mm3时,D17225随机分为四组,如下:1)多西他赛组(docetaxel,DCTX):DCTX剂量为2 mg/kg,每周两次,尾静脉注射;2)去势组(castration,CAS):手术切除双侧睾丸及其附件; 3)多西他赛联合去势组(CAS+DCTX);和4)对照组(CON),每组5只;C40019随机分为三组,如下:1)DCTX,2 mg/kg,每周两次,尾静脉注射;2)CAS组和3)CON组。每周两次测量荷瘤鼠体重及肿瘤的最大长度(l)及宽度(w),并计算肿瘤体积:V=1/2×(w2×l)。治疗28 d后实验结束,次日将荷瘤鼠放入CO2容器内处死,取得的每个肿瘤样本分为两份,一份提取组织DNA,一份做组织4%多聚甲醛固定,包埋并石蜡切片。
1.3.3 HE及免疫组织化学染色
取患者肿瘤标本及治疗前后PDX肿瘤组织,分别进行HE及免疫组织化学染色。通过间接免疫过氧化物酶程序进行免疫组织化学染色,一抗前列腺特异性抗原(PSA)和雄激素受体(AR)均为兔抗人单克隆抗体,工作均为浓度1∶100,二抗为生物素标记羊抗兔二抗工作液。光学显微镜下观察出现背景清晰的棕色或棕黄色颗粒判为阳性染色。
1.3.4 血清tPSA检测
治疗结束后,各组前列腺癌荷瘤鼠心脏采血,静置4℃过夜,4500 r/min离心10 min,收集上层血清并送西京医院检验科检测总前列腺特异性抗原(tPSA)含量。
1.4 统计学方法
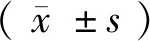
2 结果
2.1 不同类型前列腺癌PDX模型的表征
前期,我们实验室收集了20名患者的前列腺癌手术样本,并将它们植入到雄性裸小鼠皮下,初代PDX模型的建立时间从2个月到12个月以上不等。其中3个成功传代>3代,总体建模率约为15%。而后,我们在裸鼠皮下包埋睾酮软胶囊,探索了雄激素对前列腺癌生长及病情进展的影响,在补充外源性雄激素期间,动态监测小鼠体内雄激素水平,根据雄激素代谢变化情况,适时补充以保持与正常男性相似水平,确保模型成功。在本研究中,我们选择激素敏感型(D17225)和去势抵抗型(C40019)两种不同类型的前列腺癌PDX模型,连续测量皮下肿瘤体积,最终绘制PDX肿瘤的生长曲线,相比于C40019,雄激素依赖型D17225生长速度较快,呈现指数生长趋势(图1)。我们通过STR分析证实了它们与患者原始肿瘤组织的遗传学一致性,其同源性为99.99%(表1)。患者前列腺癌手术样本及PDX移植瘤组织石蜡切片进行HE和免疫组织化学染色,结果显示移植瘤与患者原发肿瘤组织形态基本一致(图2)。

图1 PDX肿瘤生长曲线Figure 1 Growth curve of PDX tumors
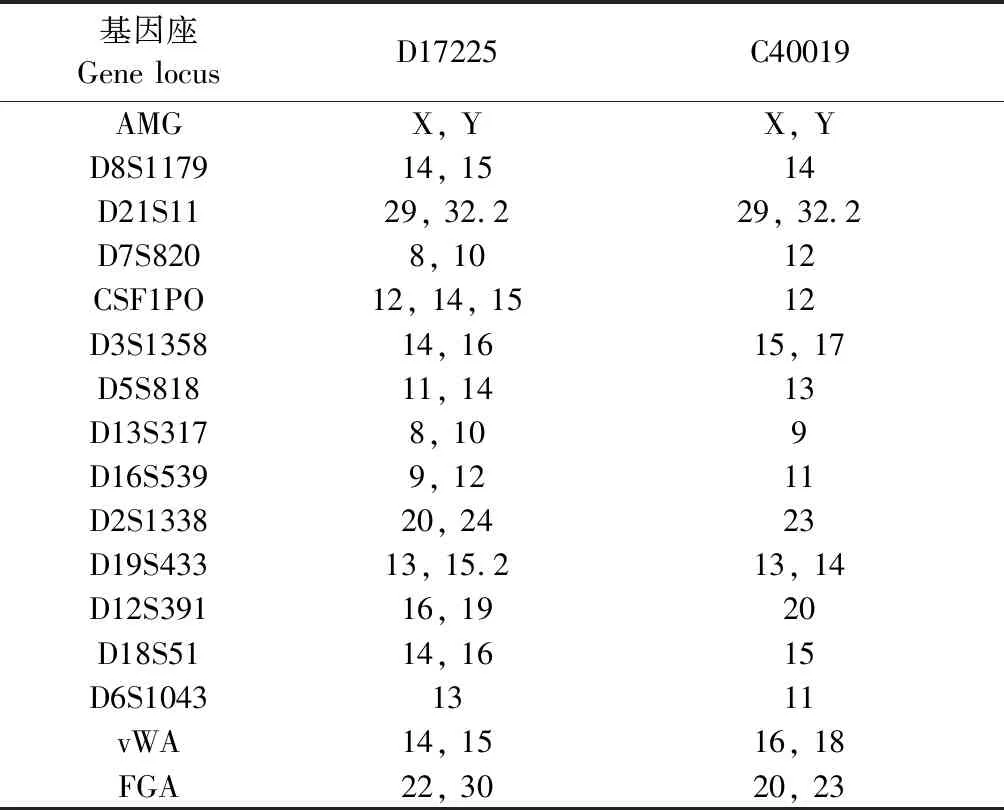
表1 PDX模型的STR检测
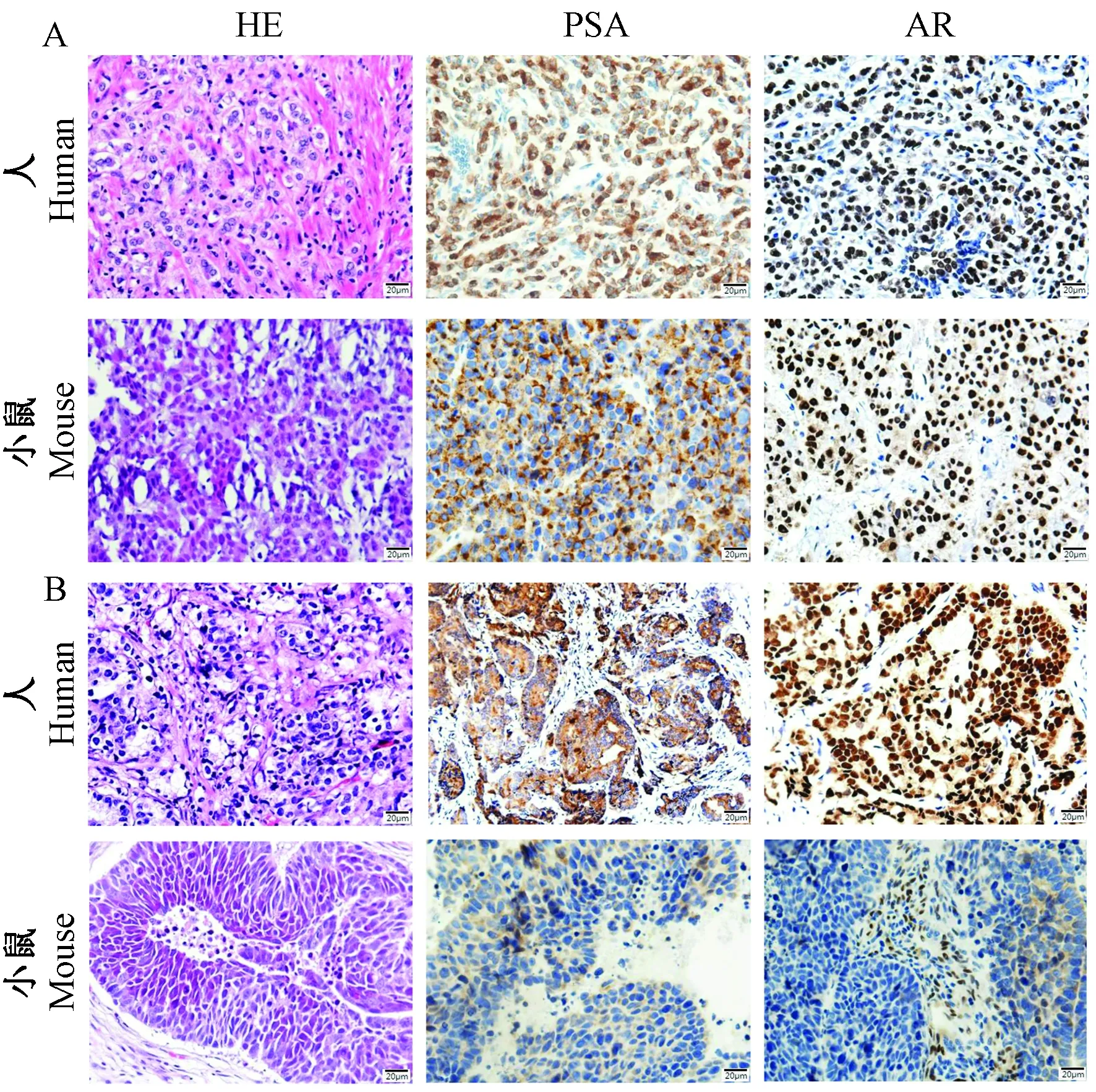
注:A:D17225;B:C40019。标尺=20 μm。图2 患者原发肿瘤与相应PDX肿瘤的组织学特征(× 40)Note. A, D17225. B, C40019. Bars=20 μm.Figure 2 Histology of the primary human tumors and matched PDX tumors
2.2 治疗效果评价
2.2.1 肿瘤体积和荷瘤鼠体重变化
治疗28 d后,通过测量肿瘤体积和荷瘤鼠体重的变化以及病理组织学评价治疗效果。如图所示,在D17225 PDX模型组,DCTX治疗及CAS+DCTX联合治疗均显著抑制了肿瘤生长(P=0.0104,P=0.0045),且联合治疗组抑瘤效果更为明显(P=0.0045);而在C40019 PDX模型组,DCTX治疗后,肿瘤体积虽有所下降,但与对照组相比差异无显著性(P=0.1897),且小鼠体重明显下降(图3)。在这两例PDX模型中,CAS+DCTX和DCTX治疗均导致荷瘤小鼠体重下降,能是由于化疗药物毒副作用及肿瘤恶病质所致。在这期间,监测荷瘤鼠体重变化情况,当体重下降20%时停止药物治疗。
2.2.2 抑瘤率
治疗结束时,计算每组治疗方案的抑瘤率(inhibitory rate,IR),IR=(对照组平均体积一治疗组平均体积)/对照组平均体积×100%(见表2)。激素敏感型D17225肿瘤各组抑瘤效果明显,而去势抵抗型C40019肿瘤恶性程度较高,DCTX治疗组抑瘤率不足50%。
2.2.3 组织形态学
取各组肿瘤组织进行HE及免疫组化染色(图4)。D17225模型中,对照组肿瘤细胞丰富且大小不一,细胞核形态多变;CAS组及DCTX组肿瘤细胞减少,恶性程度有所下降;CAS+DCTX组肿瘤细胞逐步被正常组织细胞替代,肿瘤特征已经不明显。而C40019 DCTX组治疗前后形态变化不明显。
2.2.4 血清tPSA检测结果
血清tPSA含量是前列腺癌临床诊断及治疗效果评价的重要指标之一。本实验中, D17225模型中CON组血清tPSA含量>100 ng/mL,DCTX+CAS组血清tPSA最低,平均含量为2.58 ng/mL,CAS组次之,平均含量为3.65 ng/mL,DCTX组平均含量为30.92 ng/mL(图5),而C40019模型中,所有组均未检测到血清tPSA,该结果与病理组织学评估结果保持一致。

注:A:肿瘤体积变化趋势;B:小鼠体重变化趋势。图3 治疗期间肿瘤体积及小鼠体重的变化Note. A, Variation tendency of tumor volume. B, Body weight during treatment.Figure 3 Changes of the tumor volume and body weight during treatment

表2 不同治疗方法的抑瘤率
注:与对照组(CON)比较,△P<0.01,*P>0.05;NA:无法使用。
Note. Compared with the control group (CON),△P<0.01,*P>0.05. NA: Not available.
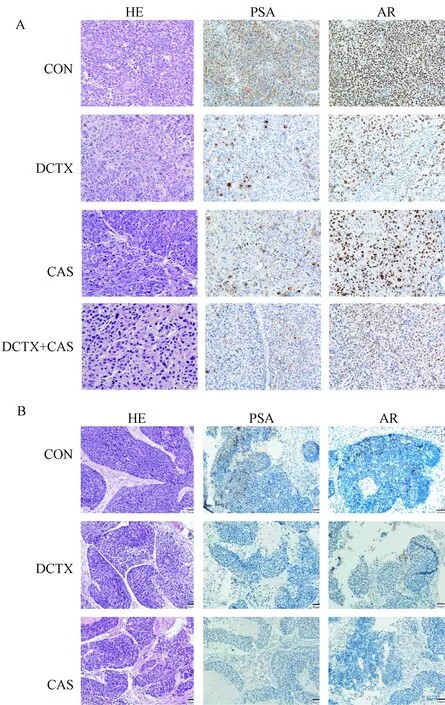
注:A:D17225治疗组;B:C40019治疗组。标尺= 50 μm。图4 各组肿瘤组织的组织学变化(HE及免疫组化染色,× 20)Note. A, D17225 group. B, C40019 group. Bars = 50 μm.Figure 4 Histological changes in the tumor tissues of the different groups. HE and immunohistochemical staining

图5 D17225各组肿瘤的血清tPSA检测结果Figure 5 Serum tPSA levels in the mice bearing D17225 tumors
3 讨论
前列腺癌PDX模型较好地重现了患者原发性肿瘤特征,使人们能够在免疫缺陷小鼠体内观察疾病进展,模拟患者对治疗方案的反应性。长期以来,研究者们多次改进模型的建立方法,提高了该种模型的建成率,从而促进了前列腺癌基础医学相关研究。目前,比较有效的方法包括:1)提高体内雄激素水平:小鼠体内雄激素(特别是睾酮)水平远低于成年男性,而一定剂量的雄激素刺激对肿瘤组织的生长至关重要,因此需要定期为宿主小鼠补充外源性雄激素,以促进人源性异种移植物的生长[3-4]; 2)选择合适的肿瘤标本移植位点:本研究前期,我们采用单纯皮下移植,模型建立率仅约15%,与其他研究结果相似。而有报道显示,肾包膜是更适合前列腺癌组织异种移植的位点,它具有丰富的血管和淋巴系统,能够在早期为肿瘤组织提供充分的营养物质,该位点的成功率甚至高达90%以上[5-7];3)确保肿瘤组织的新鲜程度:从手术室获得的患者标本应精确修剪并尽快移植入免疫缺陷小鼠体内,以减少由于组织缺血缺氧而导致组织液化、坏死等情况的发生[8]。
前列腺癌的临床分型主要包括激素依赖型和去势抵抗型[9]。因此,我们分别选择这两类病人手术标本建立相应的PDX模型,通过去势的方法证实了它们与原发瘤激素依赖状态的一致性。去势抑制了激素依赖性D17225肿瘤的生长,而对去势抵抗性C40019肿瘤无效。使用临床一线化疗药物DCTX处理两种PDX模型,结果显示,DCTX对激素依赖型D17225治疗效果明显,而激素非依赖型C40019不仅疗效不显著,还出现了宿主小鼠体重持续下降的情况,这可能是化疗药物的毒副作用和肿瘤化疗后对宿主的影响,也可能是C40019肿瘤本身是转移性去势抗性前列腺癌,该肿瘤侵犯右侧精囊腺及膀胱组织,恶性程度较高。另外,这种化疗期间宿主小鼠体重明显下降的情况,提示在临床患者的后续治疗中应引起重视,体重减轻是化疗的高危信号,肿瘤可能趋向更高的恶性程度,且预后不良,需适时调整用药剂量和治疗方案。
基于PDX模型的药效评价与临床患者的治疗反应相似,已有多项研究表明,利用PDX模型开展的个体化治疗药物筛选,可为临床医生提供最佳治疗方案的参考,从而指导临床用药,使患者受益[10-13]。然而,由于前列腺肿瘤的PDX模型成瘤率较低[14-15],且在肿瘤传代中可能缺乏肿瘤标志物,例如AR和PSA表达,因此,关于前列腺癌的个体化用药治疗鲜有报道。基于上述原因,如何提高前列腺癌PDX 模型的成功率,创建不同分型的前列腺癌PDX模型,建立前列腺癌转移模型、模拟临床雄激素依赖性到非依赖性的转化,以及腺癌到神经内分泌癌的转分化等都对于前列腺癌的转化研究具有重要意义。这些模型不仅有助于研究疾病进展和治疗抗性的机制,并且对药物及肿瘤标志物的开发和肿瘤的个体化治疗都具有重要价值。
