高脂环境下五指山小型猪和西藏小型猪冠心病相关血脂和炎症易感基因的表达
2019-06-05刘志华潘永明徐孝平徐剑钦杨钦钦蔡兆伟陈民利
郁 晨,刘志华,潘永明,徐孝平,徐剑钦,杨钦钦,蔡兆伟,陈民利
(浙江中医药大学动物实验研究中心/比较医学研究所,杭州 310053)
冠心病(coronary artery disease, CAD)是一类严重的心血管系统疾病,发病率和死亡率高居心血管疾病之首。其主要的病理基础是动脉粥样硬化(atherosclerosis, AS),AS为多因素影响的复杂病变过程,是遗传因素和环境因素相互作用的结果[1]。大量证据表明血脂异常与炎症反应在AS的发生过程中起重要作用[2-3],因此CAD血脂和炎症相关的易感基因的发现和探讨成为近年研究的重点。
猪在心血管系统、脂蛋白代谢及消化系统与人类极为相似,其AS病变部位与人类AS病变的分布特点也相一致,并具有人类成熟斑块的特点,是研究心血管疾病的一个重要模型动物。我国小型猪的品种丰富,且长期以来,由于各个猪种遗传背景、生长环境以及所接受的饲养、选育方式等的不同,形成了特有的种质特性。本课题组前期研究发现,五指山小型猪与西藏小型猪对高脂饲喂后的血脂代谢和炎症反应存在不同的敏感性[4-5],但都易形成AS和发生CAD[6-8]。故脂质和炎症是诱发AS的关键因素,随着近年来基因筛查和治疗技术研究的不断发展,外周血相关标记物的研究对疾病的筛查、预防和治疗具有重要的指导意义。本研究对高脂环境下五指山小型猪和西藏小型猪的血脂和炎症细胞变化进行观察,并比较分析外周血白细胞中CAD相关血脂和炎症易感基因的表达差异,以期能筛选出这两种小型猪CAD易感基因,为五指山小型猪和西藏小型猪在代谢性心血管病中的应用提供参考。
1 材料和方法
1.1 实验动物
普通级雄性五指山小型猪、西藏小型猪各5只,4月龄,体重10~15 kg,其中,西藏小型猪购自南方医科大学实验动物中心[SCXK (粤) 2011-0015],五指山小型猪购自海南省农业科学院畜牧兽医研究所提供[SCXK (琼) 2014-0006],均饲养于浙江中医药大学动物实验研究中心普通级小型猪实验室[SYXK (浙) 2013-0184],环境温度为(22 ±1)℃,相对湿度为45%~65%,一日二次饲喂,自由饮水,12 h/12 h明暗交替。本实验所有饲养、操作和护理均按照“实验动物饲养管理和使用指南”进行,实验过程中按实验动物使用的3R原则给予人道的关怀,并经浙江中医药大学实验动物福利伦理委员会批准(ZSLL-2016-0031)。
1.2 主要试剂与仪器
全自动生化分析仪(7020,日立公司,日本),分类血自动血液分析仪(2120型,拜耳公司,美国),PCR仪(PTC-200, Bio-Rad公司,美国),实时荧光定量PCR仪(iQ5, BIO-Rad公司,美国),垂直电泳仪(SE260, GE公司,美国),红外荧光扫描系统(Odyssey,LI-COR公司,美国)。Total RNA提取试剂盒(RNAiso Plus)、逆转录试剂盒(PrimeScript RT reagent Kit)及荧光定量试剂盒(SYBR Premix Ex TaqTM Ⅱ)购自大连TAKARA公司;RIPA裂解液、BCA蛋白浓度测定试剂盒购自碧云天生物技术研究所;低密度脂蛋白受体(LDLR)、前蛋白转化酶枯草溶菌素9(PCSK9)、5脂氧合酶(5-LO)、5脂氧合酶激活蛋白(FLAP)、基质金属蛋白酶9(MMP-9)等抗体均购自Santa Cruz公司;总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(LDL-C)购自上海申能德赛诊断技术有限公司;五分类血常规试剂包购自拜耳公司;C反应蛋白(CRP)和肿瘤坏死因子-α(TNF-α)ELIAS测试盒购自南京建成生物工程研究所。
1.3 实验方法
取五指山小型猪、西藏小型猪各5只,饲喂高脂饲料(配方:10%蛋黄粉、15%起酥油、1.5%胆固醇、73.5%基础饲料),每日饲料量为体重的2.5%,分成等量的2次饲喂,每2周称量体重后调整饲料量,连续饲喂6个月[5]。每月检测血脂和血常规指标,并取饲喂前和饲喂6月后的静脉血,一份取1 mL全血分离血清,采用ELISA法检测CRP、TNF-α水平;另一份取8 mL全血分离白细胞,检测LDLR、LPL、PCSK9、ApoAV、5-LO、FLAP、MMP-9、ICAM-1、VCAM-1的mRNA和蛋白表达。并在饲喂6个月后将小型猪处死,剖腹取腹主动脉组织,进行HE染色,观察病理形态学变化。
1.3.1 血脂和血常规指标测定
取高脂饲喂前和饲喂后每月一次检测,检测前禁食8 h后,从小型猪前腔静脉取血4 mL,3000 r/min离心10 min,分离血清,在7020全自动生化分析仪测定TC、TG、LDL-C、HDL-C水平,同时,取1 mL血置于EDTA-K3抗凝管中,测定血常规指标,观察白细胞(WBC)、中性粒细胞(NEUT)和单核细胞(MONO)的变化,具体操作按试剂盒说明书进行。
1.3.2 腹主动脉HE染色
将固定后的腹主动脉组织,经脱水、透明、浸蜡、包埋后制成4 μm厚的切片,行HE染色,光镜下观察组织病变情况,并拍照记录。
1.3.3 Real-time PCR法检测外周血白细胞中血脂和炎症相关mRNA的表达
分别取造模前和高脂饲喂6个月后的静脉血8 mL,无菌条件下分离白细胞,用裂解液处理后放置-70℃保存,备用。采用TRIzol法提取白细胞中总RNA,并按反转录试剂盒的操作步骤反转录为cDNA。选取GAPDH为内参基因,以Primer 5.0软件设计猪相关基因的引物(见表1)。根据荧光定量试剂盒说明书进行Real-time PCR反应,根据Ct值,通过2-△△Ct法计算各个基因的相对表达量。
1.3.4 Western blot法检测外周血白细胞中血脂和炎症相关蛋白的表达
在白细胞样本中加入RIPA裂解液,冰上裂解30 min得到蛋白样品,用BCA蛋白浓度试剂盒检测总蛋白浓度,于100℃加热5 min使蛋白变性。取等量样品于5%SDS-PAGE胶中电泳(80 V,40 min;120 V,2 h)后,通过转膜仪将蛋白转至PVDF膜上,用5%脱脂牛奶于37℃封闭2 h。按说明书比例加入一抗,4℃过夜。洗膜后加入二抗,室温孵育1 h,用TBST洗涤。结果用 Odyssey 红外荧光扫描仪检测,计算各条带的灰度值,以GAPDH作为内参计算各蛋白的表达量。
1.4 统计学方法
2 结果
2.1 血清脂质代谢的变化
与高脂饲喂前比较,高脂饲喂后五指山小型猪和西藏小型猪的血清TC、HDL-C、LDL-C水平均显著升高(P<0.01),其中,高脂饲喂1个月时TC、LDL-C水平达到高峰,2个月时略有回落,3个月时回升并保持在高水平状态;高脂饲喂1个月后HDL-C水平一直稳定在高水平状态;五指山小型猪的TG亦有上升趋势,但差异不明显(P>0.05),但西藏小型猪的TG水平与饲喂前相当。另外,高脂饲喂前五指山小型猪和西藏小型猪的TC、LDL-C水平相当,而在高脂饲喂1~6个月期间五指山小型猪的TC、LDL-C水平均高于西藏小型猪,但差异不显著(P>0.05),同时五指山小型猪的TG水平在高脂饲喂前后均高于西藏小型猪,并在高脂饲喂后1个月和3~6个月期间五指山小型猪的血清TG显著高于西藏小型猪(P<0.05,P<0.01)(图1)。

表1 实时荧光定量PCR引物序列
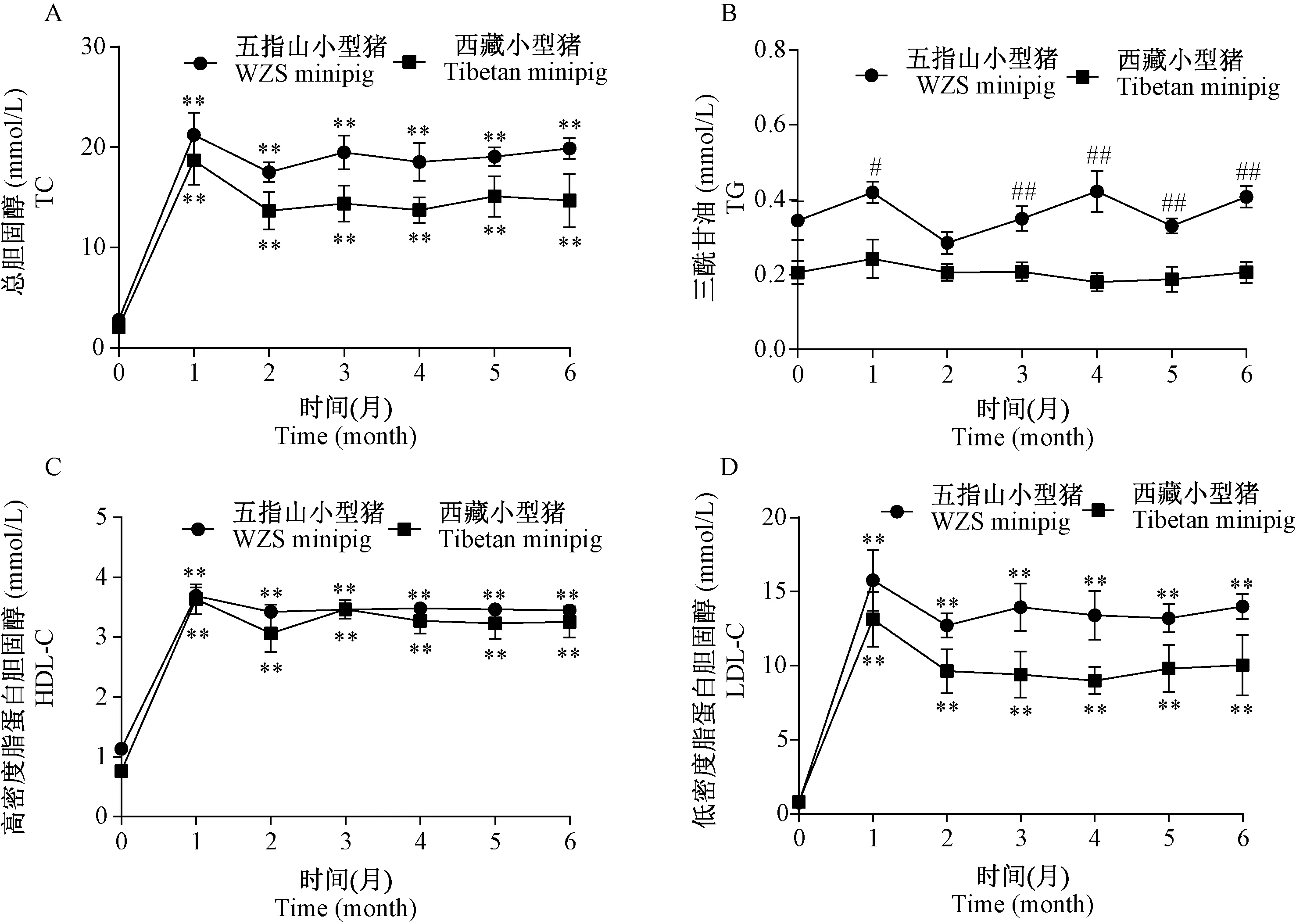
注:A~D:分别为各组TC、TG、HDL-C和LDL-C水平的变化。与高脂饲喂前(0个月)比较,*P<0.05,**P<0.01;与西藏小型猪比较,#P<0.05,##P<0.01。图1 高脂饲喂后五指山小型猪和西藏小型猪的血脂代谢的变化Note. A-D, The changes of TC, TG, HDL-C, and LDL-C levels in each group, respectively. Compared with 0 month,*P<0.05,**P<0.01. Compared with the Tibetan minipig,#P<0.05,##P<0.01.Figure 1 Changes in serum lipid metabolism in the WZS minipigs and Tibetan minipigs after high-fat diet feeding
2.2 白细胞数目、中性粒细胞和单核细胞的变化
与高脂饲喂前比较,西藏小型猪在高脂饲喂后白细胞(WBC)数目、中性细胞比率(NEUT%)、单核细胞比率(MONO%)均有不同程度的升高,其中,高脂饲喂2个月时WBC数目升高显著并达到高峰,3个月时略有回落但仍保持在较高状态;五指山小型猪WBC数目和NEUT%无明显变化(P>0.05),而MONO%在高脂饲喂后有不同程度升高,其中,在高脂饲喂后2、4、5、6个月时呈显著性差异(P<0.05,P<0.01)。另外,高脂饲喂前西藏小型猪的WBC数目与五指山小型猪相当,而在高脂饲喂后西藏小型猪的WBC数目持续高于五指山小型猪,且在高脂饲喂后2、3、5、6个月时呈显著性差异(P<0.05);同时西藏小型猪的NEUT%和MONO%在高脂饲喂前后均高于五指山小型猪,其中,NEUT%在高脂饲喂后1~6个月时均呈显著性差异(P<0.05,P<0.01),MONO%在高脂饲喂后3、6个月时呈显著性差异(P<0.05)(图2)。
2.3 血清CRP、TNF-α水平比较
与高脂饲喂前比较,西藏小型猪在高脂饲喂6个月后血清CRP和TNF-α水平均显著升高(P<0.05);但五指山小型猪血清CRP和TNF-α虽有上升趋势但无显著性差异(P>0.05)(图3)。
2.4 腹主动脉病理形态学观察
HE染色结果显示,西藏小型猪和五指山小型猪腹主动脉血管组织均出现内皮增厚、不平整,平滑肌排列紊乱,并伴有炎性细胞浸润,大量脂质、泡沫细胞沉积等,已形成明显的AS斑块(图4)。

注:A:白细胞数目;B:中性粒细胞百分比;C:单核细胞百分比;与高脂饲喂前(0个月)比较,*P<0.05,**P<0.01;与五指山小型猪比较,#P<0.05,##P<0.01。图2 高脂饲喂后五指山小型猪和西藏小型猪的白细胞数目、中性粒细胞和单核细胞的变化Note. A, Number of white blood cells. B, Percentage of neutrophils. C, Percentage of monocytes. Compared with 0 month,*P<0.05,**P<0.01. Compared with the WZS minipig,#P<0.05,##P<0.01.Figure 2 Changes in WBC, NEUT%, and MONO% of the WZS minipigs and Tibetan minipigs after high-fat diet feeding

注:A:C反应蛋白水平(CRP);B:肿瘤坏死因子-α水平(TNF-α);与高脂饲喂前(0个月)比较,*P<0.05,**P<0.01。图3 高脂饲喂后五指山小型猪和西藏小型猪的血清CRP和TNF-α的变化Note. A, C-reactive protein level. B, TNF-α level. Compared with 0 month,*P<0.05,**P<0.01.Figure 3 Changes in CRP and TNF-α levels of the WZS minipigs and Tibetan minipigs after high-fat diet feeding
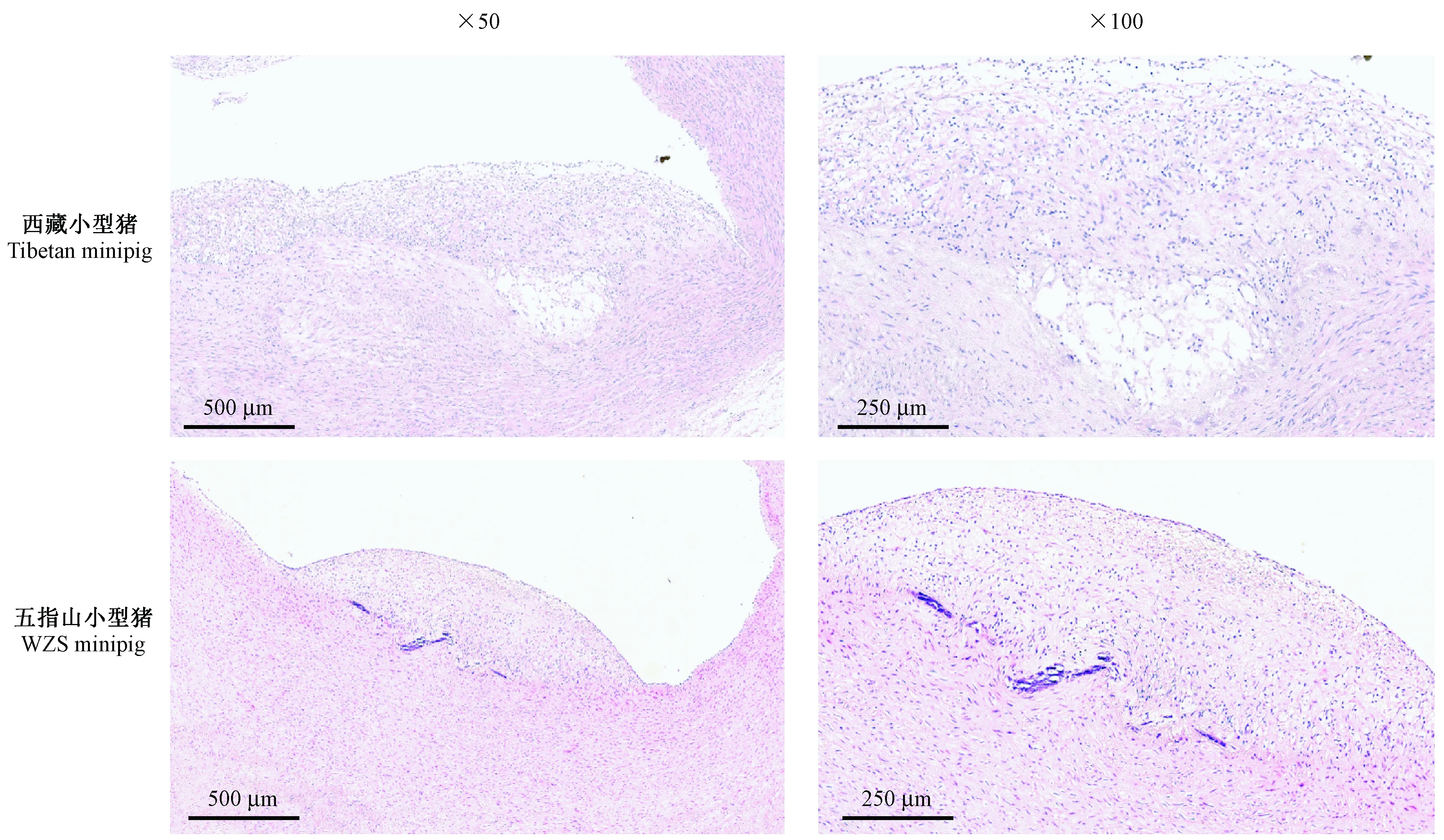
图4 高脂诱导后两种小型猪主动脉病理形态学变化Figure 4 Pathological changes of the thoracic aorta in the two miniature pigs after high-fat induction
2.5 外周血白细胞中AS相关血脂易感基因的基因和蛋白表达
2.5.1 外周血白细胞中AS相关血脂易感基因的基因和蛋白表达
与高脂饲喂前比较,五指山小型高脂饲喂6个月后外周血白细胞中LDLR、ApoAV mRNA表达显著降低(P<0.05,P<0.01),而PCSK9、LPL mRNA表达显著上调(P<0.01,P<0.05);西藏小型猪高脂饲喂6个月后外周血白细胞中LPL mRNA表达显著上调(P<0.01),而LDLR、PCSK9、ApoAV mRNA表达无明显变化(P>0.05)(图5);从图5亦可看出,高脂饲喂6个月后,五指山小型猪外周血白细胞中PCSK9 mRNA表达上调和西藏小型猪外周血白细胞中LPL mRNA的表达上调尤为突出。
2.5.2 外周血白细胞中AS相关血脂易感基因的蛋白表达
与高脂饲喂前比较,五指山小型高脂饲喂6个月后外周血白细胞中LDLR、ApoAV蛋白表达均显著下降(P<0.05,P<0.01),但PCSK9、LPL蛋白表达均无明显差异(P>0.05);西藏小型猪外周血白细胞中LPL蛋白表达显著上升(P<0.01),但LDLR、PCSK9、ApoAV蛋白表达均无明显差异(P>0.05)(图6)。
2.6 外周血白细胞中AS相关炎症易感基因的基因和蛋白表达
2.6.1 外周血白细胞中AS相关炎症易感基因的mRNA表达
与高脂饲喂前比较,五指山小型猪高脂饲喂6个月后外周血白细胞中5-LO、FLAP、ICAM-1、VCAM-1 mRNA表达均显著升高(P<0.05,P<0.01),MMP-9的表达有上升趋势(P>0.05);西藏小型猪外周血白细胞中5-LO、FLAP、MMP-9、ICAM-1、VCAM-1 mRNA表达均显著上调(P<0.01)。另外,高脂饲喂6个月后,西藏小型猪外周血白细胞中FLAP、MMP-9、ICAM-1、VCAM-1 mRNA表达上调幅度均大于五指山小型猪,而5-LOmRNA表达则五指山小型猪高于西藏小型猪(图7)。
2.6.2 外周血白细胞中AS相关炎症易感基因的蛋白表达
与高脂饲喂前比较,五指山小型猪和西藏小型猪外周血白细胞中5-LO、FLAP、MMP-9、ICAM-1、VCAM-1蛋白表达均有不同程度的上升,其中,西藏小型猪外周血白细胞中FLAP、MMP-9、ICAM-1、VCAM-1蛋白表达均显著升高(P<0.05,P<0.01);而五指山小型猪外周血白细胞中5-LO蛋白表达存在显著性差异(P<0.05)(图8)。
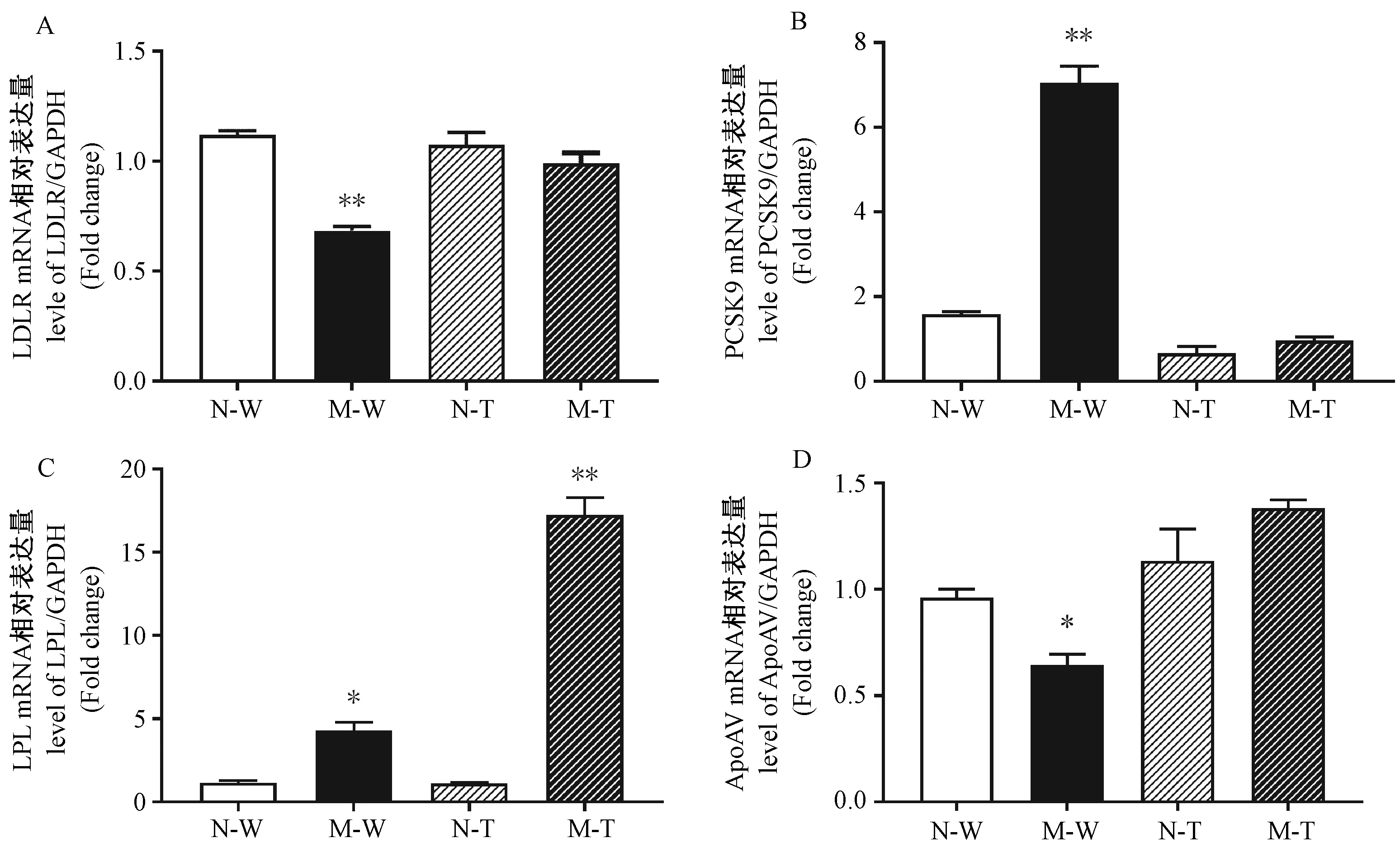
注:A~D:分别为各组LDLR、PCSK9、LPL和ApoAV mRNA 表达。N和M分别表示高脂饲喂前和饲喂6个月;W、T分别表示五指山小型猪、西藏小型猪;下图同。与高脂饲喂前比较,*P<0.05,**P<0.01。图5 高脂饲喂后五指山和西藏小型猪外周血白细胞中LDLR、PSCK9、LPL、ApoAV mRNA表达变化Note. A-D, The mRNA expression levels of LDLR, PCSK9, LPL, and ApoAV in each group, respectively. N and M indicate before and 6 months after high-fat diet feeding, respectively; W and T respectively represent WZS minipigs and Tibetan minipigs; the same in the following figures. Compared with that before high-fat diet feeding,*P<0.05,**P<0.01.Figure 5 Changes in the expressions of LDLR, PSCK9, LPL, and ApoAV mRNA in the peripheral blood leukocytes of the WZS and Tibetan minipigs after high-fat diet feeding
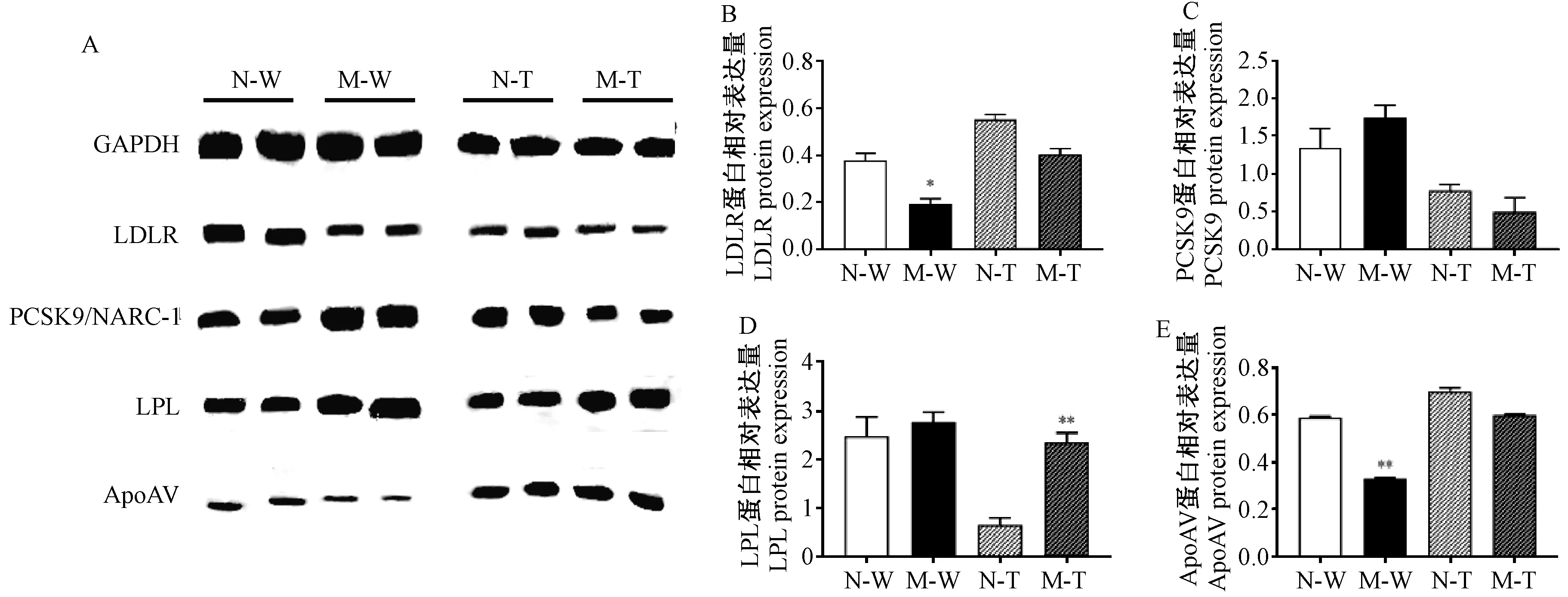
注:A:蛋白表达代表图;B~E:分别为各组LDLR、PCSK9、LPL、ApoAV蛋白相对表达量。与高脂饲喂前比较,*P<0.05,**P<0.01。图6 高脂饲喂后五指山和西藏小型猪外周血白细胞中LDLR、PSCK9、LPL、ApoAV 蛋白表达变化Note. A, A representative presentation of protein expression. B-E, The relative expression levels of LDLR, PCSK9, LPL, and ApoAV protein, respectively. Compared with that before high-fat diet feeding, *P<0.05,**P<0.01.Figure 6 Changes in the expressions of LDLR, PSCK9, LPL, and ApoAV protein in the peripheral blood leukocytes of the WZS and Tibetan minipigs after high-fat diet feeding

注: A~ E:分别为各组5-LO、FLAP、MMP-9、ICAM-1和VCAM-1 mRNA表达。与高脂饲喂前比较,*P<0.05,**P<0.01。图7 高脂饲喂后五指山和西藏小型猪外周血白细胞中5-LO、FLAP、MMP-9、ICAM-1、VCAM-1 mRNA表达变化Note. A-E, The mRNA expression levels of 5-LO, FLAP, MMP-9, ICAM-1, and VCAM-1 in each group, respectively. Compared with that before high-fat diet feeding,*P<0.05,**P<0.01.Figure 7 Changes in the expressions of 5-LO, FLAP, MMP-9, ICAM-1, and VCAM-1 mRNA in the peripheral 1blood leukocytes of WZS and Tibetan minipigs after high-fat diet feeding

注:图A为蛋白表达代表图,图B-F分别为各组5-LO、FLAP、MMP-9、ICAM-1、VCAM-1蛋白相对表达量;与高脂饲喂前比较,*P<0.05,**P<0.01。图8 五指山和西藏小型猪外周血白细胞中5-LO、FLAP、MMP-9、ICAM-1、VCAM-1蛋白表达Note. A, A representative presentation of protein expression. B-F, The relative expression levels of 5-LO, FLAP, MMP-9, ICAM-1, and VCAM-1 protein, respectively. Compared with that before high-fat diet feeding,*P<0.05,**P<0.01.Figure 8 Changes in the expressions of 5-LO, FLAP, MMP-9, ICAM-1, and VCAM-1 protein in the peripheral blood leukocytes of WZS and Tibetan minipigs after high-fat diet feeding
3 讨论
CAD由冠状动脉狭窄或闭塞引起,而脂质沉积是引起冠状动脉狭窄的首要原因,尤其血中LDL-C过量是导致脂质在血管壁沉积的危险因素。一旦血脂代谢异常,则会导致血中LDL-C升高,血中过量的LDL-C会滞留于损伤的血管内皮下,并被氧化形成氧化型低密度脂蛋白(ox-LDL),进而导致泡沫细胞的产生,促进AS发生[9]。本研究结果显示,高脂饲喂后五指山小型猪和西藏小型猪的血清TC、HDL-C、LDL-C均显著且成倍上升,持续稳定在高水平状态,表明高脂饮食的环境下五指山小型猪和西藏小型猪均发生血脂异常,且五指山小型猪的TC、LDL-C水平高于西藏小型猪,这与前期对单次静脉注射脂肪乳和单次饲喂高脂饲喂的敏感性研究基本一致[4],也进一步证实了五指山小型猪对高脂饮食易感且脂质代谢的清除率相对较慢。另外,五指山小型猪在高脂饲喂后TG水平略有升高,而西藏小型猪则基本保持不变,该结果可能与小型猪的品系、饲料成分和造模时间有关,因为高脂饮食早期TG主要在肝中沉积,导致外周血中TG升高不明显,其具体原因有待进一步探讨。尽管血脂异常所导致的脂质在血管壁沉积是AS形成的基础,同样也有大量研究提出单纯的血脂异常并不会引起CAD,往往伴着不同程度的炎症反应,AS的形成是一个慢性的病理过程,但血脂异常诱发且加剧炎症反应,进而诱发CAD[10]。血中过量的LDL-C聚集于血管内皮下,并向CAD发展是以炎症因子、单核/巨噬细胞为基础的炎症反应过程[11-12]。本研究结果显示,高脂饲喂后五指山小型猪和西藏小型猪的MONO%均出现上升,表明在高脂环境下诱发了两种小型猪的单核细胞聚集和活化,出现了慢性的低度炎症。高脂诱导后西藏小型猪同时出现WBC和NEUT%上升,相反五指山小型猪则未见明显变化,且西藏小型猪的WBC和NEUT%、MONO%均明显高于五指山小型猪,另外高脂饲喂后西藏小型猪血清CRP和TNF-α水平均显著升高,而五指山小型猪上升幅度较西藏小型猪降低,说明西藏小型猪的炎症程度相对较高,这可解释西藏小型猪的血脂水平虽不如五指山小型猪高,但仍易引发AS的形成[6-8];同时本研究HE染色也显示西藏小型猪和五指山小型猪均出现严重AS病变,说明高脂环境、氧化应激和慢性炎症是引起AS斑块形成的主要原因。
CAD的主要病理基础是AS,AS的发生与发展是多因素、多步骤的,是遗传因素和环境因素共同作用的结果,不同个体在相同环境下,冠心病的易感性存在差异。本研究在相同的高脂饲喂环境下,观察五指山小型猪和西藏小型猪 CAD相关血脂和炎症易感基因的表达,结果发现,五指山小型猪高脂饲喂6个月后外周血白细胞中LDLR、ApoAV 表达显著降低,而PCSK9、LPL 表达显著上调;西藏小型猪高脂饲喂6个月后LPL 表达显著上调,而LDLR、PCSK9、ApoAV表达无明显变化,结果也显示,五指山小型猪高脂饲喂后PCSK9表达升高和LDLR表达降低的幅度较大,而西藏小型猪LPL表达上升的幅度较大,由此说明,高脂环境下对五指山小型猪外周血PCSK9和LDLR基因表达较为敏感,而对西藏小型猪则以LPL基因表达较为敏感。另外,LDLR缺陷或缺失,不仅可导致LDLR数目降低或蛋白结构改变,影响与LDL-C的结合,而且阻止LDL-C进入细胞,导致血中胆固醇升高,使胆固醇在外周组织聚集,促进AS的发生[13]。而PCSK9表达升高后从细胞分泌出,降解其它细胞表面的LDLR,影响LDL-C的摄取,从而增加血浆LDL-C水平[14]。本研究结果提示,在相同的高脂环境下两种小型猪TC、LDL-C水平的差异可能与外周血白细胞PCSK9和LDLR基因表达的差异有关。
本研究结果同时发现,在相同的高脂环境下,五指山小型猪和西藏小型猪外周血白细胞中5-LO、FLAP、MMP-9、ICAM-1、VCAM-1表达均出现上调,但西藏小型猪FLAP、MMP-9、ICAM-1、VCAM-1的基因表达和MMP-9、ICAM-1、VCAM-1的蛋白表达上调幅度大于五指山小型猪,而五指山小型猪5-LO的基因表达和5-LO、FLAP的蛋白表达则高于西藏小型猪。由此说明,高脂环境下对西藏小型猪MMP-9、ICAM-1、VCAM-1基因表达较为敏感,而对五指山小型猪是5-LO基因表达较为敏感。LO -LTs炎症通路在AS中的扮演重要角色[15]。5-LO是催化花生四烯酸(arachidonic acid, AA)生成白三烯(leukotrienes, LTs)的关键酶。合成的白三烯与其特异性受体结合,激活白细胞和粘着在血管内皮细胞层的单核细胞,增加血管通透性,促进血栓形成,参与AS的发生[16]。MMP-9与斑块的稳定性密切相关,在各种炎症因子刺激下,斑块局部巨噬、泡沫细胞大量合成分泌MMP-9,分解斑块内多种胶原和明胶,引起纤维帽变薄甚至破裂,导致心血管事件的发生,且外周血MMP-9升高是AS斑块不稳定的重要标志[17]。ICAM-1和VCAM-1属于免疫球蛋白超家族成员,介导白细胞向血管内皮的迁移和粘附,是早期AS病变发生的关键因素。血清ICAM-1、VCAM-1水平增高与AS进展有关,目前已被作为检测冠心病患者内皮功能障碍的生物标志物[18]。本研究结果提示,在相同的高脂环境下西藏小型猪的炎症程度高于五指山小型猪的主要原因与这些炎症易感基因的表达差异有关。
综上所述,在相同的高脂环境下五指山小型猪、西藏小型猪均出现不同程度的血脂异常和炎症反应,五指山小型猪血脂高于西藏小型猪,而西藏小型猪炎症程度高于五指山小型猪,这些表症与这两种小型猪 CAD相关血脂和炎症易感基因的表达差异有关,其敏感性存在异质性,其中五指山小型猪外周血白细胞对LDLR、PCSK9、5-LO表达较为敏感,提示五指山小型猪的AS形成可能与血脂紊乱和慢性低度炎症有关;相反,西藏小型猪外周血白细胞对LPL、MMP-9、ICAM-1及VCAM-1表达较为敏感,提示西藏小型猪AS发生进程中,血脂紊乱虽作为起始因子,但严重的炎症反应参与并贯穿于发生始末,可能是导致AS病变严重的重要原因之一。本研究为这两种小型猪在代谢性心血管疾病中的选择应用提供实验依据。
