夏桑菊颗粒体外抗Ⅰ型登革热病毒的作用*
2019-06-04张磊姚江雄纪洵敏余婷婷蒲俏虹唐芮许瑛赖文辉彭拓华张吉凯
张磊, 姚江雄, 纪洵敏, 余婷婷, 蒲俏虹, 唐芮, 许瑛, 赖文辉, 彭拓华△, 张吉凯
1广东省生物制品与药物研究所耐药监测室(广东广州 510440); 2广州白云山星群(药业)股份有限公司(广东广州 510288)
登革病毒(dengue virus,DENV)是单股正链RNA病毒,有脂质包膜包裹,隶属于黄病毒科[1],该病毒主要引起登革热,是一种急性发热性疾病,登革热病毒主要包括4种血清型:Ⅰ型登革热病毒(DENV-1)、Ⅱ型登革热病毒(DENV-2)、Ⅲ型登革热病毒(DENV-3)和Ⅳ型登革热病毒(DENV-4)。近几年,登革热发展趋势迅猛,发病病例逐年增加,已成为全球性的公共卫生事件,该疾病主要在热带、亚热带地区流行[2],在我国,则主要在华南地区流行,以DENV-1为主。目前对登革热的治疗主要分为抗病毒治疗,对症治疗和中医辨证治疗[3]。夏桑菊源自于清代吴鞠通《温病条辨》的经典名方“桑菊饮”,收载于《卫生部药品标准》中药成方制剂第十五册,夏桑菊主要由夏枯草、桑叶、野菊花3味药材经加工而制成,具有清肝明目、疏风散热,除湿痹以及解疮毒之功效,常用于风热感冒、目赤头痛和咽喉肿痛等症的治疗[4]。目前,夏桑菊颗粒对DENV-1的作用效果研究还未见于公开发表的文献,2017年10月至2018年6月,本研究以前期基础研究工作为基础,以期为登革热疾病的抗病毒治疗提供基础研究数据,丰富临床治疗手段。
1 材料与方法
1.1 材料
1.1.1 药物 白云山牌夏桑菊颗粒剂(批号:MA0180,广州白云山星群药业),用PBS配制1 g/mL夏桑菊颗粒溶液,0.22 μm微孔滤膜过滤除菌;阳性对照药物利巴韦林注射液(批号:1409254,杭州民生药业,100 mg/mL)。
1.1.2 细胞与病毒 C6/36白纹伊蚊细胞(简称C6/36细胞)与DENV-1均由广东省疾病预防控制中心提供。
1.1.3 仪器与试剂 LightCycler 480实时荧光定量PCR(罗氏,美国),奥林巴斯荧光倒置显微镜IX73(奥林巴斯,日本)、酶标仪(BioTek,美国)、LHS-150SC恒温培养箱(上海一恒科技有限公司)、二级生物安全柜(Thermo Fisher Scientific,美国)等;DMEM(Gibco,美国Life Technologies),胎牛血清 (四季青,浙江天航生物有限公司),MTT(Sigma,美国),DMSO(天津市富宇精细化工有限公司),山羊抗小鼠IgG H&L(Alexa Fluor® 594)(Abcam,ab150116),Anti-Dengue Virus NS1 glycoprotein抗体[DN1](Abcam,ab41490),DENV-1核酸检测试剂盒(澳东,批号:40086),病毒RNA提取试剂盒(QIAamp Viral RNA Mini Kit,QIAGEN,批号:154032285)。
1.2 方法
1.2.1 药物细胞毒性测定 将C6/36细胞以1×106·mL-1接种至96孔板,100 μL/孔,37℃,5%CO2培养过夜,将药物按照倍比稀释自1∶8稀释至1∶2 048,夏桑菊颗粒对应的浓度分别为125.00、62.50、31.25、15.63、7.81、3.91、1.95、0.98、0.49 mg/mL,利巴韦林对应的浓度分别为12.50、6.25、3.13、1.56、0.78、0.39、0.20、0.10、0.05 mg/mL。每孔加100 μL药物和100 μL细胞维持液(以下简称MM,DMEM+2%FBS),设3个复孔,同时设立空白对照孔。37℃、5%CO2培养96 h,按照MTT操作说明,测定OD值,试验重复3次,确定细胞的最大无毒剂量[5]。
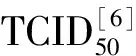
1.2.3 细胞免疫荧光法分析夏桑菊颗粒对DENV-1抑制率的影响 将不同浓度的夏桑菊颗粒与病毒36℃的预处理1 h后,加入到细胞浓度为1×106·mL-1的C6/36细胞中,每个浓度设3个复孔,同时设空白对照组和对照组,置于37℃、5%的CO2孵箱中,孵育1.5 h,弃上清后继续加入不含药物的MM,再孵育96 h;出去培养基,PBS洗1次;4%多聚甲醛(溶于PBS中,pH=7.4)室温孵育细胞10 min,PBS洗3次,每次5 min;用1% BSA室温下封闭1 h;然后加入以小鼠抗DENV-1 NS1蛋白抗体为一抗(1∶2 000)[7],室温孵育2 h;PBS洗3次,每次5 min;再加入Alexa Fluor® 594标记的山羊抗小鼠IgG为二抗(稀释度为1∶10 000),常温避光孵育1 h。荧光显微镜下观察病毒NS1抗原的表达,Image Pro Plus6.0软件分析NS1抗原表达情况,计算相对感染率。相对感染率=(药物阳性细胞数/病毒阳性组细胞数)×100%。
1.2.4 荧光定量PCR分析夏桑菊颗粒对DENV-1 RNA复制的影响 细胞按照对应的处理方式处理后,连续培养96 h,取细胞和培养基上清,在-80℃冰箱和37℃水浴反复冻融3次,3 000 r/min,离心20 min,取上清,病毒RNA抽提试剂盒抽提RNA,荧光定量PCR实验参照试剂盒说明书,进行荧光定量PCR反应,检测上清液中DENV-1的拷贝数。
1.3 统计学方法 应用SPSS 17.0统计软件进行分析,数据分析采用方差分析法,多组间的两两比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 夏桑菊颗粒对C6/36细胞毒性测定 MTT结果显示,夏桑菊颗粒溶液在稀释至15.63 mg/mL(1/64)时,细胞活力为(81.0±3.5)%,而在7.81 mg/mL(1/128),细胞活力达到(93.0±7.1)%,并且随着稀释度的增大,细胞活性无显著变化,因而选取夏桑菊颗粒溶液的最大无毒剂量为7.81 mg/mL(图1)。利巴韦林注射液在6.25 mg/mL(1/16)时,细胞活力为(79.0±4.3)%,而在6.25 mg/mL(1/32)时,细胞活力达到(92±3.8)%,并且随着稀释度的增大,细胞活性均维持在92%以上,无出现显著变化,因而选取夏桑菊颗粒溶液的最大无毒剂量6.25 mg/mL(图1)。
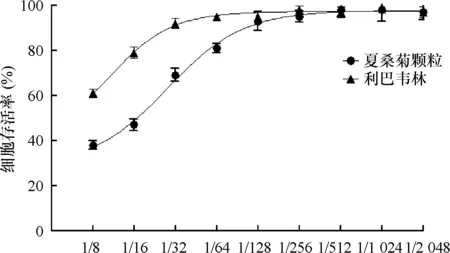
图1 夏桑菊颗粒和利巴韦林细胞毒性实验
2.2 夏桑菊颗粒对DENV-1感染细胞病变效应的影响结果 病毒阳性组的细胞存活率为(57.1±4.6)%,病毒经3.13和1.56 mg/mL阳性药物利巴韦林处理后,感染细胞,细胞存活率分别增加至(96.3±6.5)%和(81.3±7.7)%(P<0.05),细胞活力分别增加(39.2±1.9)%和(24.2±3.1)%,引起细胞的病变效应明显减弱,细胞活力明显增加(P<0.05);同时,病毒经7.81和3.91 mg/mL夏桑菊颗粒溶液处理后,感染细胞,细胞存活率分别增加至(79.0±8.9)%和(72.8±8.6)%,细胞活力分别增加(21.9±4.3)%和(15.7±4.1)%,引起细胞的病变效应明显减弱,细胞活力明显增加(P<0.05)。夏桑菊颗粒恢复细胞存活率的能力不及利巴韦林,但与病毒阳性组相比细胞的存活率明显增加,病毒引起的病变效应降低。见图2。
与病毒阳性组比较*P<0.05,**P<0.01,***P<0.001
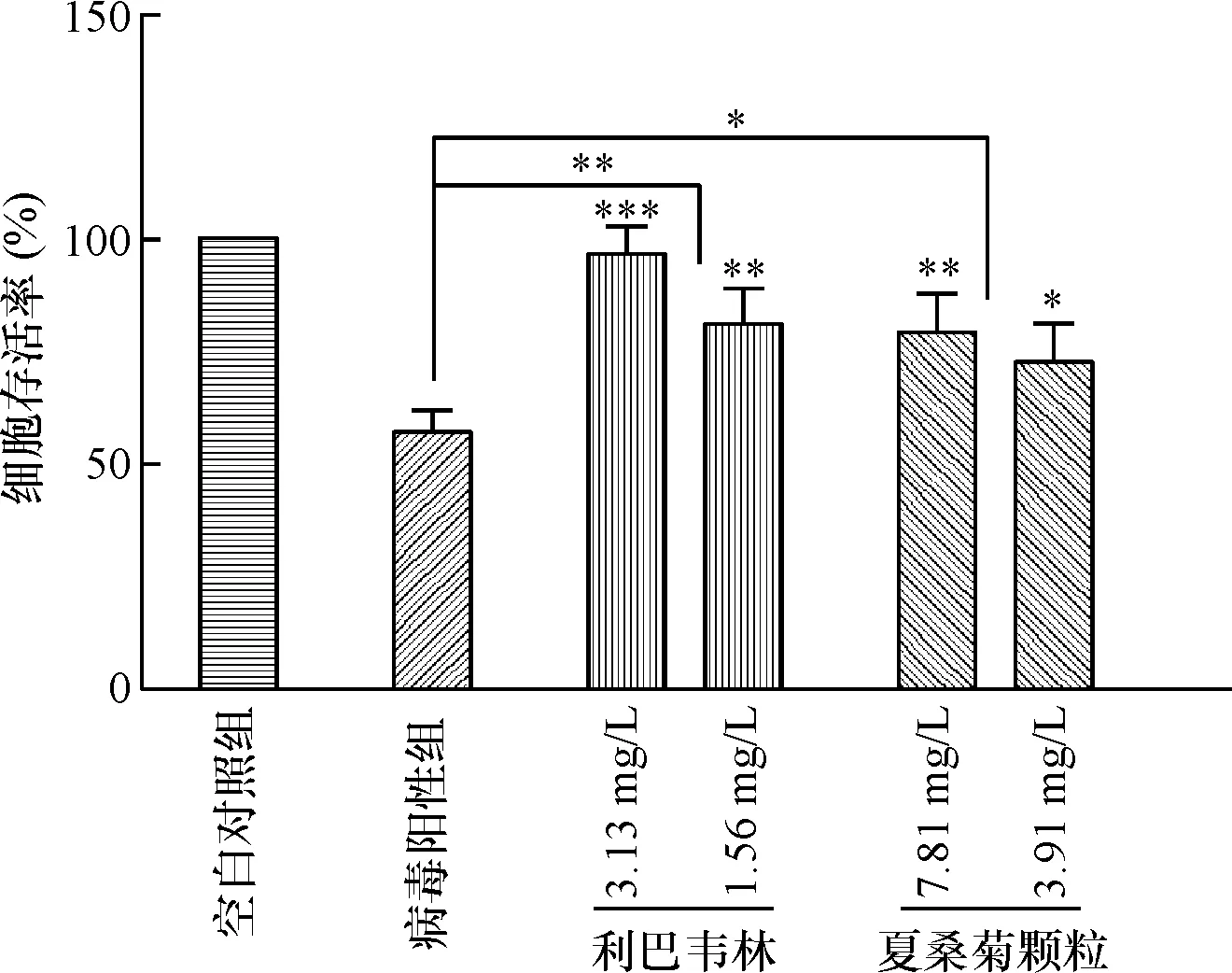
2.3 夏桑菊颗粒对DENV-1的抑制率影响(细胞免疫荧光) 红色荧光部分为DENV-1感染阳性的细胞,利巴韦林在3.13和1.56 mg/mL浓度时相对感染率分别为(48.9±2.3)%和(60.7±2.9)%,病毒相对感染率下降(51.1±2.3)%和(49.3±2.9)%;夏桑菊颗粒在7.81和3.91 mg/mL浓度时相对感染率分别为(57.9±7.4)%和(75.8±2.5)%,病毒相对感染率下降(42.1±7.4)%和(24.2±2.5)%;利巴韦林和夏桑菊颗粒对DENV-1感染细胞具有明显的抑制作用(P<0.05),这种抑制作用呈现出一定的剂量依赖性。见图3。
2.4 夏桑菊颗粒对DENV-1 RNA复制的影响 利巴韦林在3.13 mg/mL和1.56 mg/mL浓度时病毒拷贝数平均比值分别为(48.9±2.3)%,(60.7±2.9)%,抑制率达到(51.1±2.3)%和(39.3±2.9)%;夏桑菊颗粒在7.81 mg/mL和3.91 mg/mL浓度时病毒拷贝数平均比值分别为(57.9±7.4)%,(75.8±2.5)%,抑制率达到(42.1±7.4)%和(24.2±2.5)%,利巴韦林和夏桑菊颗粒对DENV-1的复制产生了明显的抑制作用(P<0.05),并且都存在明显的剂量依赖性。见图4。
3 讨论
登革热主要由登革热病毒引起,临床症状包括典型登革热,登革热出血热以及登革热休克综合征,该病已波及到全球几十亿人口,我国登革热主要流行于广东、广西、海南和台湾等地,而且以DENV-1为主[8-9]。目前,尚未有治疗登革热的特效药物,临床治疗主要以对症治疗为主,包括退热、补液和镇静止痛。
登革热病属于中医学的“瘟疫”范畴,湿热郁遏,卫气同病,治疗以清热解毒为主[10],登革热诊疗指南(2014年第2版)中推荐的清热解毒的药物包括热毒宁、清开灵等,并且相关的临床研究证明热毒宁、清开灵等在临床上治疗登革热均有明显的疗效[11-13]。
A:未转染病毒的空白细胞组;B:利巴韦林1/32稀释组;C:利巴韦林1/64稀释组;D:病毒阳性组;E:夏桑菊颗粒1/128稀释组;F:夏桑菊颗粒1/256稀释组;G:夏桑菊颗粒与利巴韦林对DENV-1感染细胞抑制率的影响;与病毒阳性组比较*P<0.05,**P<0.01,***P<0.001
图3不同的药物稀释度对病毒感染细胞的影响(n=3)

与病毒阳性组比较*P<0.05,**P<0.01,***P<0.001;比值为药物组/病毒阳性组
图4qPCR实验结果(n=3)
夏桑菊颗粒与热毒宁、清开灵等同属清热解毒药物,已被列入2018年流行性感冒诊疗方案中的推荐治疗药物[14],夏桑菊颗粒剂是由夏枯草、桑叶和野菊花三味中草药组成的复方制剂,具有清肝明目、清热解毒之功效。具有明显的抗病毒,消炎抗过敏等作用[15-16]。夏桑菊颗粒组成之一夏枯草的主要成分为黄酮类物质,其抗登革热病毒作用国外已有报道[17],但是作为复方制剂的夏桑菊颗粒的抗登革热病毒的作用国内外还未见报道。
本研究在前期采用药物与病毒同时加入、药物预保护后加入病毒、病毒感染后再加入药物以及药物与病毒预处理后感染细胞4种方式进行研究,发现只有药物与病毒预处理方式对病毒有明显的作用,因而选用这种处理方式,进一步研究发现经夏桑菊颗粒处理后病毒感染细胞的能力明显下降,同时采用细胞免疫荧光和荧光定量PCR的方法进一步分析发现在无明显细胞毒性的稀释度下,夏桑菊颗粒能够明显抑制DENV-1感染细胞的能力,DENV-1的复制能力也受到了抑制。这说明夏桑菊颗粒能够对DENV-1产生直接的作用,主要可能对病毒的感染能力和RNA复制能力产生直接的抑制,这种抑制作用与目前一些清热解毒药物的抗登革热病毒报道[12,18]的作用机制是类似的。说明夏桑菊颗粒具有抗登革热病毒的作用,但是该研究只是基于细胞层面,缺乏相应的动物实验数据以及临床试验数据,其抗登革热病毒的作用还需进一步探讨。
综上所述,夏桑菊颗粒具有明显的直接抗DENV-1的作用,夏桑菊颗粒是一种明确的中药成方制剂,是我国中医药的杰出代表,适用范围大,安全性高,进一步发掘其在治疗登革热方面的价值,对丰富登革热临床治疗手段具有重要意义,其有望成为抗登革热病毒药物家族的新成员。虽然本实验将为夏桑菊颗粒应用临床治疗登革热疾病提供了基础研究数据,但是其确切的作用机制和体内效果还需要动物实验数据和临床研究的进一步研究证实。
