磁共振在新生儿缺氧缺血性脑病中的应用
2019-06-04方汉贞陈镇城黄日华郑晓丹黄泽彬陈少贤
方汉贞, 陈镇城, 黄日华, 郑晓丹, 黄泽彬, 陈少贤
惠来县人民医院放射科(广东惠州 515200)
围生期窒息而导致的新生儿缺氧缺血性脑病(hypoxia ischemic encephalopathy,HIE)是世界范围内新生儿死亡或致残的主要原因,发病率为(1~6)/1 000[1];40%幸存者可留下轻度至重度神经发育残疾[2],如智力低下、脑瘫等。新生儿HIE的病理变化和胎龄、损伤性质及程度密切相关,包括选择性神经元损伤、脑水肿、缺血性脑梗死及继发性颅内出血等多样的病理改变[3]。磁共振(MRI)多参数、多序列扫描,软组织分辨率高,无放射性损害,是目前公认对新生儿 HIE最理想的影像学检查方法;MRI技术的进步提高了我们评估损伤的时机、严重程度的能力。本研究通过回顾性分析新生儿HIE MRI不同扫描序列的影像学表现,评估不同扫描序列在诊断中的应用价值,探讨MRI分度与临床分度一致性。
1 资料与方法
1.1 一般资料 选取我院 2017 年 12月至 2018年 12月临床诊断为新生儿 HIE 的76例患儿,男50 例,女26 例,胎龄或纠正胎龄 36~42 周,年龄 1~22 d,体重2.1~7.7 kg,所有患儿均行cMRI(T1WI、T2 WI、T2-FLAIR)、DWI以及EWSAN 检查。
1.2 影像学检查方法 采用 GE 公司 Signal 1.5T,头颅正交头线圈,T1WI-FLAIR序列、T2WI-FLAIR 序 列,T2-FLAIR序 列, DWI 序 列,ESWAN序列;T1WI-FLAIR序列TR2100 ms/TE30 ms;T2WI-FLAIR序列TR3200 ms/TE90 ms;T2-FLAIR 序列TR8000 ms/TE100 ms;DWI序列(b=0,1 000)TR4000 ms/TE Minimun;SAG T1WI TR1800/TE38;ESWAN TR Minimun 层厚2.0~4.0 mm 层间距 1.0 mm, FOV16-18 距阵 256×192,采集次数1~3。
1.3 图像分析 图像分析均由2名具备10年以上影像医师共同完成,以保障影像分析准确性。根据MRI表现分为轻度、中度、重度,MRI分度标准参考相关文献[4],建立MRI计分系统对划定的5个区域,通过T1加权、T2加权和DWI序列异常信号,按计分规则分别进行计分,计算计分总和,按照分度标准确定损伤分度。MRI计分系统:(1)区域划定:(a)皮质下:尾状核、苍白球和壳核、丘脑和内囊后肢(PLIC);(b)白质;(c)皮质;(d)小脑;(e)脑干。(2)计分规则: 0=无异常信号,1=异常信号区域<25%,2=异常信号区域在25%~50%之间,3=弥漫性损伤,范围>50%;在T1WI、T2WI序列,PLIC 计分0=内囊后肢髓鞘化良好(≥50%),2=髓鞘化不佳,3=缺乏髓鞘化;在DWI序列,PLIC计分 无弥散受限=0,广泛弥散受限=3。(3)计分方法:各个区域T1WI+T2WI+DWI独立计分,MRI损伤分度:5个区域计分总和0=无损伤;1~11=轻度损伤;12~32=中度损伤;33~138=重度损伤。
1.4 统计学方法 应用SPSS 19.0统计软件,计数资料采用2检验,以P<0.05为差异有统计学意义;MRI分度与临床分度一致性分析通过Kappa值分析,Kappa值≥0.75为一致性高,Kappa值在0.4~0.74为一致性良好,Kappa值<0.4为一致性差。
2 结果
2.1 76例新生儿HIE患儿MRI表现 (1)皮质下深部核灰质受损:包括尾状核、苍白球/壳核、丘脑,表现为斑点状T1WI高信号,T2WI呈低信号。(2)T1WI内囊后肢(PLIC)正常高信号消失。(3)脑皮层及脑白质受损:表现为条状或斑点状T1WI高信号,T2WI呈低信号,DWI呈高信号。(4)脑干/小脑受损:表现为斑点状T1WI高信号,T2WI呈低信号,DWI呈高信号。(5)脑水肿:表现为局灶或弥漫性T1WI低信号,T2WI呈高信号。(6)颅内出血:按部位分硬膜下出血、脑实质出血、脑室内出血、蛛网膜下腔出血等类型,表现为T1WI高信号,T2WI呈低信号,DWI呈高、低信号,ESWAN呈低信号。见图1、2。
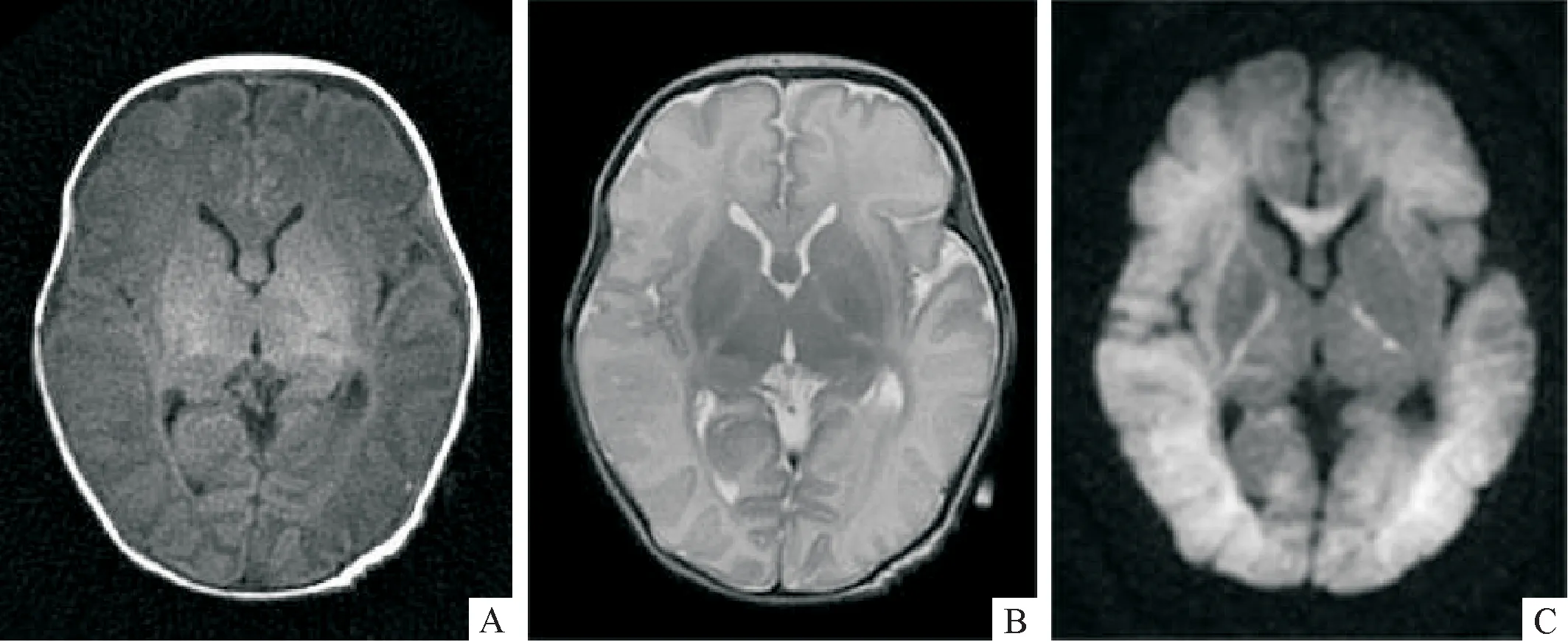
注:女2 d龄,重度HIE,MRI计分系统总分50分。A、B:分别T1WI和T2WI,双侧大脑半球弥漫性脑肿胀,灰白质分界不清;T1WI图像评分,皮质6分、白质6分,双侧背侧丘脑高信号2分,双侧内囊后肢(PLIC)高信号消失6分;T2WI图像评分,皮质6分、白质6分;C为DWI,示双侧大脑半球、胼胝体、PLIC高信号,图像评分,皮质6分、白质6分,PLIC 6分。
图1重度HIE患儿MRI检查

注:男 5 d龄。A、B分别为T1WI和T2WI,T1WI示双侧脑室旁斑片状高信号,相应T2WI呈低信号;C为ESWAN,示左侧丘脑斑片状低信号,代表左侧丘脑出血。
图2中度HIE患儿MRI检查
2.2 新生儿HIE MRI不同扫描序列组合的患儿检出例 76例新生儿 HIE患儿中,cMRI+DWI+SWI 共检出76例, cMRI 共检出阳性病例73例,cMRI+DWI 共检出76 例。
2.3 新生儿HIE不同序列出血灶检出率 根据出血部位分为:①区(硬膜下血肿)、②区(脑实质出血)、③区(脑室内出血)、④区(蛛网膜下腔出血)。76例HIE患儿ESWAN序列明确检出颅内出血23例,阳性率30.2%。其中轻度8例,中度15例,重度0例;不同序列颅内出血检出率及出血分布部位见表1。
2.4 新生儿HIE MRI分度与临床分度一致性 按照2004-11于长沙修订的《新生儿缺氧缺血性脑病诊断标准》,将76例新生儿HIE患儿分为轻度45 例,中度28 例,重度3 例。76例患儿MRI计分为1~50分,根据MRI计分系统进行MRI分度,以临床分度为标准, MRI正确分度67例,其中轻度正确分度 40例,分度过高5 例;中度准确分度24例,分度不足4例,分度过高0例;重度准确分度3例,分度不足0例。表2。
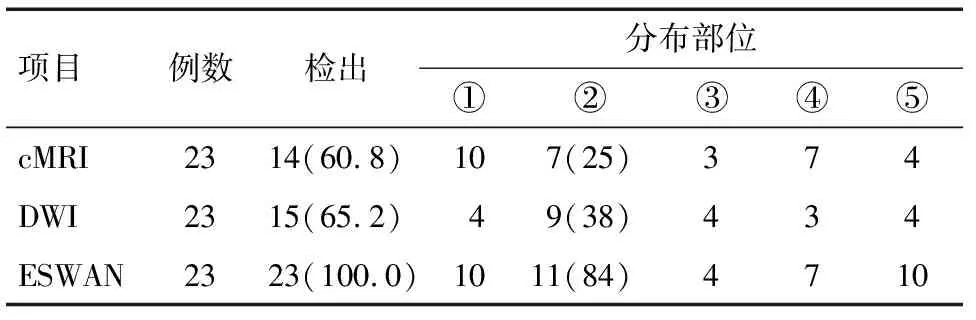
表1 不同序列出血灶检出例及分布部位情况例(%)
注:②区域()代表脑实质出血灶数目;⑤代表2个或2个以上区域出血

表2 76例HIE患儿MRI分度与临床分度比较 例
注:MRI分度与临床分度一致性高(Kappa值=0.789)
3 讨论
HIE cMRI影像表现T1加权比T2加权更明显,T1加权表现为皮层及皮层下白质点状、条状高信号,朱世军等[5]认为这是由于缺氧缺血导致血管不完全阻塞,当血流再灌注,发生反应性充血,毛细血管管壁通透性高,红细胞及血红蛋白渗出所致。皮层下灰质核团(包括尾状核、苍白球/壳核、丘脑等)以及脑干、小脑等区域T1加权高信号,可能由于细胞坏死,细胞内蛋白质释放且聚集,或者是缺血后再灌注所致的出血灶[6]。内囊后肢T1加权高信号缺乏,提示髓鞘化不良,病理基础为水肿或梗死[7]。当HIE急性期发生脑水肿时,表现为局灶或弥漫性T1加权低信号,T2加权高信号。Soul等[8]通过对HIE患儿研究发现,cMRI在发生缺氧缺血6 h内,无异常发现,32 h才开始出现信号改变。由此可见,发生缺氧缺血早期,cMRI对HIE的诊断有局限性。Barkovich等[9]研究认为cMRI不适合用于评估新生儿HIE早期改变,适用于随访。新生儿HIE可造成颅内出血,cMRI序列T1加权及T2加权,结合T2-FLAIR对于硬膜下、脑室内、蛛网膜下腔及较大范围的脑实质出血可以明确诊断。对发生于脑实质内的微小出血灶,cMRI显示效果欠佳,需要结合EWSAN序列。本组76例HIE患儿颅内出血23例,cMRI检出率为60.8%,其中硬膜下、脑室内、蛛网膜下腔出血诊断准确率达100%、100%及75.0%;11例HIE患儿脑实质出血灶总数84个,cMRI检出7例,病灶数25个,检出率仅29.7%,检出效果明显不如ESWAN。
DWI对微观水分子扩散限制较为敏感,在急性缺氧缺血早期,细胞膜Na-K泵功能障碍,细胞膜通透性增加,导致Na+内流,细胞外水分子进入细胞内,造成水分子扩散受限,DWI 表现为高信号,相应ADC 值降低,能够早期反映 HIE 细胞毒性水肿病理改变。HIE造成的脑损伤,DWI最早能在24~72 h内发现,结合T1加权、T2加权序列,2~5 d时间窗内能提供脑损伤时间的指示[10-13]。但DWI检查存在损伤程度被低估、假阴性以及假正常化现象[14]。特别是随着病情的发展,大约1周,细胞毒性水肿向血管源性水肿转换,水分子扩散受限少,DWI常出现假阴性。Barkovich等[9]通过对7例HIE患儿DWI及cMRI检查对比后发现,在发病后24 h 内,cMRI检查为阴性,而DWI可见异常高信号;在1周后随访复查时,cMRI检查多表现为阳性,而DWI检查已表现为阴性。本组76例HIE患儿,DWI阳性病例44例,38例患儿年龄1~7 d,与报道基本相符。其中6例DWI阳性患儿年龄超过7 d,笔者认为此时DWI高信号可能是未吸收脑出血灶或新发脑损伤所致。所以,DWI能够比cMRI更早、更容易发现HIE患儿早期病理生理改变,提高早期诊断准确率。同时,DWI(b=0,1 000)具有T2*效应,对颅内出血引起的磁场不均匀性较敏感。本组病例DWI对硬膜下、蛛网膜下腔出血的显示不如cMRI敏感,但对脑室内出血、脑实质内出血的显示较cMRI敏感。
磁敏感加权成像(ESWAN)是一种通过在3个方向上完全流动补偿的T2*脉冲序列,具有高分辨率、薄层三维、高信噪比的特点,主要反映组织磁化属性,借助不同组织之间磁敏感特性的差异而产生影像对比,通过相位后处理,能清晰显示出血、钙化等顺磁性物质,尤其对微小出血灶的检测最为敏感[15]。Babikian等[16]通过研究,发现合并颅内出血的HIE患儿,脑出血灶的体积与1~4年后儿童智力、神经系统功能密切相关。所以,早期发现颅内出血对于HIE的诊断和分度,以及预后评估具有重要意义。王晓虎等[17]通过研究后发现,轻度HIE患儿,颅内出血检出率明显低于中、重度HIE患儿;而中、重度HIE患儿,颅内出血检出率无显著差异。本组76例HIE患儿ESWAN明确检出颅内出血者23例,阳性率30.2%,表现为硬膜下出血、脑实质内出血、脑室内出血及蛛网膜下腔出血;ESWAN检出23例(100%),明显高于cMRI 14例(60.8%)及DWI 15例(65.2%);检测结果差异有统计学意义(2=8.840 8,P<0.05;2=7.414 5,P<0.05);其中轻度8例(34.8%),中度15例(65.2%);轻度HIE患儿颅内出血检出率显著低于中度HIE患儿,轻、中度HIE患儿颅内出血率检测结果差异有统计学意义(2=4.260 9,P<0.05),与报道结果基本相符。由于本组病例重度HIE患儿较少,没有发现颅内出血病例。
cMRI在反映HIE亚急性期病变方面效果较好,特别适用于随访。DWI能够提供早期脑损伤时间的指示,反映HIE早期病理改变。EWSAN对HIE合并颅内出血的检测较cMRI及DWI 敏感,能够提高新生儿颅内出血的检出率。cMRI+DWI + EWSAN 多序列组合扫描能全面反映新生儿 HIE不同时期多样的病理变化,提高诊断准确率,是新生儿 HIE检查的最佳序列组合。
本组76例HIE患儿,MRI分度与临床分度总符合率为88.15%,轻度符合率为88.88%,中度符合率为82.76%,重度符合率为100%,Kappa值为0.789,一致性高。对于存在的偏差,笔者认为HIE患儿临床评估与MRI检查存在一定时间差,脑组织可能发生一定程度病理生理改变,加上治疗干预等因素,影响MRI分度准确性。
总之,新生儿HIE可有多样病理改变,在MRI上呈现出不同影像,常规扫描序列结合DWI、ESWAN扫描能更早期准确深入地揭示新生儿 HIE解剖、病理改变,与临床分度一致性高,能早期准确的诊断,以及为脑损伤程度、预后评估提供科学的依据。
