超声内镜引导下胆管引流技术中肝胃吻合术与顺行技术治疗恶性梗阻性黄疸患者的疗效及安全性比较
2019-06-04郭瑾陶
廖 晔, 郭瑾陶
(中国医科大学附属盛京医院 内镜诊治中心, 辽宁 沈阳, 110004)
自20世纪90年代以来,经内镜逆行性胰胆管造影术(ERCP)已成为良、恶性胆道梗阻患者的首选引流方式,但也存在一定的局限性,如患者壶腹部解剖结构发生改变(如消化道术后或先天异常),即使由经验丰富的内镜医师操作也可能发生乳头插管失败。ERCP失败后缓解胆道梗阻的传统方法是经皮肝穿刺胆管引流术(PTCD)或外科手术治疗,二者均属于非生理性引流方式,并发症发生率较高,严重影响患者生存质量[1]。
Giovannini M等[2]在2001年首次提出内镜超声引导下胆管引流术(EUS-BD), 凭借其经济、解剖及生理性的优势,EUS-BD已被视为ERCP失败后的有效补救治疗措施[3]。有研究[4]证实,对于无法切除的恶性远端胆道梗阻,EUS-BD与PTBD均可作为首选治疗方案。根据穿刺位置,EUS-BD可分为肝外途径与经肝途径。现有研究[5-6]认为,经肝途径是存在肝内胆管扩张时的首选引流途径。根据引流方式的不同,肝内途径又可分为EUS引导下肝胃吻合术(EUS-HGS)、对接技术(RV)与EUS引导下顺行技术(EUS-AG)。由于RV途径具有不产生永久性瘘道、引流符合正常生理解剖结构、操作与ERCP类似、并发症发生率低等优势,多被推荐为EUS-BD的首选方案[7-8], 但其需要逆行支架植入,当内镜无法到达十二指肠乳头时, RV无法实现,而HGS和AG是可行的[9]。本研究回顾了15例行EUS-HGS或EUS-AG的恶性胆道梗阻患者的临床效果及并发症发生情况,现将结果报告如下。
1 资料与方法
1.1 一般资料
选取2014年10月—2018年12月本院住院期间行肝内途径EUS-BD的恶性梗阻性黄疸患者共15例,其中11例患者行EUS-HGS(男8例、女3例),4例患者行EUS-AG(男3例、女1例),平均年龄(66.9±9.0)岁。所有手术由具有EUS与ERCP丰富操作经验的内镜医师在麻醉下完成。
1.2 使用器材
日本Pentax EG-3870UTK线阵超声内镜, HITACHI EUB-6500超声主机; 美国Wilson-Cook 19-G穿刺针,美国Boston-Scientific 0.035英寸导丝,美国Wilson-Cook 6Fr囊肿切开刀,美国Wilson-Cook 10 mm×80 mm全覆膜金属胆道支架,美国Boston-Scientifc 10 mm×60 mm全覆膜金属胆道支架,美国Boston-Scientific 10 mm×60 mm不覆膜金属胆道支架。
1.3 治疗方法
线阵式超声内镜进镜至胃内,扫查肝脏左外叶,选择一处与胃壁较近的扩张肝内胆管作为穿刺点(B2或B3), 应用彩色多普勒功能避开穿刺路径中的血管。穿刺针刺入胆管后,回抽胆汁以确定穿刺针在胆道内,而后注入造影剂进行胆管造影,进一步明确穿刺针位置,显示扩张的肝内外胆管。
EUS-HGS组通过穿刺针置入导丝,放置于胆总管内。沿导丝制造胃与肝内胆管的瘘道,使用囊肿切开刀形成瘘道,根据狭窄程度置入6~8 cm金属支架并释放。EUS-AG组通过穿刺针置入导丝,通过狭窄段或十二指肠乳头。使用囊肿切开刀形成瘘道,根据狭窄段长度顺行置入6~8 cm金属支架,经乳头放置或通过恶性狭窄。造影见胆管内造影剂引流通畅,无外溢。
1.4 术后处理
患者治疗后卧床休息,禁食、禁水,给予补液、抑酸、经验性应用抗菌药物治疗,并密切观察症状和生命体征,注意有无消化道出血、胆汁外溢、腹膜炎、胰腺炎等并发症出现,观察肝功能、血常规等指标,复查腹部CT以观察支架位置形态及有无移位等。
1.5 观察指标
本研究中,操作成功指穿刺成功并放置胆管支架或取石成功,临床成功指术后总胆红素较术前下降。观察2组的操作成功率、临床成功率、术后第1天血清总胆红素下降情况、并发症发生率、住院时间等。
1.6 统计学分析
采用SPSS 25.0统计软件进行数据分析。计量资料以均数±标准差表示,组间比较采用t检验,计数资料采用Fisher′s精确检验法,P<0.05为差异有统计学意义。
2 结 果
2.1 2组患者一般资料比较
2组患者原发病、性别、年龄、术前总胆红素水平比较,差异均无统计学意义(P>0.05)。见表1。
2.2 2组患者相关指标比较
2组操作成功率、临床成功率、术前及术后第1天总胆红素、总胆红素下降率比较,差异无统计学意义(P>0.05), 但2组术后第1天总胆红素水平均较术前显著下降(P<0.05), 见表2。EUS-HGS组发生并发症患者共3例(27.3%), 其中2例菌血症,1例局限性腹膜炎,保守治疗后均缓解; EUS-AG组发生1例感染性休克(25.0%), 患者于术后第12天死亡。EUS-HGS组术后并发症发生率高于EUS-AG, 但差异无统计学意义(P>0.05)。
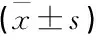
表1 2组患者一般资料比较
2.3 2组患者术后住院时间、生存时间、支架再梗阻情况比较
EUS-HGS组术后住院时间、生存时间依次为(9.0±5.7)、(273.7±64.4) d, 与EUS-AG组的(7.3±4.4)、(55.3±41.2) d比较,差异无统计学意义(P>0.05)。EUS-HGS组有4例患者术后发生支架再梗阻,均由肿瘤进展导致,支架再梗阻率为26.7%, 其中2例行PTCD后黄疸缓解, 1例于支架内留置鼻胆管引流, 1例行EUS-AG后缓解。EUS-AG组未发生支架再梗阻。
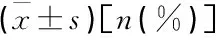
表2 2组患者相关指标比较
与术前比较, *P<0.05。
3 讨 论
EUS-HGS与EUS-AG的安全性与有效性已被大量临床数据所证实,但尚无直接比较二者优劣的研究。内镜无法触及十二指肠乳头是二者相同的手术适应证,且此类患者多为恶性肿瘤晚期,身体状况差,难以耐受多次手术,因而两种术式的适宜选择极为重要。
多数研究[10-19]报道EUS-HGS的技术成功率、临床成功率要略优于EUS-AG, 与本研究结果基本相符。本研究中, 2组术后第1天血清总胆红素均较术前显著下降(P<0.05), 证实二者均有效。本研究中, EUS-HGS组的临床成功率(90.9%)高于EUS-AG组(75.0%), 但其不良事件发生率(27.3%)亦高于EUS-AG组(25.0%), 这可能是由于EUS-AG的操作更为复杂,但其不产生永久性瘘道且引流符合正常生理解剖结构。
对于恶性胆道梗阻患者, EUS-BD属于姑息治疗手段,通过引流胆汁而改善肝脏功能,延长患者生存时间,改善生活质量。但肿瘤的持续进展常会导致胆道再次梗阻,甚至导致患者死亡,因而支架的通畅情况及术后再发胆道梗阻的多次介入治疗对于恶性胆道梗阻患者同样重要。本研究随访中共4例患者发生术后支架再次梗阻(均为HGS组),支架再梗阻率为26.7%, 其中2例行PTCD, 1例于支架内置入鼻胆管引流,另1例患者分别于术后4个月与1年后发生胆道再梗阻,均通过AG手术治疗缓解。从解剖结构上考虑, AG支架放置于肿瘤处,而肿瘤的支架内生长是支架再梗阻的主要原因,其支架再梗阻的可能性应大于HGS。本研究中再次梗阻均发生在HGS组,可能与患者术后生存时间长于AG组患者有关。由于没有穿壁瘘道, AG术后梗阻的内镜下再次干预较HGS更为困难。有相关报道[20-23]提出,同时行HGS与AG可以延长支架的通畅时间,减少不良事件的发生。
壶腹部解剖结构复杂,恶性胆道梗阻患者由于肿瘤侵袭常合并有消化道梗阻[24]。本研究中共有3例患者出现了胆道合并消化道梗阻,作者尝试通过同时置入胆道支架与十二指肠支架(EUS-AG组1例, EUS-HGS组1例)或同时行内镜下胃肠吻合术(EUS-HGS组1例)解决。对于胆道合并十二指肠梗阻的双支架同时置入,此前曾有许多相关报道。通过ERCP或经皮置入胆道支架,手术总成功率为86.0%~100.0%[24-26]。Canena J等[25]提出,对于双支架置入的患者,十二指肠支架梗阻是胆道支架梗阻的独立危险因素。通过EUS-BD置入胆道支架,合并十二指肠支架的成功率为100.0%, 不良事件发生率为27.3%~100.0%[27]。本研究中, 2例胆道支架与十二指肠支架均成功置入,且胆道引流通畅。EUS-AG组1例患者术后第5天出现消化道梗阻、感染性休克、弥散性血管内凝血(DIC), 复查CT示十二指肠末端及近端空肠管腔仍狭窄,术后第12天患者死亡。考虑其死亡原因为消化道梗阻未能完全缓解,且肿瘤进展导致肝功下降,胆汁分泌减少,食物反流入胆道导致感染性休克。该病例提示同时患有胆道与消化道梗阻的患者需在充分缓解消化道梗阻后再行胆道内引流,避免引起胆道感染。本研究结果提示, EUS-HGS比EUS-AG具有更高的临床成功率与不良事件发生率,但差异无统计学意义。
