骨髓增生异常综合征患者PTPN11基因的表达及意义
2019-06-04赵晓燕郭晓吴海兵丁韧烨曾惠
赵晓燕,郭晓 ,吴海兵,丁韧烨,曾惠
(嘉兴市第一医院,浙江 嘉兴 314000)
骨髓增生异常综合征(myelodysplasticsyndromes,MDS)是起源于造血干细胞的一组异质性髓系克隆性疾病,特点是髓系细胞发育异常,表现为无效造血、难治性血细胞减少,高风险向急性髓系白血病(AML)转化。迄今为止,MDS的病因尚未明确,相关的发病机制可能包括:染色体异常,癌基因与抑癌基因异常,骨髓造血干、祖细胞体外分化生长异常,单克隆性造血及造血细胞凋亡等[1]。酪氨酸蛋白磷酸酶非受体Ⅱ型(PTPN11)编码蛋白酪氨酸磷酸酶(PTP)SHP-2,是 PTP家族的成员[2]。SHP-2通过SH2功能域结合到酪氨酸磷酸蛋白质,使PTP酶激活,从而作为生长因子、细胞因子及其他胞外刺激因素的下游信号分子,参与信号转导,调节细胞增殖、迁移、分化、死亡等[3-4]。PTPN11在血液系统发育中发挥重要作用,参与造血生长因子以及 IL-3、EPO、SCF、GM-SCF、IL-5 和 PDGF 的信号转导,是细胞造血不可缺少的信号分子[5]。PTPN11也可见于某些急性髓系白血病亚型中,但与MDS的表达及发生有无相关性尚未见报道。本文回顾性分析本院82例MDS患者,探讨PTPN11基因对MDS的临床意义,报道如下。
1 资料与方法
1.1 一般资料 选择2015年9月-2018年9月本院符合MDS入选标准[6]的82例作为MDS组,男42例,女 40 例,年龄 23-76 岁,平均(58.4±11.4)岁;另外选择同期良性血细胞减少患者30例作为对照组,其中男 17例,女 13例,年龄 24-75岁,平均(60.2±12.5)岁。两组在年龄、性别构成方面差异无统计学意义(P>0.05),具有可比性。MDS纳入标准:入组患者均符合MDS的诊断标准,并签署知情同意书。MDS组排除标准[7]:(1)依从性差,不配合治疗;(2)患有肝脏、心脏以及肾脏等方面的严重疾病者;(3)神经类疾病患者,如神经纤维瘤病、Noonan综合征等。
1.2 方法 首先静脉采集患者的外周血4mL置于EDTA抗凝管中进行有核细胞的分离,再取15mL红细胞裂解液均匀混合后室温下静置10分钟,以 3000r/min的速度离心10分钟,弃上清液,在试管内加入7.5mL的生理盐水及与其体积相等的红细胞裂解液,重复混合均匀,离心后弃上清液,在剩余液体中加入15mL生理盐水,以3000r/min的速度离心10分钟,弃分离后的上清液,将试管内剩余液体与1mL生理盐水混匀,进行细胞计数。其次使细胞DNA被抽取,在1.5mL Eppendorf管中将 QIAamp Protease(20μL)与 PBS缓冲液重复洗涤过的细胞悬液(200μL)充分混匀,以 3000r/min的速度离心10分钟,后弃上清液,将1.5mL Eppendorf管内剩余液体与AL Buffer(200μL)振荡15秒,混匀后56℃水浴中加热10分钟,以2000r/min的速度离心10分钟,离心后液体沉积在 Eppendorf管底部,与无水乙醇(20μL)振荡混匀,持续15秒,将Eppendorf管内的液体通过QIAamp吸附柱转移至2mL收集管中,以8000r/min的速度高速离心1分钟。取一个2mL收集管中QIAamp 吸附柱上注入 AW1 Buffer (500μL),以8000r/min的速度高速离心1分钟,另取一个2mL收集管中QIAamp吸附柱上注入AW2 Buffer(500μL),以 14000r/min的速度高速离心3分钟。在另一个2mL收集管中放置 QIAamp吸附柱,重复高速离心1分钟。重新取一个1.5mL Eppendorf管放置 QIAamp吸附柱上注入 AE Buffer(50μL),在室温下静置 5分钟后以 8000r/min的速度高速离心1分钟。对提取的细胞DNA质量及浓度结果进行分析,并进行PCR扩增:通过预变性及多个反应循环,并进行延伸。根据电泳结果确定基因表达。
1.3 观察指标 检测到表达及突变即判定为阳性。根据IPSS评分结果,≤2分为低中危组,≥2.5分为高危组,分析低中危组及高危组PTPN11基因的表达。根据WHO分型,MDS包括四种亚型,分别为RA、RAS、RAEB/RAEB-T、CMML,分析四种亚型的PTPN11基因表达。
1.4 统计学处理 采用SPSS20.0软件进行统计,正态计量数据用(x±s)表示,组间比较采用t检验,计数资料用率表示,比较采用χ2检验。
2 结果
2.1 观察组与对照组PTPN11基因表达 观察组PTPN11基因阳性表达率显著高于对照组,差异具有统计学意义(P<0.05),详见表 1。

表1 两组PTPN11基因表达[n(%)]
2.2 低中危组与高危组PTPN11基因表达 高危组PTPN11基因阳性表达率高于低中危组,差异具有统计学意义(P<0.05),详见表 2。

表2 低中危组与高危组PTPN11基因表达结果分析[n(%)]
2.3 四种MDS亚型的PTPN11基因表达 高危组RAEB/RAEB-T和CMML的PTPN11阳性表达率均明显高于低中危组RA和RAS,差异具有统计学意义(P<0.05)。而低中危组RA与RAS间以及高危组RAEB/RAEB-T与CMML之间差异均无统计学意义(均P>0.05),详见表 4。
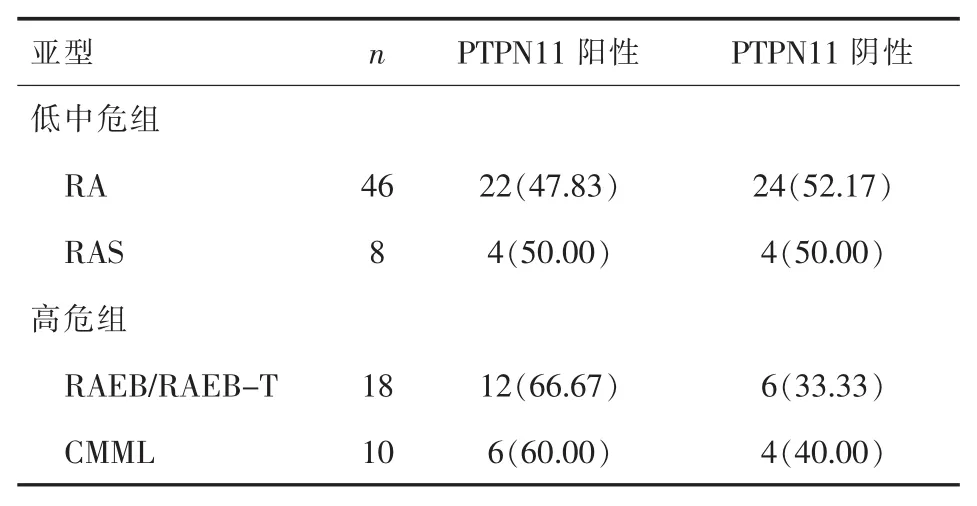
表4 四种MDS亚型的PTPN11基因表达[n(%)]
3 讨论
MDS为恶性克隆增殖性疾病,典型特征为骨髓造血干细胞增殖分化异常且具有很高的白血病转化风险,患者生存率较低。由于机体造血功能受抑制,骨髓造血干细胞被损伤,多表现为一系或多系血细胞数量降低、骨髓病态造血等[8]。研究表明,PTPN11编码蛋白SHP-2是 Akt和 Erk信号途径活化所必须的,而后两者由于促进肿瘤细胞的增殖、生存和抗凋亡,已被证实在许多肿瘤的发生和发展过程中起着重要的作用[9-10]。临床上采用检测蛋白酪氨酸磷酸酶,即PTPN11编码的SHP-2。用于检测MDS患者PTPN11基因表达,对判断疗效及预后具有较高的临床意义。
本文表明,观察组82例MDS患者PTPN11基因阳性表达率为53.67%,显著高于对照组33.33%(P<0.05), 说明 PTPN11 的检测对诊断MDS有一定价值。82例MDS患者低中危组50例,高危组32例,高危组PTPN11基因阳性表达率(75%)高于低中危组(40%),差异有统计学意义(P<0.05)。高危MDS患者一般生存时间短,转化为急性白血病的风险高,预后不佳,可能与PTPN11与肿瘤细胞的增殖、生存及抗凋亡有关,PTPN11可作为MDS克隆细胞克隆负荷标志及疾病进展标志。Germing等[11]在对 1095例 MDS患者的研究中发现,各MDS亚型中随着危险度上升,其转化为白血病的比例也随之升高。MDS四个亚型(RA、RAS、RAEB/RAEB-T 和 CMML)的PTPN11基因阳性表达率分别为47.83%、50.00%、66.67%、60.00%。高危组RAEB/RAEB-T和CMML的PTPN11阳性表达率明显高于低中危组RA和RAS,对不同亚型的预后判断有一定的帮助,高危组预后明显差于低中危组。
MDS的易感基因为PTPN11基因。采集患者的外周血进行有核细胞分离,其次使细胞DNA被抽取进行PCR扩增并根据电泳结果确定基因表达,可有效检出PTPN11基因阳性表达率,具有较高的安全性,其操作简单、检查时间短、重复性好[12]、价格经济,具有较好的应用价值。本文未深入分析PTPN11基因突变率,后期可进一步扩大样本量进行研究。
综上所述,MDS的易感基因为PTPN11基因,肿瘤细胞的增殖及白血病转化与 PTPN11基因亚型有关。检测PTPN11基因表达可有效监测MDS患者的病情及预后,有较高的临床意义。
