3.0 T MRI不同序列诊断肾细胞癌亚型的应用价值
2019-06-03孟庆成夏威利闫亮亮黎海亮曲金荣赵二江
孟庆成,夏威利,闫亮亮,黎海亮*,曲金荣,赵二江
肾细胞癌是肾脏最常见的原发性恶性肿瘤,占所有成人肿瘤的2%~3%,世界上肿瘤死亡原因中占据第6位,病理主要分为透明细胞型、乳头状细胞型、嫌色细胞型及嗜酸粒细胞型等。既往研究证实,乳头状细胞型及嫌色细胞型肾癌的预后明显好于透明细胞型肾癌[1]。MRI因其具有局部高分辨力、组织对比度好及能够准确显示病变的组织成分等优势而被广泛应用于肾细胞癌的诊断,其中研究较多的是扩散加权成像(diffusion weighted imaging,DWI)的表观扩散系数(apparent diffusion coefficient,ADC)值及动态增强特征[2-3],但由于ADC值受主、客观的影响因素较多及动态增强的特征差异较大[4-5],从而限制了其在临床的应用。本研究采用MRI的不同检查序列进行定量评估,探讨MRI不同评价指标鉴别诊断透明细胞型及非透明细胞型肾癌的应用价值。
1 材料与方法
1.1 一般资料
回顾性分析河南省肿瘤医院放射科自2014年3月至2017年3月在本院经手术病理证实的40例肾癌患者资料,其中男28例,女12例,年龄36~79岁,平均(56.4±8.7)岁。均为单肾单发病灶,所有患者术前均行肾脏的3.0 T MR平扫及动态增强。根据病理情况分为透明细胞型肾癌组21例(术后病理分期Ⅰ期2例,Ⅱ期12例,Ⅲ期5例,Ⅳ期2例)及非透明细胞型肾癌组19例(乳头状细胞型11例,嫌色细胞型8例,Ⅰ期1例,Ⅱ期3例,Ⅲ期14例,Ⅳ期1例),两组患者一般情况差异无统计学意义,具有可比性。患者检查前均对检查情况知情同意并签署了知情同意书。
1.2 检查方法
采用3.0 T MR 扫描仪(Signa HDx,GE Healthcare,Waukesha,WI,USA),使用腹部相控阵线圈,患者平静呼吸,加呼吸门控,肾脏轴位、冠状位快速恢复快速自旋回波序列T2WI:TR/TE 3000~7000 ms/110~115 ms,层厚4~5 mm,层距0.5~1.0 mm,FOV (26~35) cm×(35~40) cm,矩阵320×224,采集时间为2 min 48 s。DWI成像:采用轴面扫描,选用体部矩阵线圈,采用平面回波DWI (echo planar imaging DWI,EPIDWI),扫描参数:TR 5000 ms,TE 55.2 ms,矩阵128×128,层厚4 mm,层距l mm,FOV (35~40) cm×(35~40) cm,激励次数1,呼气末屏气状态下扫描,扫描时间为20 s。b值为0、700 s/mm2,3个方向均施加扩散梯度。增强扫描采用对比剂Gd-DTPA,剂量为0.1 mmoL/kg,经肘静脉以2 mL/s的流率团注。训练患者屏气幅度尽可能前后一致,一次屏气时间内完成肾区扫描。增强扫描时间为注射对比剂后30 s (皮质期)、100 s (实质期)及5 min (延迟期)。扫描参数:层厚8.0 mm,层间距0.8 mm,采集矩阵292×164,重建矩阵512×512,FOV 380 mm×265 mm。
1.3 图像观察及数据测量
由2名资深腹部影像诊断医生复阅MR图像,记录患者病灶出血、坏死、囊变及静脉癌栓的出现情况。采用AW4.4工作站的FuncTool软件进行DWI数据的后处理:调整域值范围以包含整个肾脏,由工作站自动生成肾脏ADC伪彩图。感兴趣区(region of interest,ROI)的选择:对于肾实质,ROI尽量放在肾门水平肾脏前外侧皮髓质交界区,ROI为圆形或椭圆形,包括肾皮质和肾髓质各约50%;对于病灶,ROI的位置需根据肿瘤的增强皮质期选取病变的实性成分区,尽量避开坏死、出血、变性及钙化区域(图1~3)。病灶及肾皮质信号强度均通过对ROI测定获得,以病灶各期强化最明显处为ROI,肾皮质的ROI尽量选病变同侧未受累的肾脏中部皮质,如病灶较大且累及肾脏中部时则选对侧肾脏中部皮质。ROI平均大小为1.5 cm2。同一患者所测定ROI的位置、大小保持一致。信号强度变化(△sI)=(sI增强后-sI增强前)/sI增强前×100%;肿瘤-皮质增强指数=△SI肿瘤/△SI皮质[6]。
1.4 统计学分析
采用SPSS 17.0软件进行分析,计量资料采用t检验分析,分类资料采用卡方检验,P<0.05表示差异有统计学意义。界值的确定采用受试者工作特征(receiver operating characteristic,ROC)曲线。
2 结果
2.1 透明细胞型肾癌组与非透明细胞型肾癌组患者MR平扫及动态增强表现

图1 患者,男,56岁。A:压脂T2WI混杂高信号;B:增强扫描动脉期实性成分强化明显,囊性成分未见强化;C:ADC图呈混杂高信号;D:病理示透明细胞型肾癌 图2 患者,女,43岁。A:压脂T2WI低信号;B:增强扫描略强化;C:ADC图低信号;D:病理示乳头状细胞型肾癌 图3 患者,男,67岁。A:压脂T2WI混杂等信号;B:增强扫描略强化;C:ADC图混杂低信号;D:病理示嫌色细胞型肾癌Fig. 1 Male, 56 years old. A: Mixed high signal of lipid-pressing T2WI; B: Enhanced scanning arterial phase solid component was significantly enhanced, while cystic component was not enhanced; C: The ADC graph shows mixed high signal; D: Pathological examination showed clear cell type renal carcinoma. Fig. 2 Female, 43 years old. A: Low signal of lipid-pressing T2WI; B: Enhanced scan slightly enhanced; C: Low signal in ADC; D: Shows papillary cell type renal cancer. Fig. 3 Male, 67 years old. A: Lipid-pressing T2WI mixed signals; B: Enhanced scanning slightly enhanced; C: ADC mixed low signal; D: Pathologic manifestations of chromophobe cell renal carcinoma.
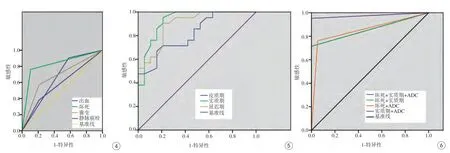
图4 MRI不同影像征象的ROC曲线 图5 增强MRI不同期相的ROC曲线 图6 不同MRI诊断指标组合的ROC曲线Fig. 4 ROC curve of MRI different image signs. Fig. 5 ROC curve of enhanced MRI at different phases. Fig. 6 ROC curve of different MRI diagnostic indicators combination.
MR平扫征象中,与非透明细胞型肾癌组患者比较,透明细胞型肾癌患者的坏死、囊变的出现率明显高于非透明细胞型肾癌组患者,出血的出现率低于非透明细胞型肾癌组患者,差异有统计学意义(χ2=17.378、5.414、4.043,P=0.00、0.020、0.044);而两组静脉癌栓的出现率的差异无统计学意义(χ2=1.380,P=0.240);出血、坏死、囊变及静脉癌栓的ROC曲线下面积分别为0.663、0.828、0.680、0.585(图4)。DWI序列中,透明细胞型肾癌患者病变的ADC值高于非透明细胞型肾癌组患者,二者差异有统计学意义(t=6.269,P=0.00)。详见表1。
2.2 透明细胞型肾癌患者MR平扫及动态增强评价指标的ROC曲线
透明细胞型肾癌患者的皮质期、实质期及延迟期肿瘤-皮质强化指数均明显高于非透明细胞型肾癌组,差异有统计学意义(t=4.082、6.509、6.083,P均=0.00)。动态增强皮质期、实质期及延迟期肿瘤-皮质增强指数对诊断透明细胞型肾癌ROC曲线下面积分别为0.817、0.929、0.897;实质期ROC曲线下面积最大,以0.77为临界值,敏感度为0.952,特异度为0.789(图5)。详见表2。
表1 两组患者MR平扫及ADC值表现比较(x±s)Tab. 1 Comparison of MR plain scan and ADC values between the two groups (±s)

表1 两组患者MR平扫及ADC值表现比较(x±s)Tab. 1 Comparison of MR plain scan and ADC values between the two groups (±s)
注:两组比较,ADC值采用χ2检验;出血、囊变、坏死及静脉癌栓采用t检验
组别 例数 ADC值(×10-3 mm/s)MR平扫征象(n/%)出血 坏死 囊变 静脉癌栓透明细胞癌组 21 2.01±0.33 2/9.5 16/76.2 9/42.9 8/38.1非透明细胞癌组 19 1.49±0.13 8/42.1 2/10.5 15/78.9 4/21.1 χ2值/t值 6.269 4.043 17.378 5.414 1.380 P值 0.000 0.044 0.000 0.020 0.240
表2 两组患者的肿瘤-皮质强化指数比较(x±s)Tab. 2 Comparison of tumor-cortical enhancement index between the two groups of patients (±s)

表2 两组患者的肿瘤-皮质强化指数比较(x±s)Tab. 2 Comparison of tumor-cortical enhancement index between the two groups of patients (±s)
注:本表采用t检验
组别 例数 皮质期 实质期 延迟期透明细胞癌组 21 1.09±0.16 0.92±0.10 0.81±0.11非透明细胞癌组 19 0.84±0.23 0.65±0.15 0.56±0.14 t值 4.082 6.509 6.083 P值 0.000 0.000 0.000

表3 不同MRI诊断指标组合的ROC曲线Tab. 3 ROC curves of different MRI diagnostic indicators
2.3 不同诊断指标组合诊断透明细胞型肾癌的特异性及敏感性
选取诊断透明细胞型肾癌敏感性、特异性较高的指标如坏死、实质期肿瘤-皮质增强指数及病变ADC值为组合元素,筛选出诊断透明细胞型肾癌的最佳诊断方法。结果显示:ADC值结合实质期肿瘤-皮质增强指数对诊断透明细胞型肾癌的ROC曲线下面积为0.976,敏感度及特异度分别为0.952、1.0(图6)。详见表3。
3 讨论
3.1 肾细胞癌的不同亚型的MRI征象差异
不同细胞亚型肾癌的生长速度和转移发生率差异大,因而各亚型的肾细胞癌的影像学表现不尽相同,其手术方式及预后也不同。研究表明,乳头状肾细胞癌和嫌色细胞癌5年生存率为80%~90%,而透明细胞癌只有50%~60%,其中嫌色细胞癌的预后更好[7]。因此,术前正确诊断对手术方式的选择和预后判断具有重要意义。本研究显示,与肾脏的乳头状或嫌色细胞癌相对而言,透明细胞型肾癌起源于肾近曲小管,肿瘤细胞胞质透亮,瘤内血管网丰富,多同时含有实性和囊性结构。本研究显示,透明细胞型肾癌21例,乳头状细胞型12例,嫌色细胞型8例,由于透明细胞型肾癌的预后明显低于其他亚型,因而把乳头状细胞型、嫌色细胞型归为非透明细胞型肾癌组。与非透明细胞型肾癌组患者比较,透明细胞型肾癌患者的坏死、囊变的出现率明显高于非透明细胞型肾癌组患者,出血的出现率低于非透明细胞型肾癌组患者,各种影像学征象ROC曲线显示,坏死的敏感性及特异性最高。MRI对病变出血、坏死诊断的敏感性及特异性均很高[8-9],Beddy等[10]研究发现坏死与透明细胞型肾癌及其预后不佳密切相关,本组结果与该研究相仿;与透明细胞肾癌比较,乳头状及嫌色细胞肾癌为少血供肿瘤[11],无或轻度强化,嫌色细胞癌少有坏死、出血及囊性变,肿瘤质地相对比较均匀[12]。另外,静脉癌栓作为肾脏肿瘤的独立影响因素,与肾癌的分型、分期及预后密切相关[13],但本研究静脉癌栓的出现率两组的差异无统计学意义,可能与研究中透明细胞型肾癌的分期较早及例数较少有关。
另外,透明细胞型肾癌血供丰富,增强扫描强化程度高,动态增强扫描各期透明细胞型肾癌强化程度均最显著,肿瘤-皮质增强指数亦最高,以中重度强化为主[14],均体现其血管生成活跃、血供丰富的特点。两组患者病变各期强化指数呈递减型,体现了肾癌强化的快进快出的特征,但透明细胞型肾癌的下降速率高于非透明细胞型肾癌患者,间接证实了透明细胞型肾癌的富血供特性。本研究结果支持透明细胞型肾癌的强化特征,尤其以实质期肿瘤-皮质增强指数为著,与Kim等[15]的研究结果相仿。
3.2 MRI功能成像序列DWI区分肾细胞癌亚型的应用
DWI是目前唯一的一种无创性反映活体水分子扩散运动的成像方法。活体组织的扩散系数值受许多因素如细胞的生物学行为、体液的流动、温度等宏观因素以及脏器的运动影响。从扫描技术角度来看,DWI的图像质量主要与b值选择有关。大部分研究结果将b值范围确定为500~1000 s/mm2[16],在本研究中,将b值确定为700 s/mm2。ROI的设置对ADC值的测量结果也有较大的影响。既往的研究中,ROI范围的划分一般包括整个病变,由于肾脏肿瘤多数伴有不同程度的坏死、出血、变性及钙化区,并不能真实反映肾癌压型肿瘤细胞的特征。本研究采用动态增强实质期病变实质部分的最大截面作为ROI,平均大小为1.5 cm2,在相应DWI序列图像中测量ADC值。本研究结果显示,透明细胞型肾癌组患者病变的ADC值为(2.01±0.33)×10-3mm2/s,非透明细胞型肾癌组患者病变的ADC值为(1.49±0.13)×10-3mm2/s,二者差异有统计学意义,与前人的研究相仿[17]。可能原因是从组织病理学上来讲,肾透明细胞癌较其他亚型的肾癌更易出现坏死和出血,笔者倾向于肾透明细胞癌ADC值高于其他亚型的原因是肿瘤更多的发生镜下可见的坏死和出血导致了ADC值的升高[18]。
3.3 MRI多参数指标模型鉴别肾细胞癌亚型的意义
为进一步分析不同MRI表现诊断肾癌压型的临床应用价值,本研究选用了坏死、实质期肿瘤-皮质强化指数及ADC值作为评价指标,结果发现ADC值结合实质期肿瘤-皮质增强指数对诊断透明细胞型肾癌的敏感度及特异度最高,ROC曲线下面积为0.976,敏感度为0.952,特异度为1.0,与Notohamiprodjo等[19]的研究结果相仿。这说明多参数指标对于MRI鉴别肾癌压型具有一定的临床应用价值。本研究尚存在一些缺陷。首先本组资料较少,不能够定量统计出鉴别肾癌压型的可借鉴的ADC临界值。其次,DWI的测量区域与病理结果缺乏准确的对应关系,很难从组织病理学方面解释研究所得结果。
利益冲突:无。
