容积定量动态增强MRI在预测宫颈鳞癌淋巴脉管间隙浸润中的应用研究
2019-06-03白志强史洁段小慧沈君
白志强,史洁,段小慧,沈君*
宫颈癌是女性第4常见的恶性肿瘤,严重威胁着女性的身心健康[1]。宫颈癌的病理分型中,鳞状细胞癌约占80%。肿瘤淋巴脉管间隙浸润(lymph vascular space invasion,LVSI)反映了肿瘤的侵袭性,是宫颈癌转移和复发的危险因素[2],LVSI阳性患者和阴性患者的5年生存率及平均存活时间有显著差异。而且有无LVSI对早期患者的手术方式及术后支持治疗的方案选择有重要指导意义。目前,LVSI的诊断需通过术后病理检测,而采用影像学检查指标预测LVSI的报道少见。动态增强磁共振成像(dynamic contrast-enhanced MRI,DCE-MRI)能提供反映肿瘤组织微观血流动力学的半定量和定量参数,这些参数能反映肿瘤的血管生成,而血管生成在肿瘤的发生、进展中起着重要作用。因此,DCE-MRI的半定量和定量参数具有预测肿瘤侵袭性的潜力。本研究收集25例宫颈鳞癌患者进行DCEMRI检查,探讨DCE-MRI的半定量和定量参数在预测宫颈鳞癌LVSI中的价值。
1 材料与方法
1.1 一般资料
回顾性分析2017年7月至2018年3月中山大学孙逸仙纪念医院宫颈癌患者的DCE-MRI检查资料。病例入选标准:(1)初诊患者,无化疗、放疗史;(2)进行根治性手术切除治疗;(3)手术病理证实为鳞状细胞癌。排除标准:(1)国际妇产科联盟(international federation of gynecology and obstetrics,FIGO)分期为IA期;(2)未进行手术治疗者;(3)DCE-MRI图像运动伪影严重而影响DCE参数测量者。共收集64例宫颈癌患者,其中35例根治性手术,35例中术后病理证实为鳞癌者30例。30例宫颈鳞癌中,4例FIGO分期为IA期,1例DCE-MRI图像运动伪影严重,予以排除。最后,25例宫颈癌患者纳入分析,其中IB1期14例,IB2期5例,IIA1期3例,IIA2期3例;年龄31~70岁,平均年龄(50.0±9.6)岁。25例患者主要症状为阴道不规则流血或绝经后阴道出血。所有患者均在知情同意下完成检查并且签署知情同意书。
1.2 MRI检查
MRI检查采用荷兰Philips 3.0 T超导磁共振扫描仪(Gyroscan Achieva 3.0 TX),检查序列包括常规序列:①横断位T1加权快速自旋回波序列(turbo spin echo T1 weighted imaging,TSE-T1WI):TR=573 ms,TE=8 ms,回波链长度(echo train length,ETL)=5,FOV=220 mm×220 mm,矩阵=276×236,层厚=4 mm,层间距=1 mm,层数=24,信号平均次数(number of signal average,NSA)=2;②横断位TSE-T2WI序列:TR=3000 ms,TE=100 ms,ETL=22,FOV=150 mm×150 mm,矩阵=248×199,层厚=4 mm,层间距=1 mm,层数=24,NSA=3;③矢状位TSE-T2WI序列:TR=3000 ms,TE=100 ms,ETL=20,FOV=240 mm×240 mm,矩阵=240×240,层厚=4 mm,层间距=1 mm,层数=15,NSA=2。
常规平扫完成后进行DCE-MRI扫描,首先进行多翻转角横断位TRHIVE (T1 high resolution isotropic volume excitation)序列扫描,TR=3.1 ms,TE=1.42 ms,FOV=360 mm×250 mm,矩阵=144×100,层厚=3 mm,层间距=0 mm,层数=40,NSA=1,翻转角分别取2°、4°、6°、8°、10°和12°;多翻转角平扫完成后进行DCE-MRI序列扫描,主要参数与多翻转角平扫序列相同,翻转角=12°,120个动态期相,时间分辨率为3 s。检查前建立静脉通道留置针,在第4个动态扫描完成后使用高压注射器团注对比剂Gd-DTPA-BMA (欧乃影,GE医疗集团,爱尔兰),剂量为0.1 mmol/kg,速率为3 mL/s,对比剂注射完毕后采用相同速率注射生理盐水20 mL。
1.3 图像处理及分析
DCE-MRI数据传输至离线工作站,运用定量分析软件(Omni-Kinetics,GE Healthcare)进行图像处理。首先进行图像运动校正,再利用多翻转角成像数据进行T1-mapping计算,将感兴趣区(region of interest,ROI)放置于髂内动脉的中心获得动脉输入函数,然后采用Extended Tofts Linear血流动力学模型拟合DCEMRI数据,获得反映肿瘤血流灌注的半定量及定量参数,其中定量参数有:容积转移常数(volume transfer constant,Ktrans),单位为min-1;返流速率常数(efflux rate constant,Kep),单位为min-1;细胞外血管外体积分数(extracellular-extravascular volume fraction,Ve);血浆体积分数(plasma volume fraction,Vp)。半定量参数有:达峰时间(time to peak,TTP),单位为min;最大斜率(maximum slope,MaxSlope),单位为mmol/(min·L);浓度-时间曲线下面积(area under curve,AUC),单位为mmol·min/L;最大浓度(maximum concentration,MaxCon),单位为mmol/L。肿瘤DCEMRI参数测量时,在宫颈癌原发病灶上逐层绘制ROI,将获取的二维ROI融合为三维ROI,绘制ROI时避开肿瘤坏死和囊变区,尽量覆盖肿瘤全部实质部分,获得肿瘤的半定量和定量DCE-MRI参数。

图1 宫颈癌患者。A~C:女性,41岁,IIA期,术后病理证实为LVSI阳性;D~F:女性,53岁,IB期,术后病理证实为LVSI阴性。从左至右依次为横断T2WI、横断位脂肪抑制增强T1WI(T1+C+FS)、AUC伪彩图。LVSI阳性患者AUC为7.247,LVSI阴性患者AUC为0.741Fig. 1 A—C: A 41-year-old woman with cervical cancer which staged IIA, LVSI was proved positive by surgical pathology; D—F: A 53-year-old woman with cervical cancer which staged IB, LVSI was proved negative by surgical pathology. From left to right are transversal T2WI, fat-suppressed contrast-enhanced T1WI (T1+C+FS) and pseudo-colorized map of AUC. The AUC of LVSI positive and negative cases are 7.247 and 0.741, respectively.
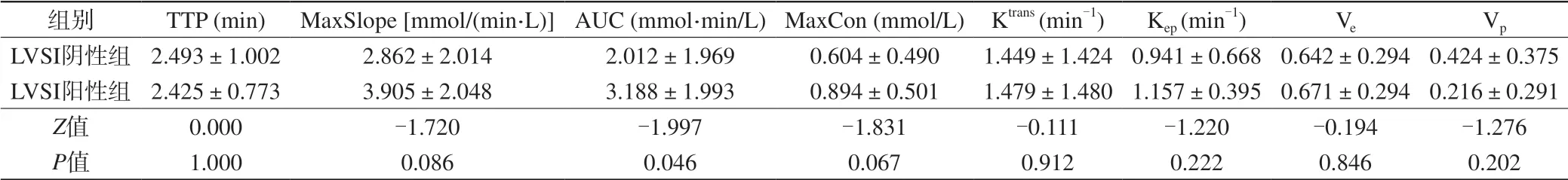
表1 LVSI阴性组和阳性组DCE-MRI各参数的组间比较Tab. 1 Comparisons of DCE-MRI parameters between LVSI negative group and positive groups
1.4 LVSI病理诊断
25例患者进行手术切除,切除的肿瘤进行常规病理检测,根据病理报告记录有无LVSI。LVSI是指显微镜下在扁平的内皮细胞围绕成的间隙中存在至少一簇肿瘤细胞。其诊断标准为受累血管周围存在淋巴细胞浸润且浸润灶临近其他血管,肿瘤内的LVSI灶予以排除[3]。
1.5 统计学处理
采用SPSS 17.0(Chicago,Ill,USA)统计学软件进行统计学分析。定量资料采用平均值±标准差表示。采用Mann-Whitney U秩和检验比较各参数在LVSI阴性组和阳性组间的差异,利用受试者工作特征(receiver operating characteristic,ROC)曲线分析差异有意义的参数的预测效能。采用双侧检验,检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
25例患者中LVSI阴性15例,阳性10例。LVSI阴性组及阳性组DCE-MRI参数组间比较见表1。LVSI阴性组和阳性组的AUC分别为2.012±1.969和3.188±1.993,AUC在两组之间的差异有统计学意义(P=0.046)(图1)。其余各参数在两组间的比较差异无统计学意义(P>0.05)。AUC预测宫颈鳞癌LVSI的ROC (图2)曲线下面积为0.740,取临界值为1.258,AUC预测宫颈鳞癌LVSI的准确率为0.760,敏感性为0.900,特异性为0.667。

图2 AUC预测LVSI的ROC曲线Fig. 2 ROC curve of AUC predicting LVSI.
3 讨论
3.1 LVSI对宫颈癌患者预后和治疗方案的重要影响
宫颈癌为女性常见的恶性肿瘤,其中鳞状细胞癌最为常见。LVSI的有无对患者的预后和治疗有重要影响。根据FIGO报道[4],对于临床分期为Ⅰ~Ⅱ期的宫颈癌患者,LVSI阳性者5年生存率为79.5%,阴性者为91.3%。对于临床分期为Ⅲ~Ⅳ期的宫颈癌患者,LVSI阳性者5年生存率为25.4%,阴性者为34.0%。Xie等[5]研究表明,LVSI阳性的早期患者平均存活时间比阴性患者短约1年5个月。此外,LVSI阳性是淋巴结转移的危险因素[6-7]。现行美国国立综合癌症网络指南指出,对于有生育要求的IA期LVSI阴性患者,可行单纯切除术或锥切,若LVSI阳性,则应同时行淋巴结清扫[8]。Sedlis标准对宫颈癌患者术后是否行放疗有重要的指导意义[9],而LVSI是构成Sedlis标准的一个指标,故LVSI对宫颈癌患者的后续治疗有重要的指导意义。
3.2 目前LVSI的评价方法及局限
LVSI是指显微镜下在扁平的内皮细胞围绕成的间隙中存在至少一簇肿瘤细胞,因此,LVSI需要依靠术后组织病理学检测才能明确。目前,评价LVSI的影像学手段十分少,Lee等[10]利用PET/CT评价LVSI,发现LVSI阴性组和阳性组的最大标准摄取值(SUVmax)不同,PET/CT有助于术前评价LVSI。但PET/CT检查价格昂贵且有辐射性,故难以普及。CT及MRI手段用于评估LVSI尚未见报道。
3.3 容积定量DCE-MRI评估LVSI的价值
DCE-MRI不仅可以提供丰富的解剖信息,而且能提供反映肿瘤血管生成情况的功能信息。血管生成与肿瘤的发生和进展密切相关,因此理论上,DCE-MRI半定量和定量参数具有预测肿瘤侵袭性的能力。本研究首次利用宫颈癌原发病灶的DCE-MRI参数来预测宫颈癌LVSI,发现LVSI阳性组原发肿瘤的AUC高于LVSI阴性组,AUC预测宫颈鳞癌LVSI的准确率可达0.760。
AUC是反映在给定时间内进入并且滞留于肿瘤组织的对比剂总量。研究表明,AUC与肿瘤的血流灌注、血管通透性和间质体积等病理特征有密切关系[11]。该参数具有稳定性好、不依赖于模型假设和容易获取等优势[12]。Thomassin-Naggara等[13]研究表明,AUC可用于鉴别卵巢附件区良恶性肿瘤,恶性肿瘤的AUC大于良性肿瘤。Li等[14]利用该参数评价乳腺癌患者的预后,并认为AUC大者预后差。还有学者[15]利用DCE-MRI参数评价抗血管生成药物对肿瘤的疗效,认为AUC的下降可作为药物有效的指征。叶裕丰等[16]认为,与正常宫颈和子宫肌瘤相比,宫颈癌时间-信号强度曲线上升支斜率更大,达峰时间更短,平台持续时间更长。上述研究表明AUC与肿瘤的侵袭性呈正相关。其原因可能是侵袭性越高的肿瘤新生血管越丰富、微血管通透性越大,而新生血管杂乱无章并相互交通,对比剂排出缓慢。宫颈癌原发肿瘤的AUC越大,其侵袭性越高,可能更容易发生LVSI。
本研究发现LVSI阳性及阴性组Ve无差别。Ve反映的是细胞外血管外间隙的容积分数,受细胞密度、微血管渗透性、坏死、囊变以及细胞外基质等多种因素的影响,Ve受这些因素影响不稳定。随着肿瘤恶性程度的增高,Ve值可增加或降低。与Ve相比,AUC稳定性好,且反映的是血流灌注、血管通透性和间质体积等病理指标的综合结果。另一方面,本研究中Ve在LVSI阴性组和阳性组间差异无统计学意义,可能的原因是LVSI阴性组和阳性组均为宫颈恶性肿瘤,故差异不显著。
3.4 本研究的局限性
本次研究存在如下局限性:①本研究病例数相对较少。原因在于较多的宫颈癌病例在确诊时已无法手术,另有相当一部分早期宫颈癌患者采取根治性放疗,而进行手术切除的病例数较少;②本研究结果除AUC差异有统计学意义外,其余DCE-MRI参数包括Ve,在LVSI阳性及阴性两组间差异并无统计学意义,原因可能与本研究纳入的样本量还较少有关,需要今后收集更多病例进行深入研究。
综上所述,本研究发现LVSI阳性的宫颈鳞癌其AUC高于LVSI阴性宫颈鳞癌,AUC预测宫颈鳞癌LVSI的准确率为0.760,qDCE-MRI半定量参数AUC可有效预测宫颈鳞癌的LVSI,为宫颈癌治疗方案的制订提供参考。
利益冲突:无。