不同乳腺非特殊型浸润性癌分子分型的MRI表观扩散系数特点研究
2019-06-03南帅明黄波罗娅红
南帅明,黄波,罗娅红
乳腺癌是在遗传及基因表型方面具有高度异质性的恶性肿瘤,不同分子分型的乳腺肿瘤对治疗的反应及预后等均存在显著的个体差异,而正常乳腺上皮结构的多样性可能成为乳腺癌异质性组织学基础[1]。由于精细化诊疗模式的推出,精准医学理念的广泛共识,利用基因谱、二代测序、DNA拷贝变异分析等基因技术研究的乳腺癌分子分型,为解决乳腺癌异质性、准确地判断预后提供了更为崭新的并适合个体化治疗的视角[2]。
当前MRI检测技术既能反映肿瘤形态学特征又能定量测定肿瘤的功能参数,能较准确地反映肿瘤生物学特性。我们常用表观弥散系数(apparent diffusion coeff icient,ADC)在活体水平对组织内水分子的扩散程度和某些生化物质含量变化进行定量评估,为乳腺恶性肿瘤的准确诊断提供依据[3]。因此,本文从乳腺癌筛查和指导临床的角度出发分析ADC值与乳腺癌不同分子分型是否具有相关性。
1 材料与方法
1.1 一般资料
收集2015年1月1日至2016年12月31日于辽宁省肿瘤医院就诊并进行MRI及扩散加权成像(diffusion weighted imaging,DWI)检查并经术后病理证实的158例乳腺癌女性患者资料,年龄25~76岁,平均年龄(52.0±10.6)岁,病理类型均为乳腺非特殊型浸润性癌。所有病例均为首诊病例且为单发病灶。所有确诊患者均行乳腺GE 1.5 T磁共振检查,且在行MRI检查前均未进行放、化疗及其他治疗。
1.2 乳腺癌分子分型
雌激素受体(estrogen receptor,ER)(SP1,Roche)、孕激素受体(progesterone receptor,PR) (1E2,Roche)、人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)(4B5,Roche)采用Ventana-Benchmark全自动免疫组化染色法,ER、PR以癌旁乳腺组织为阳性对照,HER-2选择既往阳性乳腺癌(3+)为阳性对照。阴性对照一抗以PBS代替。Ki-67(GM 001,GEN)采用EnVision二步法,DAB显色。根据2011年St.Gallen 会议专家共识,ER和PR以浸润性癌细胞核染色数目>1%为阳性;HER-2以浸润性癌细胞胞膜强阳性染色数目>30%为标准, Ki-67以癌细胞核着色数目≥14%为阳性。目前广为使用并达成共识的免疫组化的检测代替基因检测的分子分型[4-7]。Luminal A型:ER (+)和/或PR (+)、HER-2(-)、Ki-67阳性指数<14%;Luminal B型:ER (+)和/或PR (+)、HER-2(+)和/或Ki-67阳性指数≥14%;HER-2过表达型:ER (-)、PR (-)、HER-2(+);基底细胞样型:ER (-)、PR (-)、HER-2(-)、CK5/6和/或EGFR (+);未分类型:ER (-)、PR (-)、HER-2(-)、CK5/6(-)、EGFR (-)。由两名副高职称以上病理医师对标本HE切片以及免疫组化切片进行复检评阅,经联合评判达成一致意见的纳入本研究。
1.3 MRI检查方法
在月经周期第2周进行乳腺MRI检查。所有患者均行MRI平扫和DWI扫描,MRI检查应用GE 1.5 T EXCITE HD MR扫描设备,使用8通道乳腺专用相控阵表面线圈。患者取俯卧位,双侧乳腺自然悬垂。平扫采用双侧乳腺矢状位T2WI (加脂肪抑制)平扫,FSE FS T2WI:TR/TE=4650 ms/85 ms,层厚4 mm,层间距1.0 mm,矩阵320×224,NEX=4,FOV=20 cm×20 cm。再行横断面DWI扫描,扫描参数如下:扩散敏感系数b值分别取0、800 s/mm2,TE 63.2 ms,TR 5000 ms,层厚4 mm,层间距选取1 mm,全部DWI序列均加脂肪抑制。最后行横轴位3D-FSPGR序列(VIBRANT)多时相增强MRI扫描,经前臂肘正中静脉团注对比剂钆喷酸葡胺注射液前扫描1次,静脉团注对比剂(Gd-DTPA,0.1 mmol/kg)以2.0 ml/s后开始连续无间隔扫描8次,TR 6.1 ms,TE 2.9 ms,TI 13 ms,FOV=36 cm×36 cm,扫描块厚度52层,矩阵350×350,NEX 0.8。
1.4 数据处理及图像分析
扫描结束后,将不同扩散敏感度(b)值(0、800 s/mm2)的DWI资料传至GE ADW 4.3工作站,应用Diffusion后处理软件进行图像分析获得表观扩散系数图像。隐去患者姓名、年龄等个人信息,采用双盲法由医院两名副高职称的影像科医师参考常规T2WI、T2WI压脂及动态增强图像,在避开出血、液化、坏死和囊变的前提下,以800 s/mm2作为其扩散敏感系数,将感兴趣区(region of interest,ROI)固定于病变的中央且信号于病灶最大层面或/及其上下两层面,ROI图形形态一致,面积为20~40 mm2,每个ROI均重复测量3次,取平均ADC值作为病变的最终测量值。
1.5 统计学分析
采用SPSS 17.0统计分析软件。数据分析采用平均值±标准差,不同乳腺癌分子亚型的平均ADC值差异采用单因素方差分析(ANOVA),均数多重比较采用最小显著性差异法(LSD-t)分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 乳腺非特殊型浸润性癌的MRI表现
所有患者经手术常规病理及免疫组化结果证实共158例,均为单侧乳腺发病且为单发病灶,41个均匀强化,90个不均匀强化,27个簇集样强化;DWI呈均匀稍高或高信号52个,不均匀稍高或高信号106个,ADC值为(0.786~1.210)×10-3mm2/s,所有病灶的平均ADC值为0.969×10-3mm2/s。
2.2 生物因子ER、PR、HER-2、Ki-67的表达与ADC值比较
158例乳腺非特殊型浸润性癌病灶中,ER阳性表达率为54.43%,PR阳性表达率为53.16%,HER-2阳性表达率为65.82%,Ki-67阳性表达率为37.97%。ER、PR阴性者ADC值高于阳性者,差异有统计学意义(P<0.01);HER-2阳性者ADC值高于阴性者,差异有统计学意义(P<0.01);Ki-67阳性者ADC值低于阴性者,差异具有统计学意义(P<0.05),见表1。各分子生物学指标及分子亚型ADC值的数据分布特点见图1。

表1 各生物学因子指标的ADC值结果对比Tab. 1 Comparison with other biological prognostic factors in ADC values
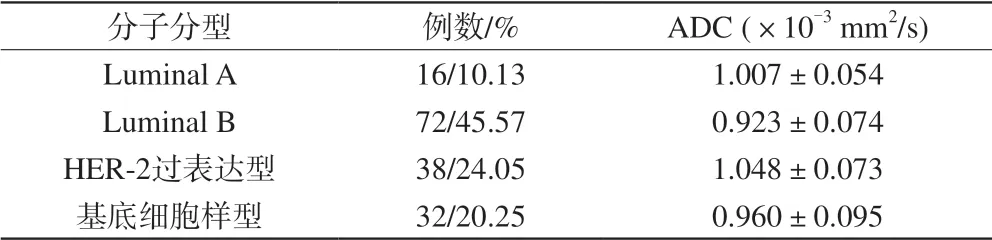
表2 各分子分型的ADC值结果对比Tab. 2 Comparison with other molecular subtypes in ADC values
2.3 不同分子亚型与ADC值比较
乳腺非特殊型浸润性癌不同分子分型的DWI及ADC值、动态增强图像及免疫组化染色图像见图2~5。Luminal A、Luminal B、HER-2过表达型、基底细胞样型的ADC值见表2。依据免疫组化检测结果,Luminal A亚型16例,Luminal B亚型72例,HER-2亚型38例,基底细胞样亚型32例。其中Luminal B亚型约占45.57%,在所有分子亚型中发病率最高。经单因素方差分析,在平均ADC的均数多重比较中,HER-2过表达型与Luminal B、基底细胞亚型之间差异有统计学意义(P均<0.01),以及Luminal B亚型与Luminal A亚型之间差异有统计学意义(P<0.01)。
3 讨论
3.1 ER、PR、HER-2和Ki-67的ADC值特点研究
ER、PR能够调节正常乳腺细胞的分化与增殖,ER和PR同属于核受体超家族中的甾体类激素受体,PR是在雌激素启动下由雌激素和雄激素受体结合诱导的产物,PR的形成直接受ER的影响,PR与ER的表达具有关联性。本研究显示,ER阳性率为54.43%,PR阳性率为53.16%,在数据统计时发现ER阳性时,PR多表现为阳性,比例达97%。乳腺癌细胞表达ER/PR受体说明癌细胞保留雌孕激素依赖性生长的特征,对乳腺癌治疗方案的选择有指导意义,鉴于ER/PR具有一致性,将ER、PR放在一起讨论。本研究结果显示,ER/PR阳性乳腺浸润性导管癌患者的ADC值明显低于ER/PR阴性患者,差异有统计学意义(P<0.01),与既往研究结果一致[8-9]。究其原因,推测与肿瘤灌注通路下降及细胞增殖速度快有关。Ludovini等[10]发现ER/PR阳性表达抑制血管生成导致灌注通路下降,分子扩散相对受限,导致ADC值降低。另有学者强调ER/PR阳性肿瘤的细胞密度高,流体黏度相应增加,这将限制分子的自由扩散,DWI显示为高信号[11]。
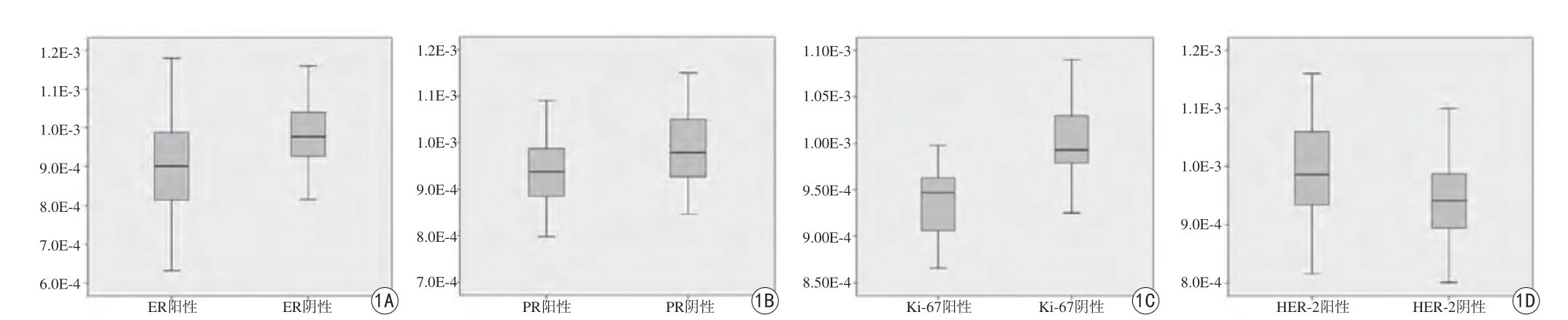
图1 ER、PR、HER-2和Ki-67的数据分布箱式图。A:ER阳性vs ER阴性;B:PR阳性vs PR阴性;C:Ki-67阳性vs Ki-67阴性;D:HER-2阳性vs HER-2阴性Fig. 1 The data distribution box plot of ER, PR, HER-2 and Ki-67. A: ER positive vs ER negative; B: PR positive vs PR negative; C: Ki-67 positive vs Ki-67 negative; D: HER-2 positive vs HER-2 negative.

图2 女,48 岁,Luminal A亚型。A:DWI图,测量癌灶的平均ADC值为1.02×10-3 mm2/s;B:DCE图;C:免疫组化染色(× 200),ER和PR 阳性、HER-2阴性、Ki-67<14%Fig. 2 Female, 48 years old, Luminal A subtype. A: DWI: the average ADC value of the tumor lesion was 1.02×10-3 mm2/s; B: Dynamic contrast enhanced magnetic resonance imaging (DCE-MRI); C: Immunohistochemical staining (× 200), ER and PR positive, HER-2 negative, Ki-67<14%.

图4 女,56岁,HER-2过表达型。A:DWI图,测量癌灶的平均ADC值为1.15×10-3 mm2/s;B:DCE图;C:免疫组化染色(× 200),ER和PR阴性,HER-2强阳性,Ki-67>14% Fig. 4 Female, 56 years old, HER-2-enriched subtype. A: DWI: the average ADC value of the tumor lesion was 1.150×10-3 mm2/s; B: Dynamic contrast enhanced magnetic resonance imaging (DCE-MRI); C: Immunohistochemical staining (× 200), ER and PR negative, HER-2 enriched, Ki-67>14%.

图3 女,68岁,Luminal B 型。A:DWI图,测量癌灶的平均ADC值为0.887×10-3 mm2/s;B:DCE图;C:免疫组化染色(× 200),ER和PR 阳性、HER-2阴性,Ki-67>14% Fig. 3 Female, 68 years old, Luminal B subtype. A: DWI: the average ADC value of the tumor lesion was 0.887×10-3 mm2/s; B: Dynamic contrast enhanced magnetic resonance imaging (DCE-MRI); C: Immunohistochemical staining (× 200), ER and PR positive, HER-2 negative, Ki-67>14%.

图5 女,55 岁,基底细胞样型。A:DWI 图,测量癌灶的平均ADC值0.934×10-3 mm2/s;B:DCE图;C:免疫组化染色(× 200),ER、PR、HER-2均阴性,Ki-67>14% Fig. 5 Female, 55 years old, Basal-like subtype. A: DWI: the average ADC value of the tumor lesion was 0.934×10-3 mm2/s; B: Dynamic contrast enhanced magnetic resonance imaging (DCE-MRI); C: Immunohistochemical staining (× 200), ER and PR negative, HER-2 negative, Ki-67>14%.
本研究中,HER-2阳性肿瘤的平均ADC值显著高于HER-2阴性,差异有统计学意义(P<0.01)。HER-2是一种具有酪氨酸激酶活性的跨细胞膜糖蛋白,在细胞信号传导过程中通过对细胞周期的调控,促进细胞的增殖活性和新生血管生成,抑制细胞凋亡,使肿瘤细胞的侵袭性增加。通常恶性肿瘤的细胞密度均较良性肿瘤及正常组织高,这会降低肿瘤的ADC值,但HER-2基因的表达更容易引起肿瘤血管过度增生[12]。新形成的微脉管系统使血液的微循环增加,血液灌注较高,加上新生血管细胞膜通透性较高,水分子扩散相对容易,ADC值较高[13]。
Ki-67抗原是与细胞增殖相关联的核抗原,而肿瘤细胞的高增殖率促使肿瘤浸润生长和转移,因此Ki-67的表达率与患者的预后具有一定的相关性[14]。本研究中,Ki-67阳性表达的非特殊类型浸润性癌ADC值较Ki-67阴性者低,差异具有统计学意义(P<0.01)。笔者推测ADC值降低与肿瘤细胞的快速增殖有关。尽管ADC值的高低受水分子扩散与血液灌注两方面的影响,如果肿瘤血管增生能力较强,恶性肿瘤新生的毛细血管组织灌注增强,ADC值将会升高[15]。然而一些研究指出恶性肿瘤较良性肿瘤的ADC值低,这预示着肿瘤组织致密的细胞密度影响超过血液灌注增加的影响[16]。因而,推测Ki-67阳性表达的肿瘤细胞增殖能力极强,细胞密度增高是ADC值降低的主要因素。
3.2 各分子分型的ADC值的特点研究
近年来,分子分型分类标准的提出为乳腺癌异质性的研究提供了崭新的视角,为制订个体化治疗方案提供了重要信息。本研究结果显示,Luminal A型平均ADC值较Luminal B型高,差异具有统计学意义(P<0.01)。Luminal A型发病率占乳腺癌的40%~50%,该型肿瘤的细胞增殖率较低,对激素治疗反应良好,预后最佳,是乳腺癌最常见的类型。Luminal B型肿瘤的增殖率较Luminal A型高,预后较差。从分型标准看,Ki-67指数是否大于14%为Luminal A和B分型的最重要因素,Ki-67指数能够反映肿瘤细胞的增殖活性[14]。笔者认为管腔A型较高的ADC值与Ki-67指数(增殖指数)有关。Molinari[17]等研究管腔A型的Ki-67指数较B型低,管腔A型肿瘤增殖率较低,DWI图像为稍低信号,表现为较高的ADC值,与笔者推测一致。
血管再生在肿瘤细胞增殖及转移方面扮演重要的角色。HER-2过表达型乳腺癌血管再生能力较强,恶性程度较高,复发转移较早,预后较差。在本研究比较各亚型乳腺癌的平均ADC值中,发现HER-2过表达型肿瘤的平均ADC值最高,约为(1.048±0.073)×10-3mm2/s,组间多重比较HER-2过表达型的ADC值显著高于Luminal B型和基底细胞样型,差异具有统计学意义(P均<0.01)。笔者认为基于DWI图像较高的ADC值对预测HER-2过表达型乳腺癌具有一定的价值。ADC值的高低受多种因素影响,包括肿瘤血管的高灌注、肿瘤血管壁不稳定及血管源性水肿等利于水分子扩散的因素及细胞密度增大等抑制水分子扩散的反作用因素[18]。HER-2阳性肿瘤血管再生能力较强,组织灌注能力超过肿瘤组织密度的增加,是ADC值升高的决定性因素。Martincich等[19]的研究结果与本研究一致,但他提出HER-2过表达型肿瘤表现出较高的ADC值与其高度侵袭性有关。
基底细胞样型乳腺癌在所有乳腺癌中占比为10%~20%,比重较小。但因其较高的侵袭性和缺乏有效的靶向治疗,该型肿瘤的死亡率较高。本组研究基底细胞样型占比20.13%,发病率与文献报道相符。基底细胞样型的ADC值较管腔B型高,但低于HER-2过表达型,差异无统计学意义(P>0.05)。Youk等[20]将分子亚型分为3种类型(基底细胞样型、ER+/HER-2-和HER++),基底细胞样型乳腺癌的ADC值显著高于其他两型,但本研究中HER-2过表达型的ADC值最高,与本研究结果不一致。造成这种差异的原因可能是分型标准的不同。
本研究仅收集乳腺非特殊型浸润性癌的病例,研究显示各生物学因子指标及分子分型的ADC值具有一定的特征性,比如ER/PR、Ki-67阴性者ADC 值高于阳性者;HER-2阳性组ADC值高于阴性组;HER-2过表达型ADC值最高,基底细胞样型ADC值次之,管腔型最低。这为影像科及临床医师鉴别不同分子亚型及评估乳腺癌预后提供一定的理论依据,但本文乳腺癌各亚型间数据样本小,可能会导致统计效能不足,其结果的验证仍需要进行大样本和前瞻性研究以得到无偏理论。
利益冲突:无。
