热处理时间对CuZnAl催化剂合成C2+OH性能的影响
2019-06-03邓皓月高志华
邓皓月, 高志华, 黄 伟
(太原理工大学 煤科学与技术教育部与山西省重点实验室, 山西 太原 030024)
随着近年来全球能源和环境压力的增大,世界各国都加大了对非石油路线制取液体燃料的研究[1,2]。低碳醇(C2+OH)具有较高的辛烷值,不仅可以作为一种燃料添加剂,更可以直接用来替代传统液体燃料。而中国“富煤、贫油、少气”的能源结构决定了由煤为原料经合成气制备C2+OH研究具有重要的工业应用价值[3-5]。
在合成气制C2+OH反应过程中,高效催化剂的研发是该技术的关键所在。当前,煤基合成气直接制备C2+OH所用的催化剂主要分为四类[6-8]:铑基催化剂、钼基催化剂、改性F-T催化剂和改性甲醇催化剂。其中,铑基催化剂因其独特的对C2+含氧化合物选择性,被认为是合成气制C2+OH的最佳催化剂。但贵金属铑储量太少,成本较高,难以工业化;而在非贵金属催化剂中,钼基催化剂虽然有着较好的抗硫性能,但总体活性不高,反应条件较为苛刻;改性F-T催化剂的F-T组元(Fe、Co、Ni)能增长碳链,提高C2+OH选择性,但生成的产物种类较多,分离困难,稳定性较差;改性甲醇催化剂主要产物还是甲醇,C2+OH产量较低。因此,有必要研究制备高活性和高选择性合成C2+OH的新型廉价催化剂,以便实现合成气制C2+OH技术在工业上的规模化应用。
本课题组针对浆态床的使用特性,提出了一种全新的催化剂制备方法——完全液相法[9]。其创新之处在于催化剂的热处理过程是在浆态床使用的惰性介质中完成的,避免了传统方法制备环境与使用环境不一致导致催化剂分布不均甚至失活的问题。本课题组在前期工作中发现[10],采用完全液相法制备的不含F-T组元或碱金属的CuZnAl催化剂对C2+OH表现出了较好的选择性。但该催化剂的性能对结构非常敏感,导致催化剂的重复性较差,目前,研究尚未澄清催化剂结构与反应性能间的内在关联。喻仕瑞[11]和刘勇军[12]研究均发现,CuZnAl催化剂合成C2+OH需要Cu+-Cu0双活性位。其中,Cu+有助于促进CHxCO-中间体的形成,而Cu0主要是吸附并活化CO分子。只有当Cu+-Cu0的协同作用达到平衡时,才能促进C2+OH的生成。董伟兵[13]发现,催化剂在高压热处理条件下内部物种数量发生了改变,并且生成了常压下没有出现的尖晶石,活性评价结果显示乙醇选择性增加明显,不足之处是催化剂反应活性很低,而且没有对高压热处理条件的影响进行更为深入的分析。因此,为了进一步研究高压下热处理条件对催化剂表面活性物种的影响,强化Cu+-Cu0的协同作用,本实验在课题组前期研究成果上,采用完全液相法制备CuZnAl催化剂,考察高压条件下不同热处理时间对催化剂结构和性能的影响,为后续开发性能优异的催化剂提供借鉴和指导。
1 实验部分
1.1 催化剂的制备
本实验所用试剂如未特殊说明均来自天津市科密欧化学试剂有限公司。
催化剂组分物质的量比为Cu∶Zn∶Al=2∶1∶4。制备过程首先将40.9 g研磨好的异丙醇铝(AR,天津市光复精细化工研究所)溶于70 mL乙醇中,75 ℃下搅拌2 h后在室温下放置1 d。将溶液升温至75 ℃,然后将含有24.2 g硝酸铜、14.9 g硝酸锌、1 g聚乙二醇600(AR,上海市阿拉丁生化科技股份有限公司)和35 mL乙醇的混合溶液用蠕动泵缓慢滴加到上述溶液中,升温至85 ℃,加入180 mL蒸馏水水解1 h。最后加入少量浓硝酸,升温至95 ℃,回流搅拌直至形成凝胶。
将制得的凝胶在25 ℃下老化10 d后分散在250 mL液体石蜡中,置于500 mL高压反应釜内进行热处理。热处理过程:N2流动气氛下,压力保持在1.0 MPa,以1 ℃/min的升温速率从室温升至280 ℃,恒温热处理一定时间以获得不同的浆状催化剂。热处理时间为3.5、7、10.5 h的催化剂分别命名为Cat-3.5、Cat-7和Cat-10.5。
1.2 催化剂的活性评价
将热处理后的催化剂置于500 mL高压反应釜内进行活性评价。固含率为10%,不进行预还原。合成气配比H2/CO(体积比) =2∶1,总流量为150 mL/min。反应器压力维持在4.0 MPa,反应温度为280 ℃,持续反应6 d。反应产物使用海欣GC-950气相色谱仪检测。气相产物中的H2、CO和CO2用TCD检测器检测;烃类、未冷凝的醇类以及二甲醚用FID检测器检测。每24 h收集一次液相产物后再通过FID检测器检测分析。所有活性数据均在反应24 h催化剂性能稳定后测定。CO转化率(xCO)和产物的选择性(si)分别根据以下公式计算:
(1)
(2)
式中,i包括气液相产物中除去CO外的所有含碳物质。
1.3 催化剂的表征
将浆状催化剂用石油醚抽提5 d,以除去残留的液体石蜡。抽提后,自然晾干得到固体催化剂后再进行表征。
XPS使用美国赛默飞公司的ESCALAB 250型X光电子能谱仪测定。真空度为7×10-8Pa,激发源为AlKα(hv= 1486.6 eV, 150 W),以表面污染碳C 1s峰(284.6 eV)作荷电效应校正。
XRD使用日本理学公司的D/MAX-2500型衍射仪测定。辐射源为CuKα,5°-85°扫描,扫描速率8(°)/min。
H2-TPR使用天津先权仪器厂的TP-5080多用吸附仪测定。将50 mg样品在150 ℃下用He吹扫30 min,自然降温至50 ℃。再以5% H2/N2混合气(30 mL/min)为还原气,10 ℃/min的速率升温至500 ℃。用热导检测器检测耗氢量。
NH3-TPD-MS使用天津先权仪器厂的TP-5080多用吸附仪测定。将100 mg样品在280 ℃下用He吹扫30 min后降温至50 ℃,然后吸附纯氨30 min至饱和。再通He吹扫30 min以除去物理吸附的氨。以10 ℃/min的速率升温至800 ℃。氨脱附曲线使用QIC-20型质谱检测器检测。
织构性质使用美国康塔公司的QDS-30型物理吸附仪测定。首先将样品在200 ℃下脱气5 h,然后在液氮中采用N2吸附法测定。比表面积通过BET方法计算,平均孔径和孔容通过BJH方法计算。
2 结果与讨论
2.1 催化剂的活性评价
图1为CuZnAl催化剂CO加氢制C2+OH过程中活性评价数据随反应时间的变化。其中,图1中各点均为评价第2-6 d催化剂性能稳定后每天活性数据的平均值。由图1可知,在热处理时间为3.5 h时,活性随反应时间呈现下降趋势,在反应第5 d后保持相对稳定。而热处理时间较长的两种催化剂CO转化率总体保持稳定。三种催化剂C2+OH在总醇中的占比总体上均随反应时间的延长而下降,在反应到第5 d后保持稳定。通过这两条变化曲线可以看到,所有催化剂的活性在反应前期总体上均随反应时间的延长而下降,但在反应5 d后维持在一个稳定数值。对5 d活性数据进行整体平均,计算得到Cat-3.5、Cat-7和Cat-10.5三种催化剂CO转化率分别为40.9%、38.1%和37.8%,总醇(ROH)选择性分别为21.8%、15.8%和13.0%,均随着热处理时间的延长而下降。而C2+OH在总醇中的质量分数分别为37.8%、65.9%和44.0%。总体来看,Cat-7催化剂性能最佳。
图2为不同热处理时间下催化剂合成C2+OH的产物碳数分布。
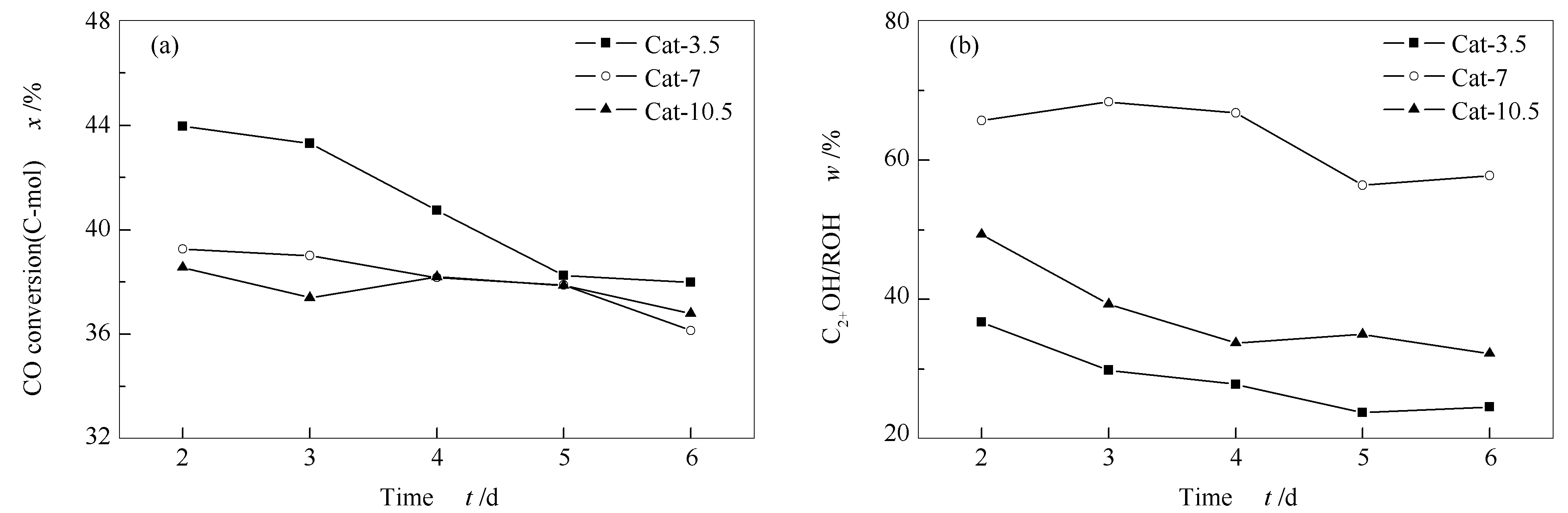
图 1 CuZnAl催化剂在不同热处理时间下的催化性能
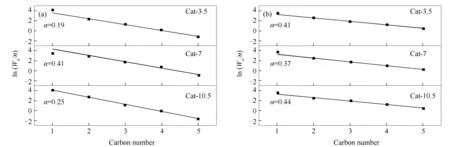
图 2 CuZnAl催化剂在不同热处理时间下产物的碳数分布
由图2可知,所有催化剂的醇类和烃类产物均较好地服从ASF分布[14]。在醇产物分布中,Cat-3.5催化剂和Cat-10.5催化剂的链增长因子(α)仅为0.19和0.25,而Cat-7催化剂的链增长因子达到了0.41,这与Cat-7催化剂中C2+OH占比最高相对应。在烃产物分布中,所有催化剂的链增长因子均在0.40附近。催化剂表面醇、烃产物分布的链增长因子变化趋势存在明显差异,表明反应产物中的醇和烃是在催化剂不同活性位点上生成的[15,16]。由此可见,改变热处理时间主要改变了醇类产物的碳链增长能力,选择适宜的热处理时间更容易形成长链的醇类产物。
2.2 XPS表征
图3为催化剂反应前的Cu 2pXPS谱图。由图3可知,所有催化剂均没有在940-945 eV间检测到明显的shake-up峰,表明催化剂表面没有CuO物种[17]。各催化剂的Cu 2p3/2峰型均不对称,经分峰拟合后存在两个峰。其中,结合能位于932 eV附近的峰表明催化剂中Cu物种是以Cu+和Cu0形式存在[18-20];而结合能位于934.5 eV附近的峰则归属于尖晶石(CuAl2O4)的峰[20, 21]。尖晶石峰面积大小次序为Cat-10.5> Cat-7> Cat-3.5,这表明,催化剂在高压热处理过程中可以生成尖晶石物相,并且该物相数量是随着热处理时间的延长而增多的。文献报道[22]催化剂生成尖晶石后活性位会减少,从而导致催化剂的活性下降,这与催化剂活性评价结果相一致。此外,XPS数据中所有催化剂的Zn 2p3/2结合能均在1021.5 eV附近,对应的Zn LMM谱峰在988 eV附近,表明Zn物种在催化剂中均以ZnO形式存在[23]。可见改变高压热处理的时间并没有对Zn的存在形态产生影响。
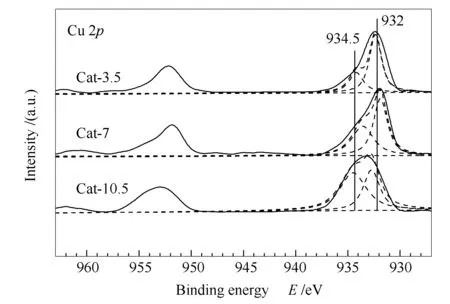
图 3 CuZnAl催化剂在不同热处理时间下的Cu 2pXPS谱图
表1为催化剂表面各物种的元素含量。由表1可知,催化剂表面Cu/Zn和Cu/Al均小于催化剂的投料物质的量比(Cu/Zn/Al=2∶1∶4),这是因为Zn和Al的晶格能大于Cu,更容易在催化剂表面富集。Cat-7催化剂表面Cu/Zn最大,而高的Cu/Zn有利于C2+OH的生成[24]。随着热处理时间的延长,催化剂表面C含量下降明显,说明延长热处理时间能有效抑制液体石蜡在催化剂表面的堆积。
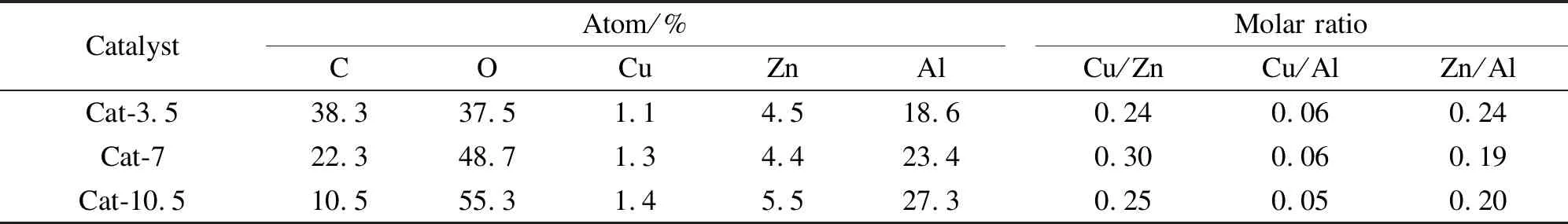
表 1 CuZnAl催化剂在不同热处理时间下的表面元素组成
2.3 XRD表征
图4为催化剂反应前的XRD谱图。由图4可知,所有催化剂均检测到了Cu0的衍射峰。Cat-3.5催化剂中出现了AlOOH和ZnO的衍射峰,没有检测到尖晶石(CuAl2O4)的衍射峰。结合XPS结果,这是由于Cat-3.5催化剂中尖晶石物相数量较少,未达到XRD检测线。Cat-7催化剂和Cat-10.5催化剂中均检测到了尖晶石相的衍射峰,但没有出现AlOOH衍射峰,可见热处理时间的延长使催化剂中Cu、Al物种间的结合力增加,形成了更完整的尖晶石结构,从而一方面导致AlOOH数量减少;另一方面,也提高了AlOOH在体系中的分散度。同时从图4可见,Cat-7和Cat-10.5催化剂中也未检测到ZnO的衍射峰。本课题组前期的实验结果表明[13],尖晶石的存在会使ZnO晶粒变小,分散度增加。本工作实验结果进一步验证了尖晶石的存在有助于提高AlOOH和ZnO的分散度。由谢乐公式计算出三种催化剂的Cu0晶粒粒径分别为24.0、29.5和30.5 nm。这表明随着热处理时间的延长,催化剂中Cu0晶粒逐渐增大,晶型更为完整。文献报道[25-27],Cu0晶粒越小,分散度越大,其对CO分子的吸附活化能力越强。而在CO加氢生成醇类和烃类过程中,催化剂表面存在较高的CO浓度可以促进CHx中间体插入CO生成醇类的前驱体CHxCO-,从而有利于醇类的生成。可见,Cu0晶粒越小,越有利于醇类产物的生成。在活性数据中,总醇选择性随热处理时间的延长而下降,这与上述分析一致。
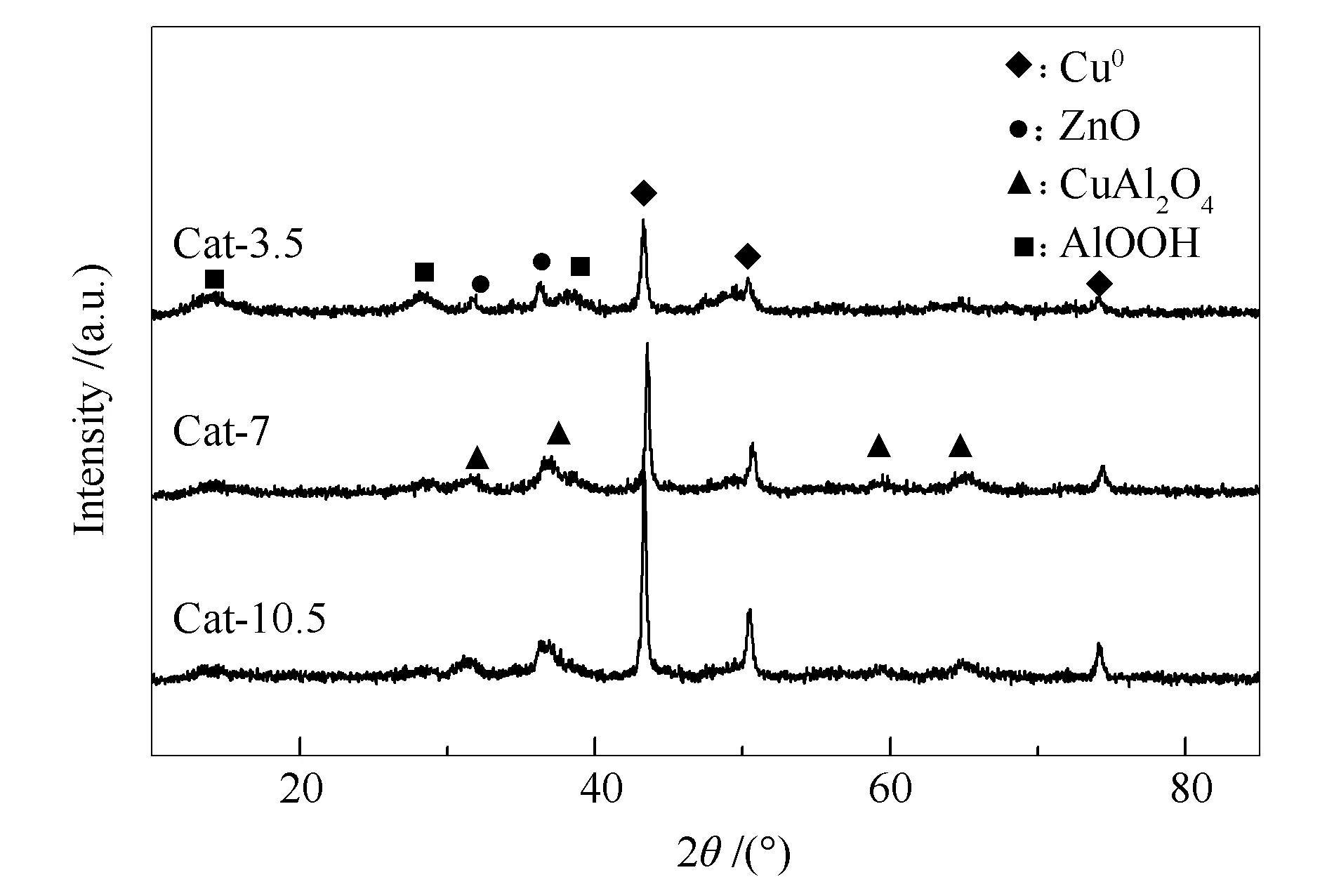
图 4 CuZnAl催化剂在不同热处理时间下的XRD谱图
2.4 H2-TPR表征
图5为催化剂反应前后的H2-TPR谱图。由图5可知,反应前后所有催化剂均出现了两个还原峰。根据前期研究[24]和XPS结果,温度较低的还原峰归属为此催化剂中晶粒粒径较小Cu+物种的还原;温度较高的还原峰归属为此催化剂中晶粒粒径较大Cu+物种的还原。反应前后,不同催化剂各还原峰的中心温度与峰面积也不相同。Cat-7催化剂反应前的高温还原峰中心温度较高,峰面积最大,在反应后下降幅度不大,表明合适的热处理时间会使催化剂中存在较多晶粒粒径大的,在反应过程中相对难被还原的Cu+。需要指出的是,Cat-10.5催化剂反应后的还原峰面积变大,这可能是由于反应过程中水煤气变换反应产生的CO2、H2O等氧化物使Cu0氧化形成Cu+,类似现象在合成甲醇的文献中也有报道[28]。但是仅有Cat-10.5催化剂出现此现象的原因目前还没有明确结论。
前期采用完全液相法制备催化剂时,由于在常压热处理过程中液体石蜡受热分解产物会将大部分Cu氧化物还原为Cu0,导致催化剂中Cu+较少[29]。研究发现,CuZnAl催化剂中Cu+-Cu0是合成C2+OH催化剂的双活性中心。其中,Cu+有助于促进CHxCO-中间体的形成,而Cu0主要起到吸附活化CO分子的作用[11,12]。当催化剂中存在适量比例的Cu+和Cu0时,有利于Cu+-Cu0的协同作用的发挥,从而促进C2+OH的生成。本研究中高压下热处理适宜时间(7 h),有利于催化剂中形成较多难被还原的Cu+,使Cu+和Cu0的量达到平衡,进而提高了C2+OH在总醇中的占比。
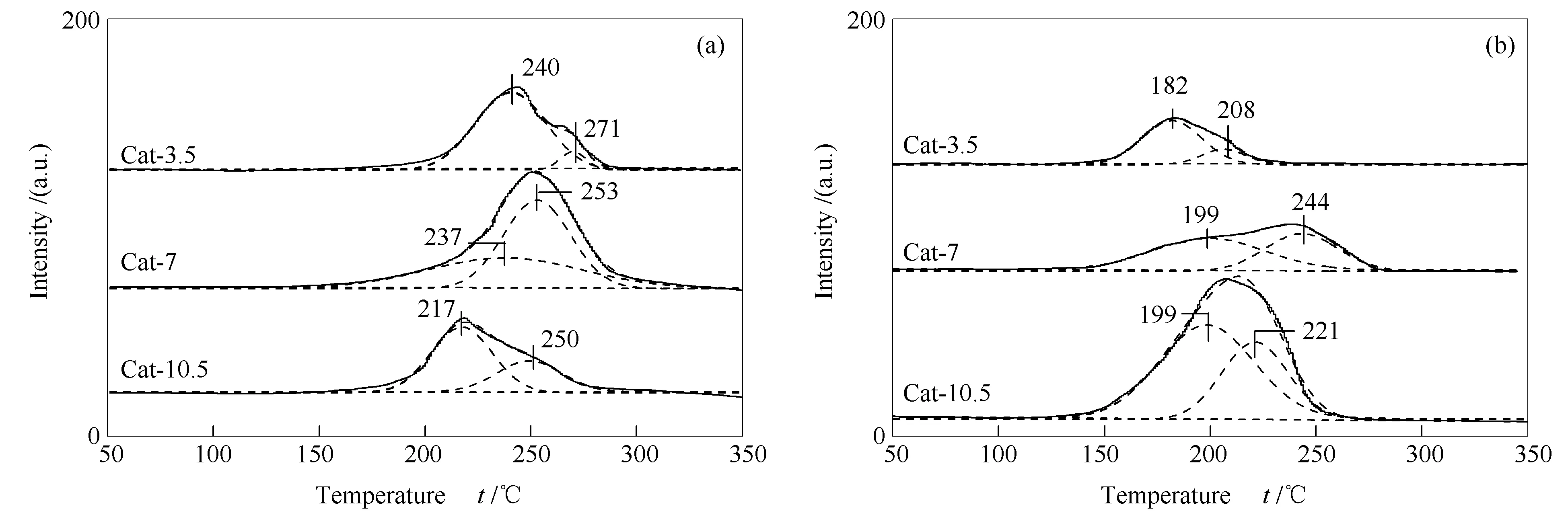
图 5 CuZnAl催化剂在不同热处理时间下的H2-TPR谱图
2.5 NH3-TPD表征
图6为催化剂反应前的NH3-TPD-MS谱图。由图6可知,所有催化剂均检测到了两个NH3脱附峰。其中,在150 ℃附近的脱附峰对应于催化剂表面的弱酸位;在550 ℃附近的脱附峰对应于催化剂表面的中强酸位。随着热处理时间的延长,催化剂表面弱酸位和中强酸位脱附峰面积均减小,表明延长热处理时间会减小催化剂的表面弱酸量与中强酸量。通过对不同酸性位的脱附峰面积进行积分计算,三种催化剂表面弱酸量在总酸量中的占比分别为0.33、0.27和0.32,Cat-7催化剂的表面弱酸量占比最小。Liu等[23]认为,催化剂中较多的弱酸量有利于C2+OH的生成。吕晓东[30]认为,表面弱酸位更有利于二甲醚的生成。而董伟兵[13]却发现,适当的弱酸量与中强酸量比例才有利于C2+OH的生成。可见,虽然各研究者在制备C2+OH时都选择CuZnAl催化剂,但由于制备方法、处理条件等的差异,使得结果不尽相同。而本研究发现催化剂中较小的弱酸占比有利于C2+OH的生成。
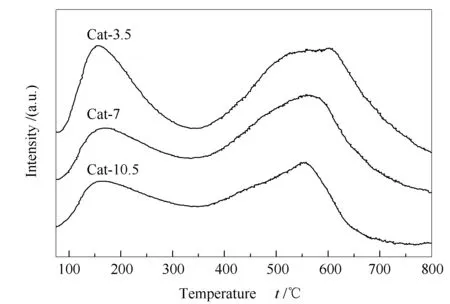
图 6 CuZnAl催化剂在不同热处理时间下的NH3-TPD-MS谱图
2.6 织构参数
表2为催化剂反应前后的织构参数。反应前,随着热处理时间的延长,催化剂的比表面积逐渐减小,孔容和孔径逐渐增大。经分析,高温高压条件下较长的热处理时间会使催化剂中活性组分团聚,晶粒粒径增大,从而导致比表面积减小;而孔容和孔径逐渐增大是因为长的热处理时间使催化剂孔道中的液体石蜡在N2流动气氛下更多地被带出,形成了更大的孔容和孔径。相比其他两种催化剂,Cat-3.5催化剂反应后的比表面积和孔容增大,这是由于其热处理时间较短,催化剂孔道中残留有较多液体石蜡,经过反应过程,残留的液体石蜡逐渐解吸导致催化剂比表面积和孔容增大[31,32],这与XPS结果中Cat-3.5催化剂的表面碳含量最大相对应。Cat-7和Cat-10.5催化剂反应后比表面积和孔容均有所减小则可能是催化剂孔道在反应过程中被长链烃等产物堵塞所致。一般来说,大的孔容能为碳链增长提供足够的空间,从而生成长碳链产物[33]。而较大孔径有利于H2和CO在催化剂孔道中扩散,形成限域效应促进C2+OH的生成[34]。
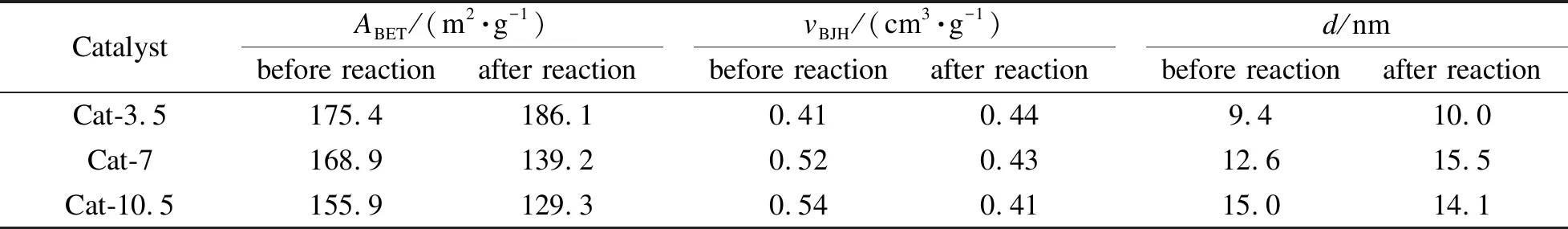
表 2 CuZnAl催化剂在不同热处理时间下的织构参数
notes:ABET: BET surface area;vBJH: pore volume;d: average pore diameter
3 结 论
采用完全液相法制得的CuZnAl催化剂,不同热处理时间主要对催化剂在CO加氢合成C2+OH反应过程中的醇类产物生成产生一定影响。通过表征结果发现,热处理时间为7 h时,催化剂中存在较多难被还原的Cu+,此时Cu+-Cu0活性位点间的协同作用较好,C2+OH在总醇中的占比最高。而随着热处理时间的延长,催化剂中Cu、Al物种之间结合力增强,尖晶石的量随之增多, CO转化率下降。同时,热处理时间的延长也使催化剂表面酸量减少,孔容和孔径增大,而催化剂表面较小的弱酸占比、大的孔容和孔径均有利于C2+OH的生成。
