黄芪甲苷对扑热息痛诱导肝损伤小鼠炎症因子表达的影响
2019-06-02孙克诚何亚兰朱耀辉张文雪
孙克诚, 何亚兰, 张 乐, 朱耀辉, 张文雪, 陈 超, 刘 畅, 李 磊
(安徽科技学院 动物科学学院,安徽 凤阳 233100)
肝脏是人体最大的解毒和代谢器官,易受到各种药物及代谢产物的影响进而导致肝损伤[1]。药物性肝损伤(DILI)是指在使用治疗剂量药物时,由于特殊机体对药物的敏感性增强或耐受性降低[2-3],或是由于服用保健品,膳食补充剂等及其代谢产物,所致肝细胞损伤坏死,肝脏内酶表达量异常及引起的其它相关临床症状[4-5]。据世界卫生组织统计,DILI已上升为全球死亡原因的第5位,严重影响人类健康。近年来相当数量的新药在投放市场后短期内由于其肝毒性而撤回[6-8]。DILI可表现为各类急慢性肝脏疾病,以急性肝损伤最为普遍。DILI是一个多因素多机制的复杂过程,其发病机制不仅与氧化应激有关,炎症反应在其发生、发展进程及预后中也起到重要作用[9]。
扑热息痛也称对乙酰氨基酚(APAP),是一种常用的解热镇痛药,广泛用于临床,治疗剂量范围内无毒性[10],但长期或过量服用则会造成严重的DILI[11-14],国内外常见急性肝损伤成因多为APAP的过量使用[15]。目前普遍认为,氧化应激以及随后的炎症反应在APAP诱导的急性肝损伤过程中起着重要作用[16]。
黄芪甲苷(AS-IV)为中药黄芪的主要活性成分之一,具有提高免疫力、抗自由基、抗炎、抗氧化、降低血糖与心血管保护等药理作用[17-20]。本试验通过建立APAP急性药物性肝损伤模型,检测小鼠血清炎症因子水平,探讨AS-IV对APAP诱导急性肝损伤小鼠炎症因子表达的影响,为将来进一步研究APAP诱导肝损伤机制,研发新型预防治疗肝损伤药物提供借鉴。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级ICR小鼠40只,雌雄各半,体重20±2 g,购自于南京青龙山动物繁殖场动物合格证编号NO.201710241,试验期间自由摄食、饮水。
1.1.2 实验试剂 AS-IV、APAP均购于上海阿拉丁生化科技股份有限公司;羧甲基纤维素钠购于国药集团化学试剂有限公司;小鼠TNF-α、IL-1β、IL-6 ELISA试剂盒购于欣博盛生物科技有限公司。
1.1.3 实验器材 电热恒温培育箱购于上海一恒科学仪器有限公司;1510酶标仪和高速冷冻离心机均购于赛默飞世尔(上海)仪器有限公司;高速组织研磨器套装购于天根生化科技(北京)有限公司。
1.2 方法
1.2.1 分组与给药 取40只清洁级ICR小鼠适应性喂养1周,随机分为空白对照组、模型组(400 mg/kg)、AS-IV 20 mg/kg组、AS-IV 40 mg/kg组。空白对照组和模型组每日给予0.5%羧甲基纤维素钠,给药组分别给予相应剂量的AS-IV,连续灌胃1周。末次给药后2 h后,除空白对照组灌胃生理盐水外,其余组均灌胃400 mg/kg APAP,建立急性肝损伤模型。
1.2.2 小鼠血清炎症因子的测定 采用ELISA法检测小鼠血清中TNF-α、IL-1β、IL-6炎症因子水平。
1.2.3 肝组织病理学检查 摘取小鼠左肝叶片,经过4%甲醛溶液固定,乙醇脱水后石蜡包埋切片,将切片放入二甲苯中脱蜡30 min,用浓度由高至低的酒精水化切片,随后蒸馏水冲洗1 min,将切片放入苏木精中染色5 min,流水稍洗去苏木精后采用1%的盐酸乙醇溶液进行分化和漂洗,促蓝液返蓝,返蓝后依次放入75%、85%酒精中各2 min,0.5%伊红乙醇溶液复染1 min后依次放入95%、100%酒精中各10 min进行脱水,加入二甲苯中保持10 min,滴加中性树胶封片,观察肝组织切片的病理变化。
1.3 数据统计
实验数据以平均值±标准误表示,采用SPSS 20.0软件进行处理,采用单因素方差分析,多重比较采用LSD检验,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 AS-IV对APAP致肝损伤小鼠肝组织病理学影响
空白对照组小鼠肝细胞排列整齐,肝细胞以中央静脉为中心呈放射性排列,肝窦清晰,肝索分界明显,肝小叶结构完整(图1A)。APAP使小鼠肝细胞出现空泡和灶性坏死,肝索边界不清晰(图1B),表明急性肝损伤模型建立成功。给予AS-IV治疗后可改善APAP引起的小鼠肝组织细胞形态变化(图1C、图1D)。

图1 AS-IV对APAP致急性肝损伤小鼠肝组织病理学影响(×400)
2.2 AS-IV对小鼠血清TNF-α表达的影响
如图2所示,模型组TNF-α水平对比空白对照组明显上升(P<0.01)。给药组小鼠血清TNF-α水平均低于模型组,且差异具有统计学意义(P<0.05)。其中AS-IV 40 mg/kg组小鼠血清TNF-α水平降低极显著(P<0.01),表明AS-IV对APAP诱导的急性肝损伤小鼠TNF-α表达有显著影响。

图2 AS-IV对小鼠血清TNF-α表达的影响
2.3 AS-IV对小鼠血清IL-1β表达的影响
如图3所示,空白对照组、模型组与给药组相互比较显示,灌胃APAP的小鼠其血清中IL-1β表达量极显著升高(P<0.01),给予AS-IV治疗的小鼠血清中IL-1β表达量均极显著低于模型组,结果显示,AS-IV能极显著降低急性肝损伤小鼠IL-1β表达量。
2.4 AS-IV对小鼠血清IL-6表达的影响
图4表明空白对照组,模型组与给药组间小鼠血清中IL-6表达量的差异。对比空白组,模型组小鼠血清IL-6表达量极显著上升(P<0.01),给药组中小鼠IL-6表达量均有显著下降(P<0.05),AS-IV 40 mg/kg组降低极显著(P<0.01)。图4显示,急性肝损伤会使小鼠IL-6表达量显著上升,AS-IV能显著降低因急性肝损伤导致小鼠IL-6表达量异常升高。
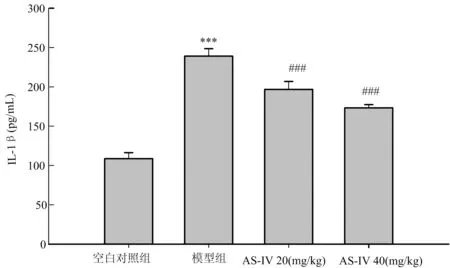
图3 AS-IV对小鼠血清IL-1β表达的影响

图4 AS-IV对小鼠血清IL-1β表达的影响
3 结论与讨论
AS-IV是中草药黄芪的主要活性成分,常用于治疗糖尿病,改善免疫系统。目前越来越多的研究表明AS-IV可用于治疗器官纤维化、炎性损伤、氧化损伤[19-21]。
氧化应激是APAP诱导肝损伤的主要机制[22]。当机体摄入过量的APAP时,其代谢过程中产生的大量N-乙酰基-对苯醌亚胺超过了谷胱甘肽(GSH)的解毒能力,大量消耗肝脏内GSH,破坏氧化还原过程,导致氧化应激[15]。过度的氧化应激会导致肝组织炎症反应[23],过量的活性氧刺激单核细胞与巨噬细胞,促进各种促炎细胞因子的合成和释放。其中TNF-α、IL-1β是早期炎症反应中变化最显著的炎症因子,参与多种肝脏疾病进程[24];IL-6主要由单核巨噬细胞、血管内皮细胞、成纤维细胞产生,研究表明IL-6在多种肝损伤进程具重要作用[25]。炎症反应参与APAP诱导的急性肝损伤发生、发展过程,肝损伤严重程度也取决于炎症因子的释放程度[26-27]。本实验通过ELISA法检测血清中TNF-α、IL-1β、IL-6表达量以判断肝损伤发生、发展进程及严重程度,通过给予AS-IV治疗,观察TNF-α、IL-1β、IL-6表达量判断AS-IV是否具有抗炎和治疗APAP诱导肝损伤作用。结果显示AS-IV(20、40 mg/kg)能显著降低APAP诱导肝损伤小鼠TNF-α、IL-1β、IL-6表达量,给予AS-IV治疗的肝损伤小鼠肝细胞形态有明显改善。
APAP诱导肝损伤过程是一个多因素多机制的复杂过程,多种细胞和通路参与其中,炎症因子是其中一个重要参与者。本研究讨论了炎症因子在APAP诱导小鼠肝损伤的含量变化,实验结果表明AS-IV可显著下调APAP诱导肝损伤小鼠血清中TNF-α、IL-1β、IL-6表达量,可明显改善APAP诱导肝损伤肝细胞形态,表明AS-IV具抗炎与治疗APAP诱导肝损伤作用。
