解耦联蛋白3基因-55C/T多态性与2型糖尿病血糖控制的相关性
2019-06-01段英连王晓成邵晋康杨艳兰马婵娟
周 晶,郑 银,2,段英连,王晓成,邵晋康,杨艳兰,秦 洁,马婵娟,4*
(1山西医科大学附属人民医院内分泌科,太原 030012;2天津医科大学内分泌研究所;3山西医科大学附属人民医院病案统计科;4山西医科大学附属人民医院肾内科;*通讯作者,E-mail:mcj5670206@163.com)
2型糖尿病(type 2 diabetes mellitus,T2DM)是以慢性高血糖为特征的一类慢性代谢性疾病,存在胰岛素分泌和/或胰岛素作用的缺陷。其由遗传和环境因素相互作用而引起[1]。由于糖尿病的发病存在由多基因介入与机体环境因素交互作用产生的异质性,因此对遗传相关基因的研究成为热点。迄今为止,已发现多个基因多态性位点与T2DM密切相关[2,3]。解耦联蛋白3(uncoupling protein 3,UCP3)是主要在骨骼肌表达的线粒体阴离子转运蛋白,它可以通过使氧化磷酸化解耦联减少ATP和活性氧(reactive oxygen species,ROS)的生成[4],也可以通过转运脂肪酸阴离子/转运非酯化脂肪酸出线粒体内膜减少脂质过氧化损伤作用并参与脂肪酸代谢[5,6]。骨骼肌是体内胰岛素刺激的葡萄糖利用的主要场所,占全身葡萄糖利用的75%,故骨骼肌是重要的外周胰岛素抵抗器官,作为目前已知的在骨骼肌唯一表达的解耦联蛋白,UCP3在能量代谢及糖代谢中的作用近年来备受关注。UCP3基因定位于染色体11q13,长8.7 kb。UCP3基因启动子区-55 bp处、即TATA盒上游6 bp处存在C→T的变异[7]。国内外有多项研究报道该多态性与体脂代谢、肥胖及2型糖尿病发病的相关性,但是,由于各项研究中受试人群的种族、性别及样本量存在差异,因此报道的结果不尽相同[8-15]。且较少有研究关注UCP3基因多态性与2型糖尿病血糖控制水平的相关性。因此,本研究以我国北方汉族T2DM患者及健康对照人群为研究对象,探讨UCP3-55C/T多态性与T2DM患者血糖控制水平的相关性。
1 对象及方法
1.1 对象
选取2018-03~2018-07入我院就诊的T2DM患者(T2DM组)103例,男60例,女43例,平均年龄(59.23±11.24)岁,病程1月-27年。选取同期于我院体检中心体检的非T2DM对照组(NC组)110例,男52例,女58例,平均年龄(52.27±10.51)岁,受试者间无亲缘关系。T2DM诊断依据1999年WHO制定的诊断标准:糖尿病症状+随机血糖≥11.1 mmol/L或空腹血浆葡萄糖(FBG)≥7.0 mmol/L和(或)口服糖耐量实验(OGTT)2 h血糖≥11.1 mmol/L。糖尿病症状包括:多尿、多饮、多食、体质量明显下降。根据病史、家族史除外1型糖尿病、继发性糖尿病及遗传性缺陷导致的糖尿病。排除急性感染、应激状态及严重肝肾损害及心功能不全。该项研究经医院伦理委员会批准,所有受试者均签署书面知情同意书。
1.2 方法
1.2.1 人体测量学指标的测量 清晨空腹状态下,排空大小便,脱鞋并去外衣,测身高、体质量、腰围,并测量血压(收缩压SBP,舒张压DBP),计算BMI。BMI=体质量(kg)/身高的平方(m2)。腰围的测量即绕脐水平一周的长度。
1.2.2 生化指标及血清胰岛素检测 研究对象隔夜禁食12 h,于次日清晨抽取空腹静脉血,测定空腹血糖(FBG)、空腹胰岛素(FINS)、糖化血红蛋白(HbA1c)及血脂。采用葡萄糖氧化酶法测定血浆葡萄糖,甘油三酯(TG)及总胆固醇(TC)采用酶法测定,高密度脂蛋白胆固醇(HDL-C)及低密度脂蛋白胆固醇(LDL-C)采用硫酸葡聚糖-锰沉淀法及公式计算。利用高效液相离子层析法检测HbA1c。化学发光法测定FINS,试剂盒购于美国贝克曼公司。采用稳态模型评估的胰岛素抵抗指数(HOMA-IR)评价受试者的胰岛素抵抗程度(HOMA-IR=空腹胰岛素×空腹血糖/22.5)。
1.2.3 血清脂联素(adiponectin)的测定 研究对象均隔夜禁食12 h,于次日清晨抽取空腹静脉血约3 ml,离心并分离血清,冷藏于-80 ℃待测脂联素。采用ELISA方法测定,试剂盒购自美国R&D SYSTEMS公司。
1.2.4 UCP3-55C/T基因型测定 ①DNA的提取:采用常规酚/氯仿法提取DNA(全血DNA提取试剂盒由美国Omega Bio-Tek公司提供)。②基因型测定:采用聚合酶链反应-直接测序法测定。具体步骤如下:以100 ng DNA为模板在总反应体系30 μl行PCR扩增,上游引物为5′-TCTCTGAAAGCCTCCAA-3′,下游引物5′-GTGCCCAGCCTATCGTG-3′(由北京六合华大基因科技有限公司合成),其中10×PCR缓冲液3 μl,dNTP Mixture 4 μl,上下游引物各1 μl,Ex Taq酶1 μl;PCR反应条件:96 ℃预变性5 min,96 ℃变性20 s,52 ℃退火20 s,72 ℃延伸30 s,共进行35个循环,末次循环后72 ℃延伸5 min至4 ℃保存。PCR产物纯化:按照Millipore公司96纯化板操作流程操作:向96孔纯化板中加入100 μl ddH2O,取出PCR产物至96纯化板中室温静置10 min,真空抽滤泵抽10 min至抽干,向96孔纯化板中加入40 μl ddH2O,室温溶解10 min,取出对应的孔中的纯化产物至另一96孔PCR板中。PCR产物测序:测序反应体系为:2 μl Mix(Bigdye3.1、5×测序缓冲液、H2O),2 μl纯化后的PCR产物,1 μl引物(5 mmol/L)。循环条件及反应程序为:95 ℃ 15 s→(95 ℃ 15 s →50 ℃ 5 s→60 ℃ 90 s)×35个循环→终止反应(72 ℃ 5 min)。
1.3 统计学分析
2 结果
2.1 两组一般资料及代谢性指标比较
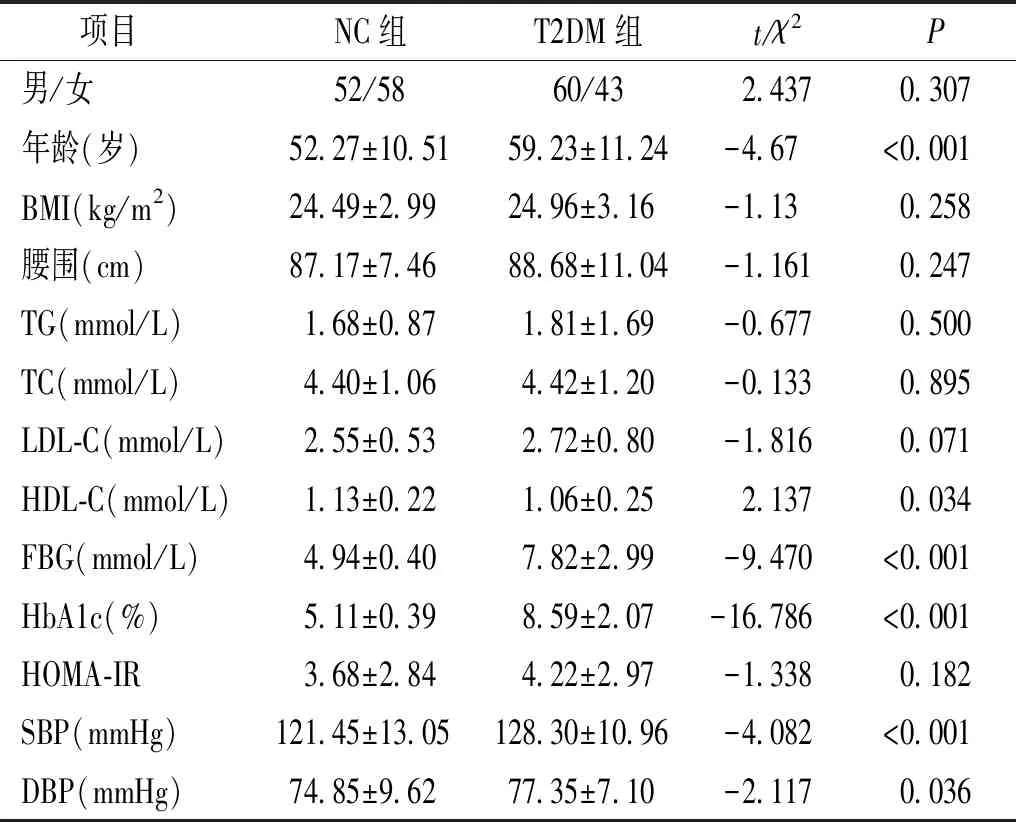
T2DM组的年龄、FBG、HbA1c、SBP、DBP明显高于NC组,HDL-C低于NC组,差异有统计学意义(均P<0.05,见表1)。
2.2 两组UCP3-55C/T基因型及等位基因频率比较
经检验,UCP3-55C/T基因型频率在各组分布符合Hardy-Weinberg平衡,数据来自同一孟德尔群体,具有较好的群体代表性(NC组:χ2=0.227,P=0.633;T2DM组:χ2=0.211,P=0.646)。T2DM组与NC组的基因型频率和等位基因频率分布见表2。NC组基因型频率:CC、CT、TT分别为38.18%,45.45%,16.36%;等位基因频率:C为60.91%,T为39.09%。T2DM组基因型频率:CC、CT、TT分别为42.71%,43.69%,13.59%;等位基因频率:C为64.56%,T为35.44%。两组间三种基因型及等位基因频率分布差异无统计学意义(均P>0.05,见表2)。
表1 两组临床资料及生化指标比较
Table 1 Comparison of clinical data and biochemical indexes between two groups
项目NC组T2DM组 t/χ2 P男/女52/5860/43 2.437 0.307年龄(岁)52.27±10.5159.23±11.24-4.67<0.001BMI(kg/m2)24.49±2.99 24.96±3.16 -1.130.258腰围(cm)87.17±7.46 88.68±11.04-1.1610.247TG(mmol/L)1.68±0.871.81±1.69-0.6770.500TC(mmol/L)4.40±1.064.42±1.20-0.1330.895LDL-C(mmol/L)2.55±0.532.72±0.80-1.8160.071HDL-C(mmol/L)1.13±0.221.06±0.252.1370.034FBG(mmol/L)4.94±0.407.82±2.99-9.470<0.001HbA1c(%)5.11±0.398.59±2.07-16.786<0.001HOMA-IR3.68±2.844.22±2.97-1.3380.182SBP(mmHg)121.45±13.05 128.30±10.96 -4.082<0.001DBP(mmHg)74.85±9.62 77.35±7.10 -2.1170.036
表2 两组UCP3-55 C/T基因型及等位基因频率分布例(%)
Table 2 Distribution of UCP3-55 C/T genotype and allele frequency in two groupscases(%)

组别n基因型CCCTTTχ2P等位基因CTχ2P NC11042(38.18)50(45.45)18(16.36)0.580.748134(60.91)86(39.09)0.6070.436 T2DM10344(42.71)45(43.69)14(13.59)133(64.56)73(35.44)
2.3 T2DM组与NC组各组不同基因型临床资料比较
按UCP3-55 CC、CT、TT将NC组与T2DM组各分为三个亚组,在NC组中,各亚组BMI、LDL-C差异有统计学意义(P<0.001),TT基因型患者的BMI显著低于CC基因型患者(P<0.001),而LDL-C在TT基因型患者中高于CC基因型患者(P<0.001)。2型糖尿病组中,各亚组患者病程及用药无明显差异。各亚组LDL-C差异有统计学意义(P<0.05)。其中TT基因型患者的LDL-C高于CC基因型患者。在T2DM组及NC组中,与CC基因型者相比,TT基因型患者的HbA1c有降低趋势,但差异无统计学意义(见表3)。
2.4 UCP3-55C/T基因型及等位基因在不同HbA1C分组中的分布
进一步将T2DM患者按照糖化血红蛋白水平分为3个亚组(<7%,7%-9%,≥9%),比较各亚组基因型及等位基因的分布频率。三亚组间三种基因型频率分布有统计学意义(P=0.024),TT基因型在HbA1C≥9%的患者中所占比例明显低于CC基因型,差异具有统计学意义(P=0.043)。等位基因T在HbA1C≥9%的患者中所占比例低于等位基因C(P=0.057,见表4)。
2.5 血清脂联素与UCP3-55C/T基因型之间的关系
本研究进一步检测了T2DM患者的血清脂联素
表3 各组不同基因型临床资料比较
Table 3 Comparison of clinical data among different genotypes in two groups

项目NC组T2DM组CCCTTTCCCTTT BMI(kg/m2)25.79±2.99 24.11±2.95 22.49±1.40∗∗##24.63±3.18 24.99±3.16 25.89±3.07 腰围(cm)87.12±7.66 87.20±7.67 87.22±6.78 87.80±10.7787.86±11.4194.11±9.79 TG(mmol/L)1.66±0.891.60±0.841.93±0.922.07±2.291.71±1.771.35±0.54 TC(mmol/L)4.32±0.944.42±1.034.51±1.414.51±1.254.14±1.075.01±1.29 LDL-C(mmol/L)2.33±0.362.60±0.65 2.88±0.25∗∗##2.74±0.772.56±0.75 3.17±0.92∗ HDL-C(mmol/L)1.15±0.241.15±0.211.07±0.171.10±0.281.00±0.211.17±0.21 FBG(mmol/L)4.93±0.414.92±0.404.99±0.398.46±3.557.53±2.616.68±1.46 HbA1c(%)5.05±0.335.13±0.384.97±0.348.56±2.118.89±1.957.69±2.16 HOMA-IR3.85±2.233.30±3.194.35±3.024.16±2.614.25±3.524.36±2.29 SBP(mmHg)121.45±14.66 121.32±11.25 121.86±14.51 128.02±11.54 127.89±11.47 130.50±7.12 DBP(mmHg)75.17±10.7774.32±8.38 75.71±10.5078.68±7.14 76.18±7.47 76.93±5.20 病程(年)---10.00(3.00,18.75)12.00(3.00,20.00)10.00(7.50,14.00)
同组内与CC及CT型比较,*P<0.05,**P<0.001;与CC组比较,##P<0.001
表4 UCP3-55C/T基因型及等位基因在不同HbA1C分组中的分布例(%)
Table 4 Distribution of UCP3-55C/T genotype and allele frequency in different HbA1c groupscases(%)

UCP3-55C/THbA1c<7%7%-9%≥9%χ2P 基因型11.2170.024 CC15(55.56)9(27.27)20(46.51) CT7(25.93)17(51.52)21(48.84) TT5(18.52)7(21.21)2(4.65)6.282∗0.043∗ 等位基因5.730.057 C37(65.8)35(53.0)61(70.9) T17(31.5)31(47.0)25(29.1)
*表示与CC组比较
水平,在CC、CT、TT各基因型中脂联素水平分别为:2 952.10(1 784.40,4 923.40)pg/ml,3 520.30(2 699.30,6 682.10)pg/ml,5 136.10(2 814.38,13 347.83)pg/ml,携带T等位基因(CT+TT)的患者血清脂联素水平高于CC基因型患者。行Spearman秩相关,结果显示UCP3-55C/T基因型与患者脂联素水平呈正相关(r=0.256,P=0.026),TT基因型患者血清脂联素水平明显升高。
3 讨论
UCP3是解耦联蛋白超家族的成员之一,该家族是一类位于线粒体内膜上的质子转运蛋白。UCP作为线粒体内膜的质子载体,能将线粒体内膜外侧的H+运回内侧,降低在物质氧化过程中H+形成的膜两侧的电化学梯度,从而将线粒体内膜上的电子传递过程和ATP的合成过程解耦联,使内膜上的电能以热能的形式释放,导致能量消耗和产热增多。哺乳动物体内已知的UCPs包括UCP1-5。UCPs的共同特征是其单体由大约300个氨基酸组成,每个单体均具有6个穿膜结构域,UCPs只有二聚体才有转运功能,UCPs家族每个成员均有3个由100个氨基酸组成的重复序列。UCP1是最早发现的解耦联蛋白,它仅分布在棕色脂肪中,其主要功能是产热。UCP2对神经系统、免疫系统及胰岛β细胞的功能具有重要的作用。UCP3是UCPs中唯一在骨骼肌线粒体内表达的蛋白质,它主要在骨骼肌表达,在棕色脂肪组织和心肌中也有少量分布[16]。骨骼肌的能量代谢是人体基础代谢率的主要决定因素,UCP3在骨骼肌特异性表达可能对人体的能量消耗具有非常重要的意义。UCP3基因启动子区-55 bp处存在C→T变异,越来越多的研究发现UCP3基因的遗传多态性与代谢、肥胖相关表型变化及T2DM发病有着不同程度的关联性。目前对UCP3-55C/T基因多态性与肥胖及T2DM发病的相关性研究结果不尽一致,有的研究认为T基因携带者与C基因携带者相比BMI更低,T2DM的发病风险低[9,10,13,14],有的研究则发现TT基因型受试者的BMI高于CC及CT基因型[8],而有的研究则认为该多态性位点与体质量无明显相关[8,12]。我国上海地区的研究显示UCP3-55C/T基因多态性与肥胖不相关,但TT基因型者具有更高的静息代谢率[17]。总之,目前国内外对UCP3-55C/T基因多态性与肥胖、T2DM的相关性尚无定论,且以往国内外研究关注的均为UCP3基因多态性与肥胖或T2DM发病风险的相关性,较少关注UCP3基因多态性与T2DM血糖控制水平的相关性。因此本研究通过观察T2DM患者及健康对照人群中UCP3-55C/T不同基因型空腹血糖及糖化血红蛋白水平,探讨UCP3-55C/T多态性与T2DM患者血糖控制水平的相关性。
研究表明,在Pima印第安人中,携带55T等位基因的受试者骨骼肌UCP3 mRNA表达高于携带C等位基因者[7]。研究发现,过表达UCP3的小鼠,空腹血糖和胰岛素水平降低,糖耐量增加[18]。对60倍过表达UCP3的小鼠研究发现,高脂饮食后,UCP3可通过促进脂肪酸代谢,降低膜与胞质二脂酰甘油的比例,PKCθ激活减少,IRS-1丝氨酸磷酸化水平降低,酪氨酸磷酸化水平增加,胰岛素信号通路增强,从而保护机体不发生高脂诱导的胰岛素抵抗[15]。特异性在酵解型骨骼肌2倍过表达UCP3的雌性小鼠经过14周高脂饮食后,其胰岛素敏感性高于对照小鼠[19,20]。UCP3可促进骨骼肌细胞GLUT4转位,促进葡萄糖摄取[21]。我们的研究结果显示在健康对照及T2DM患者中,TT基因型者的糖化血红蛋白较CC基因型者低;将T2DM患者根据糖化血红蛋白水平分组后,发现在糖化血红蛋白大于9.0%的患者中TT基因型所占的比例降低。因此我们推测TT基因型的患者骨骼肌UCP3表达量增加,骨骼肌葡萄糖摄取增加,从而使血糖水平下降。但我们的结果显示,在T2DM组中,TT基因型患者空腹血糖较CC基因型患者低,但差异无统计学意义。在健康对照组中,各基因型的空腹血糖未见明显差异。故我们猜测TT基因型患者糖化血红蛋白的降低可能主要是由于骨骼肌UCP3表达量增加,促使骨骼肌葡萄糖摄取增加,从而使餐后血糖下降所致。遗憾的是,本次研究未能完善葡萄糖耐量试验,缺乏餐后血糖的数据,且HOMA-IR在各组间未见明显差异,这与我们设想TT基因型胰岛素敏感性增加不符,分析原因可能如下:高胰岛素正葡萄糖钳夹技术是测定IR的“金标准”,但因其操作复杂、费用昂贵,难以推广。随后有学者们提出了多种评价IR的简易公式计算方法,HOMA-IR即为其中之一[22-23]。HOMA-IR的计算基础是单次检测的FBG及FINS值,而单次测定的值容易受多种因素影响,如检测方法的不同、患者体质量差异等。国内有研究发现,HOMA-IR在NGT和IGT组中均展现了与钳夹技术中GIR的明显相关性,但在DM组中相关关系缺失[24],说明用HOMA-IR评价T2DM患者的胰岛素抵抗程度存在一定的欠缺。且HOMA-IR仅考虑了空腹血糖及空腹胰岛素,主要代表了肝脏的胰岛素敏感性[25-26],而解耦联蛋白3主要表达在骨骼肌,我们推测UCP3主要通过增加骨骼肌的葡萄糖摄取改善胰岛素敏感性降低血糖,这可能是我们的研究结果未发现不同基因型的HOMA-IR有差异的原因。且我们的研究样本量较少可能对结果也有一定的影响。我们将在今后的实验中扩大样本量、完善葡萄糖耐量试验,进一步探讨UCP3-55C/T基因多态性与餐后血糖的相关性,明确UCP3-55C/T基因多态性与T2DM患者血糖控制水平的关系。
脂联素是一种由脂肪组织特异性分泌的细胞因子,它可以通过激活AMPK促进外周组织葡萄糖摄取,改善胰岛素敏感性[27,28]。我们的研究结果显示携带T等位基因(CT+TT)的患者血清脂联素水平高于CC基因型患者,Spearman秩相关结果显示UCP3-55C/T基因型与患者脂联素水平呈正相关,TT基因型患者血清脂联素水平明显升高。提示T等位基因携带者可通过增加血清脂联素的表达改善胰岛素抵抗进而改善糖尿病患者的血糖控制水平,但具体机制还有待于进一步研究。
本研究结果显示,在NC组携带T等位基因者BMI低于携带C等位基因者,但在T2DM组三种不同基因型的患者体质量未见明显差异,这与先前的研究一致[11],可能T等位基因在不同人群中对BMI的影响不同。在NC和T2DM组,我们均观察到TT基因型患者LDL-C升高,这与先前的研究一致[10]。推测机制可能为:UCP3是过氧化物酶体增殖剂激活受体(peroxisome proliferators-activated receptors,PPARs)的作用靶点,UCP3-55C/T位于UCP3基因PPAR反应元件下游4 bp,故推测该基因多态性会影响UCP3基因对PPAR的反应,从而影响脂代谢。
综上所述,与CC基因型患者相比,TT基因型患者HbA1c有下降趋势。在血糖控制不佳的T2DM患者中,TT基因型占比明显降低,提示TT基因型可能与T2DM患者的血糖控制水平相关,但其具体机制有待进一步阐明。
