Cx43通过增加肿瘤浸润T细胞的数量抑制黑色素瘤生长
2019-06-01陶岚婷张小敏刘嘉辉
黄 鹍,陶岚婷,张小敏,刘嘉辉
(1中山大学中山医学院药理学教研室,广州 510080;2中山大学附属第一医院中医科;#共同第一作者;*通讯作者,E-mail:liujiahui126@139.com)
黑色素瘤(melanoma)又称恶性黑色素瘤,主要发生于皮肤组织,恶性度极高,一旦发生转移就会迅速扩散危及生命,且对常规化疗敏感性低[1]。近年来,肿瘤免疫治疗已取得重大进展,其中的过继细胞疗法(adoptive cell therapy,ACT)是治疗黑色素瘤的绝佳方案:ACT是在体外扩增患者或供者具有肿瘤特异性杀伤活性的淋巴细胞后,再回输到患者体内从而发挥肿瘤杀伤效应的一种免疫治疗方法[2]。肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes,TILs)则是影响ACT治疗黑色素瘤疗效的关键所在:移植了相应的TILs后,大部分患者的黑色素瘤出现了明显消退[3]。因此,如何增强TILs的肿瘤杀伤作用是研究的重点方向。
在TILs中起抗肿瘤杀伤作用的主要是其T细胞,即肿瘤浸润T细胞(tumor-infiltrating T lymphocytes,TIL-Ts),而肿瘤浸润T细胞主要由负责协调并增强免疫反应的CD4+T细胞(即辅助性T细胞)和负责杀伤肿瘤靶细胞的CD8+T细胞(即细胞毒性T细胞)构成[4,5],故对这两种T细胞的研究更是重中之重。程序性死亡受体1(programmed cell death 1,PD-1)主要就是通过影响这两种T细胞的活化和功能从而抑制自身免疫反应,甚至使肿瘤细胞发生免疫抑制和免疫逃逸[6]。
细胞缝隙连接(gap junction,GJ)是一种位于细胞间的蛋白质通道,使得离子和小分子可以在相邻细胞间直接扩散,由GJ介导的缝隙连接细胞间通讯(gap junction intercellular communication,GJIC)对协调细胞间的信号转导和代谢活动至关重要[7]。研究表明GJ在免疫系统中发挥重要作用:免疫信息能够以肽段的形式通过GJ传递[8],如识别T细胞的肽段可通过GJ在细胞间进行转运[9],而免疫细胞间的GJIC更是可以促进黑色素瘤中相关抗原的呈递和T细胞的免疫应答[10]。Cx43作为组成GJ最重要的连接蛋白(connexin,Cx)之一,也是免疫细胞中主要表达的Cx之一,在黑色素瘤的肿瘤微环境中发挥重要作用:Cx43及其组成的GJ可介导免疫细胞和肿瘤靶细胞之间的GJIC,允许抗原通过树突状细胞或肿瘤细胞与内皮细胞发生交叉呈递(cross-presentation),从而使特异性的CD8+T细胞识别并杀伤肿瘤靶细胞[9, 11]。上述研究提示,在黑色素瘤中,Cx43及其形成的GJ对肿瘤浸润T细胞可能有着极其重要的影响。
因此,本研究通过构建黑色素瘤小鼠模型,观察Cx43对肿瘤生长的影响,并进一步通过流式细胞术分析肿瘤浸润T细胞的数量,明确Cx43影响肿瘤生长的机制,为以Cx43为靶点的抗肿瘤免疫疗法的研发提供理论基础。
1 材料与方法
1.1 细胞株与主要试剂
人胚肾293T细胞和黑色素瘤B16细胞均购自美国ATCC(American type culture collection)公司。胎牛血清(FBS)、青霉素-链霉素(penicillin-streptomycin)、胰酶(typsin)、RPMI 1640 Medium干粉、Dulbecco’s Modified Eagle’s Medium干粉和Opti-MEM转染优化培养基均购于美国Gibco公司。二甲亚砜(DMSO)、Cx43抗体、抗tubulin抗体和相应二抗均购自美国Sigma-Aldrich公司。钙黄绿素(calcein-AM)和活细胞染色剂(CM-DiI)均购自美国Invitrogen公司。30%凝胶母液(丙烯酰胺、甲叉双丙烯酰胺)和脱脂奶粉购自美国Bio-rad。BCA蛋白定量试剂盒购自美国Thermo Fisher;PVDF膜和化学发光液购自美国Millipore公司;CD3-FITC、CD4-PE、CD8-BV421和PD-1-Percp染色的试剂均购自美国Biolegend公司。过表达Cx43的慢病毒载体pLenti-EF1a-F2A-Puro-CMV-Cx43-Myc及作为对照的Mock载体pLenti-EF1a-F2A-Puro-CMV-Mock-Myc购自上海合元公司。pSPAX2、pMD2G质粒由武汉协和医院肿瘤中心徐双兵课题组馈赠。
1.2 主要仪器
二氧化碳细胞培养箱(HEPAC CLASS 100,Thermo);pH计(InLab413,Mettler Toledo);超声破碎仪(sonics);发光生物分子成像仪(Image Quant LAS4000);荧光倒置显微镜(IX51,Olympus);流式细胞仪(BD LSRFortessa X-20)。
1.3 细胞培养及慢病毒转染法构建B16-Mock及B16-Cx43细胞模型
B16细胞常规培养于含有10%胎牛血清的RPMI 1640培养基中(含1%青霉素-链霉素双抗)。293T细胞常规培养于含10%胎牛血清的DMEM培养基中。两种细胞均在37 ℃、5% CO2培养箱中进行传代培养。第1天,293T细胞接种至10 cm细胞培养皿,密度为30%-50%。第2天贴壁后根据实际所需转染的个数,每个样品取出2个EP管,在1个EP管中加入30 μl PEI,并加入1.5 ml Opti-MEM转染优化培养基。轻柔混匀,室温静置5 min。在另1个EP管中加入12 μg质粒(包含慢病毒载体/目的质粒6 μg,pSPAX2质粒4.5 μg,pMD2G质粒1.5 μg),加入1.5 ml Opti-MEM转染优化培养基,轻柔混匀。将两者混合,静置15-20 min。将上一步骤中的混合液体轻轻加入铺有293T细胞的10 cm皿中,轻轻摇匀。置于37 ℃,5%的CO2培养箱中继续培养。第3天,293T细胞换液(13 ml培养基)。第4天,接种目的细胞B16到10 cm皿中,30%-50%密度。第5天,收集293T细胞上清,用0.45 μm滤器,过滤收集约10 ml培养基,加入等体积培养基,分为2份,各10 ml。一份培养基及基因转染增强剂polybrene,感染目的细胞24 h。第6天,将另一份培养基及基因转染增强剂polybrene加入目的细胞,继续感染24 h。第7天用含有1 μg/ml嘌呤霉素的培养液筛选3 d后可进行鉴定。
1.4 黑色素瘤小鼠模型的制备
将8只6-8周龄的雌性C57BL/6C小鼠,SPF级,购自北京维通利华实验动物技术有限公司,生产许可证号:SCXY(京)2016-0006,随机均分为对照组和过表达Cx43组,每组4只。分别取对数生长期的B16-Mock和B16-Cx43细胞,吸去培养液,消化细胞制成细胞悬液,计数存活的肿瘤细胞,存活肿瘤细胞应大于95%。调整细胞数为每毫升1×106个,制备成B16-Mock和B16-Cx43细胞悬液备用。消毒小鼠左侧腹股沟处皮肤,对照组小鼠注射B16-Mock细胞悬液,过表达Cx43组小鼠注射B16-Cx43细胞悬液,每只0.2 ml。接种相应黑色素瘤细胞后,观察记录肿瘤生长情况,直至小鼠因状态萎靡或肿瘤过大(直径>2 cm)而被处死,处死时取脾脏、淋巴结和肿瘤组织备用。
1.5 Western blot检测细胞蛋白水平
待相应细胞融合度至90%时弃掉培养液,经预冷的PBS洗3次,加入适量细胞裂解液裂解细胞,用细胞刮匙将细胞刮下后超声破碎细胞,4 ℃、12 000 r/min,离心30 min,取上清,采用Bio-rad DC assay法进行蛋白定量。取蛋白25 μg上样至10% SDS-PAGE分离,转膜至NC膜,5%的脱脂奶粉/TBST封闭60 min,Cx43一抗(1 ∶8 000),Tubulin一抗(1 ∶10 000),Cx43二抗(1 ∶10 000,抗鼠),Tubulin二抗(1 ∶10 000,抗鼠),使用凝胶成像系统照像记录,然后用ImageJ软件分析条带灰度。
1.6 细胞接种荧光示踪法(parachute dye-coupling assay)检测GJ功能
在细胞中Calcein-AM染料游离出来的Calcein(绿色荧光),不能通过细胞膜,但可自由穿过GJ传递至相邻的细胞。DiI-CM染料进入细胞后释放出的DiI大分子(红色荧光),不能通过GJ,因此用于定位识别供体细胞(Donor cell)。首先将实验细胞按照一定的密度接种于12孔板,培养至约80%融合度。制备供体细胞:选取其中一孔,培养基换为0.5 ml无血清培养基,接着加入0.5 μl的Calcein-AM和1 μl的DiI-CM。然后置于37 ℃,5 %的CO2培养箱中继续共同孵育30 min后,快速用PBS洗细胞3次。用胰酶消化,细胞计数供体细胞密度,按照1 ∶500的密度均匀接种到药物处理后的受体细胞(receiver cell)中,培养4 h,用荧光显微镜观察荧光传递情况,评价GJ功能。通过计数1个供体细胞(红色和绿色荧光共标记)附近受体细胞(绿色荧光标记)的个数,对GJ功能进行定量评估。
1.7 抗肿瘤效果评估
肿瘤细胞移植到小鼠皮下,待可测量(直径>0.3 cm)肿瘤生长后,用游标卡尺每隔1 d测量肿瘤生长情况,包括肿瘤最长径L和肿瘤垂直方向最大横径W,依照公式计算肿瘤体积V=L×W2×0.5计算。17 d时,麻醉处死小鼠,摘取肿瘤,尽量去除皮肤毛发及结缔组织,电子天秤上称量肿瘤质量。
1.8 在体外分别对小鼠相应组织中的T细胞进行分离并用流式细胞仪分析
处死小鼠后分别取出其脾脏、淋巴结和肿瘤组织并分别磨碎组织,然后1 500 r/min离心5 min。各相应组织加入10 ml红细胞裂解液,混匀,室温静置10 min裂解红细胞,PBS洗涤细胞终止反应。重悬调整细胞浓度,每个染色用1×106个细胞。按说明书分别进行CD3-FITC/CD4-PE/CD8-BV421/PD-1-Percp染色,通过BD LSRFortessa X-20流式细胞仪分析。肿瘤组织中分离出来的T细胞即肿瘤浸润T细胞。
1.9 统计学分析

2 结果
2.1 黑色素瘤细胞中过表达Cx43后GJ功能的变化
Western blot结果显示,与B16-Mock细胞相比,B16-Cx43细胞中Cx43的蛋白表达明显增多(P<0.05,见图1A),表明过表达Cx43的稳定转染细胞模型构建成功,可进行下一步GJ功能变化的检测。细胞接种荧光示踪法检测显示:与B16-Mock细胞相比,B16-Cx43细胞间的荧光传递数目明显增多,在每一个供体细胞周围,接受细胞的平均个数由0.33个增加到17个,即GJ功能显著增强、细胞间的GJIC显著增多(P<0.05,见图1B)。

与对照组(B16-Mock)比较,*P<0.05图1 在B16细胞中过表达Cx43对GJ功能的影响Figure 1 Effects of Cx43 overexpression on GJ function in B16 cells
2.2 过表达Cx43后黑色素瘤肿瘤体积和质量的变化
相应黑色素瘤细胞移植且待肿瘤生长至可测量大小(直径>0.3 cm)后(Day 11),Mock对照组小鼠的皮下瘤组织块体积不断增大,在第17天被处死时,其肿瘤体积可达(4.361±0.680)cm3,肿瘤质量为(0.28±0.04)g;而过表达Cx43组小鼠的肿瘤体积增长显著减缓,在第17天被处死时其肿瘤体积仅为(0.941±0.207)cm3,肿瘤质量仅为(0.05±0.01)g。与Mock对照组相比,过表达Cx43后黑色素瘤的肿瘤体积明显下降(P<0.05,见图2A),肿瘤质量也明显下降(P<0.05,见图2B)。
2.3 过表达Cx43后脾脏和淋巴结中CD4+T细胞和CD8+T细胞的数量变化
取小鼠脾脏和淋巴结并分离出其中的T细胞,流式细胞仪分析结果显示:与Mock对照组相比,过表达Cx43组的黑色素瘤小鼠脾脏中分离出的T细胞中CD4+T细胞和CD8+T细胞数量的差异无统计学意义(P>0.05,见图3A、B),过表达Cx43组的黑色素瘤小鼠淋巴结分离出的T细胞中CD4+T细胞和CD8+T细胞数量的差异无统计学意义(P>0.05,见图3C、D)。
2.4 过表达Cx43后肿瘤浸润T细胞中CD4+T细胞和CD8+T细胞的数量变化
分离出小鼠肿瘤组织中的肿瘤浸润T细胞TIL-Ts,流式细胞仪分析结果显示:与Mock对照组相比,过表达Cx43组小鼠黑色素瘤肿瘤浸润T细胞中CD4+T细胞的数量有所增加,平均由40.95%增加至46.70%(P<0.05,见图4A);CD8+T细胞的数量也有所增加,平均由20.43%增加至29.20%(P<0.05,见图4B);双阳性的CD4+CD8+T细胞数量显著增加,平均由1.34%增加到3.27%(P<0.05,见图4C)。
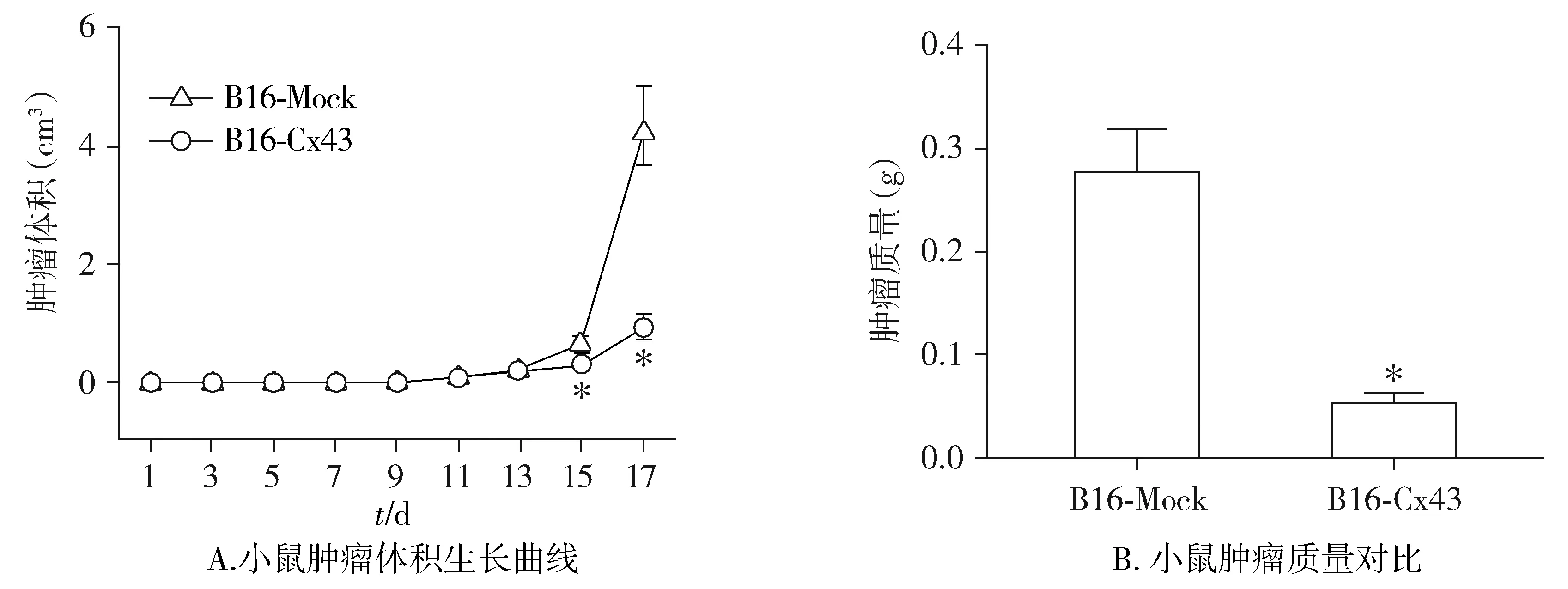
与对照组(B16-Mock)比较,*P<0.05图2 黑色素瘤细胞中过表达Cx43对小鼠黑色素瘤肿瘤生长的影响Figure 2 Effects of overexpressing Cx43 in melanoma cells on melanoma tumor growth in mice

图3 黑色素瘤细胞中过表达Cx43对小鼠脾脏和淋巴结中相应T细胞数量的影响Figure 3 Effects of overexpressing Cx43 in melanoma cells on the number of T cells in the spleen and lymph nodes of mice
2.5 过表达Cx43后,肿瘤浸润CD8+T细胞中PD-1的阳性率的变化
本研究通过流式细胞仪进一步对肿瘤浸润CD8+T细胞中PD-1的阳性率(T细胞衰竭的标志之一)进行了检测,结果表明:与Mock对照组相比,过表达Cx43组小鼠肿瘤浸润CD8+T细胞中PD-1的阳性率也显著增加,平均由6.69%增加到12.63%(P<0.05,见图5)。

与对照组(B16-Mock)比较,*P<0.05图4 黑色素瘤细胞中过表达Cx43对小鼠肿瘤组织中肿瘤浸润T细胞的数量的影响Figure 4 Effects of overexpressing Cx43 in melanoma cells on the number of tumor-infiltrating T cells in mice tumor tissues

图5 黑色素瘤细胞中过表达Cx43对相应CD8+T细胞中PD-1阳性率的影响Figure 5 Effects of overexpressing Cx43 in melanoma cells on the positive rate of PD-1 in CD8+T cells
3 讨论
黑色素瘤作为一种高转移性恶性肿瘤,对传统的化疗方案耐受性较强,其发病危险系数与死亡率仍呈逐年增长的趋势[12]。近年来以肿瘤浸润T细胞为主的过继细胞免疫疗法在黑色素瘤的治疗上获得了重大成效,使很多黑色素瘤患者实现了长期生存,故免疫疗法将是未来攻克黑色素瘤的重点方向[2,12]。但该疗法的不足之处在于其存在“免疫治疗耐药”,即黑色素瘤会对免疫治疗产生耐受:某些通路如PTEN的缺失和PI3K-AKT通路的激活,抑制T细胞进入肿瘤组织的数量、减少肿瘤中肿瘤浸润T细胞的数量、降低T细胞介导的肿瘤杀伤作用,进而促使黑色素瘤对杀伤肿瘤的免疫反应发生耐受[13]。因此只有尽快地找到可逆转“免疫治疗耐药”的靶标,才能更大程度地增强过继细胞疗法和免疫疗法的临床疗效。
本研究中的Cx43是人体内分布最广泛、研究最深入的缝隙连接蛋白,也是肿瘤细胞中主要表达的连接蛋白之一[14]。研究表明,Cx43在免疫细胞中也广泛表达,并在T细胞活化和细胞因子的产生中发挥重要作用[15]。关于Cx43在肿瘤发生发展中作用和机制的研究数不胜数,但Cx43和GJs对肿瘤浸润T细胞的影响尚未明确,关于Cx43、肿瘤浸润T细胞和黑色素瘤三者之间相互关系的研究很少[16]。于是本研究聚焦于Cx43是否可以通过影响肿瘤浸润T细胞的数量进而影响黑色素瘤的发生发展。
已有研究证明Cx组成的GJ可使识别相应T细胞的肽段在细胞间进行转运[9]:更多的Cx增强GJ功能,从而增强细胞间GJIC后,可使更多的T细胞识别肽段在细胞间发生转运,促进T细胞转运至肿瘤组织或靶细胞上,从而更为高效地识别抗肿瘤免疫反应中杀伤肿瘤细胞的T细胞。所以本研究首先在黑色素瘤B16细胞上过表达了Cx43,细胞接种荧光示踪法检测显示其GJ功能得到了显著增强,说明在B16细胞上增加Cx43的表达可形成更多细胞间的GJ并增强细胞间GJIC。这为后续的研究奠定了基础。
Cx在某些肿瘤中可作为抑癌基因对肿瘤生长增殖进行抑制,如Cx43已被证实可抑制黑色素瘤的肿瘤增殖[14]。本研究在小鼠黑色素瘤模型中的实验数据也表明:相比正常表达Cx43的黑色素瘤,过表达Cx43的黑色素瘤肿瘤体积明显减小、质量也明显下降,这进一步说明Cx43可抑制黑色素瘤肿瘤的生长,且这种抑制作用可能和GJIC功能的增强有关。
Benlalam等[17]的研究表明,Cx43和其形成的GJ介导的GJIC会影响T细胞的活化,肿瘤浸润CD4+T细胞和CD8+T细胞的数量也可能会受到影响。本研究的实验结果也证实:小鼠肿瘤模型中取出肿瘤并分离出其中的肿瘤细胞,通过流式细胞仪分析结果表明过表达Cx43后的肿瘤组织中的肿瘤浸润T细胞中CD4+T细胞和CD8+T细胞的数量有所增加,CD4+CD8+(双阳性)的T细胞数量更是显著增加。同时,本研究分离出小鼠脾脏和淋巴组织中的T细胞,流式细胞术分析结果表明,过表达Cx43后脾脏和淋巴结中的T细胞数量基本不变。这表明在肿瘤细胞中过表达Cx43可有针对性地显著增加肿瘤浸润T细胞数量,同时不影响脾脏和淋巴结中相应T细胞的数量。可见,增强Cx43表达或许能够解决免疫耐受中肿瘤浸润T细胞数量减少及T细胞肿瘤杀伤作用被抑制的问题。以上种种实验结果提示:Cx43可以通过增加肿瘤浸润T细胞的数量进而抑制肿瘤的生长。
最后一部分的实验结果表明:过表达Cx43后,肿瘤浸润CD8+T细胞中的PD-1阳性率显著增加,这是一个耐人寻味的现象。本研究在小鼠模型上过表达Cx43显著地抑制了黑色素瘤的生长,而PD-1在CD8+T细胞中高表达是T细胞衰竭的指标之一[18]。此现象的发生可能有以下原因:其一,PD-1高表达固然是T细胞衰竭的重要指标,过表达Cx43后CD8+T细胞中PD-1的表达增高表示衰竭的T细胞增多,这和本研究的结论—过表达Cx43可增加T细胞的数量是相符合的,肿瘤组织中T细胞的数量增多了,其衰竭的数量自然也会增多;其二,过表达Cx43增加了肿瘤浸润T细胞数量后,PD-1的高表达可能是作为一种负反馈调节而出现的,这将有利于增进PD-1抑制剂的敏感性和疗效—在PD-1高表达的基础上能够更为显著地降低PD-1的表达,从而减少T细胞的衰竭。
总而言之,本研究证明:在黑色素瘤B16细胞中增强Cx43的表达后,黑色素瘤肿瘤的生长明显受到抑制;肿瘤中的肿瘤浸润T细胞数量明显增加。也就是说,Cx43可通过增加肿瘤浸润T细胞的数量,从而抑制黑色素瘤肿瘤的生长,其作用机制可能与高表达的Cx43增强了细胞间的GJIC有关。因此,Cx43很可能是解决黑色素瘤“免疫耐药性”问题的一剂良方,高表达Cx43可从“上游开闸”增加肿瘤浸润T细胞的数量,与PD-1抑制剂减少T细胞的衰竭相辅相成,这为缝隙连接和肿瘤免疫的研究都提供了新的参考方向。
