lncBRM对子宫内膜癌细胞增殖和迁移的影响
2019-06-01张莉华张易欣段建英李美艳
刘 平,杨 安,于 辉,张莉华,张易欣,段建英,李美艳
(1邯郸市中心医院妇科,邯郸 056000;2邯郸市人民医院妇产科;*通讯作者,E-mail:LiuPing1801@163.com)
子宫内膜癌是女性子宫内膜的一组上皮性恶性肿瘤,是女性生殖系统常见恶性肿瘤之一,约占女性生殖道肿瘤的20%[1]。近年来,子宫内膜癌发病率有升高趋势,流行病学统计表明,近年来我国子宫内膜癌发病率升高1.5倍,已成为发病率最高的女性生殖道恶性肿瘤[2]。
长链非编码RNA(lncRNA)是指转录本长度大于200个核苷酸且不编码蛋白质的RNA序列。研究显示,lncRNA已成为不同生物领域基因表达的中心调节因子,包括肿瘤生长和发育、增殖、分化和细胞自噬[3]。研究表明,许多lncRNA通过与蛋白质、miRNA或mRNA的相互作用在子宫内膜癌的发生和进展中发挥关键作用[4]。有研究显示,lncBRM在卵巢癌中表达显著上调[5]。lncBRM在子宫内膜癌中的作用机制无报道。基于lncBRM对卵巢癌的作用,我们推测lncBRM对子宫内膜癌也具有显著的影响。本研究探讨lncBRM在子宫内膜癌细胞中的生物学功能和分子机制,以寻找子宫内膜癌患者潜在治疗靶点。
1 材料与方法
1.1 组织样本收集
选择2015-10~2016-10在邯郸市中心医院经病理确诊并实施手术切除的子宫内膜癌患者组织和癌周正常子宫内膜组织(距肿瘤组织6 cm左右)8例,每例标本均经过病理科医师严格鉴定。所有患者手术前未接受全身治疗,所有组织样本取下后迅速置于液氮冻存。本实验方案通过伦理委员会审批,并取得患者知情同意。
1.2 细胞株及主要试剂
人子宫内膜癌细胞系Ishikawa(中国科学院典型培养物保藏委员会细胞库),RPMI 1640细胞培养基、胎牛血清(美国Gibico公司),胰酶、Lipofectamine 2000(美国thermofisher公司),lncBRM siRNA及其对照物NC-siRNA(上海吉玛生物公司),CCK-8(美国sigma公司),Trizol试剂(美国Invitrogen公司),Transwell小室(美国Corning公司),Wnt3a Rabbit mAb、p-β-catenin Rabbit mAb(美国CST公司),Anti-Sox4 antibody(美国Abcam公司)。
1.3 细胞培养与转染
人子宫内膜癌细胞系Ishikawa用含有10%胎牛血清的RPMI 1640培养基培养,于37 ℃、5% CO2培养,每28 h更换培养基1次,细胞汇合至80%以上传代培养。转染前24 h,6孔板接种Ishikawa细胞,用不含抗生素的培养基培养。待细胞密度达到70%时,按照Lipofectamine 2000操作说明转染细胞,细胞被培养6 h,去除培养基,加入完全培养液(10% FBS RPMI 1640)。37 ℃、5% CO2培养,检测lncRNA BRM的表达,用于后续实验。
1.4 CCK-8法检测细胞活力
取转染后的人子宫内膜癌细胞Ishikawa,0.25%胰酶消化离心,接种5×103个细胞于96孔板,每孔200 μl,细胞被置于37 ℃、5%CO2培养,每组设置6个复孔,培养24-48 h,每孔加入10 μl CCK-8工作液,细胞被置于细胞培养箱,细胞被培养1.5 h,然后于酶标仪450 nm下测定吸光值(A450 nm),用A450 nm代表细胞活力。
1.5 荧光定量PCR检测lncRNA BRM和Sox4水平
通过Trizol法从子宫内膜癌组织和细胞中提取总RNA,按照说明书逆转录成cDNA,以获得反应体系的cDNA模板,采用两步法进行实时荧光定量PCR反应,以GAPDH为内参,根据Ct值计算子宫内膜癌组织和细胞的lncRNA BRM和Sox4水平。
1.6 流式细胞仪检测细胞迁移
取转染后的人子宫内膜癌细胞Ishikawa,常规培养,细胞同步化后,更换原培养液,细胞被培养24 h,然后收集细胞,离心洗涤后按照试剂盒操作说明书加入流式缓冲液重悬细胞,加入5 μl Annexin Ⅴ-FITC混匀,4 ℃避光孵育20-30 min,再加5 μl PI染液,孵育5 min,立即用流式细胞仪检测。
1.7 Western blot检测Wnt和β-catenin蛋白表达
培养转染后的人子宫内膜癌细胞Ishikawa,去除细胞培养液,加入PBS洗涤细胞,加入蛋白裂解液收集细胞蛋白样品,然后取25 μg蛋白样品进行SDS-PAGE分离、转膜,5%脱脂奶粉封闭1 h,加入(1 ∶500)稀释的一抗(Wnt,β-catenin,GAPDH),室温孵育1 h。洗涤后加入HRP标记的二抗,室温孵育1 h,洗涤后加入化学发光液显色,成像拍照,软件进行灰度值统计分析。
1.8 统计学分析
实验数据采用SPSS22.0软件进行分析,细胞实验均至少重复3次,实验数据采用均数±标准差表示。两组间的比较采用t检验,多组间的比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 lncBRM在子宫内膜癌组织中的表达
荧光定量PCR结果表明,与癌旁组织相比,子宫内膜癌组织中的lncBRM的表达量显著升高,差异具有统计学意义(P<0.01,见图1)。
2.2 干扰lncBRM对子宫内膜癌Ishikawa细胞lncBRM和Sox4的影响
荧光定量结果所示,与对照组NC-siRNA比,lncBRM-siRNA组Ishikawa细胞lncBRM和Sox4 mRNA表达显著降低,差异具有统计学意义(P<0.01,见图2)。
2.3 干扰lncBRM对子宫内膜癌Ishikawa细胞活力的影响
CCK-8结果所示,与NC-siRNA组比较,lncBRM-siRNA组细胞在被培养24和48 h后细胞活力显著降低,差异具有统计学意义(P<0.01,见图3)。

与癌旁组织比较,**P<0.01图1 lncBRM在子宫内膜癌和癌旁组织中的表达量Figure 1 Expression of lncBRM in endometrial cancer and and normal tissues
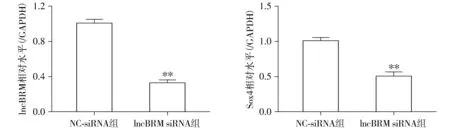
与NC-siRNA组比较,**P<0.01图2 lncBRM siRNA对人子宫内膜癌Ishikawa细胞lncBRM和Sox4 mRNA表达的影响Figure 2 Effects of lncBRM siRNA on the lncBRM and Sox4 mRNA level of Ishikawa
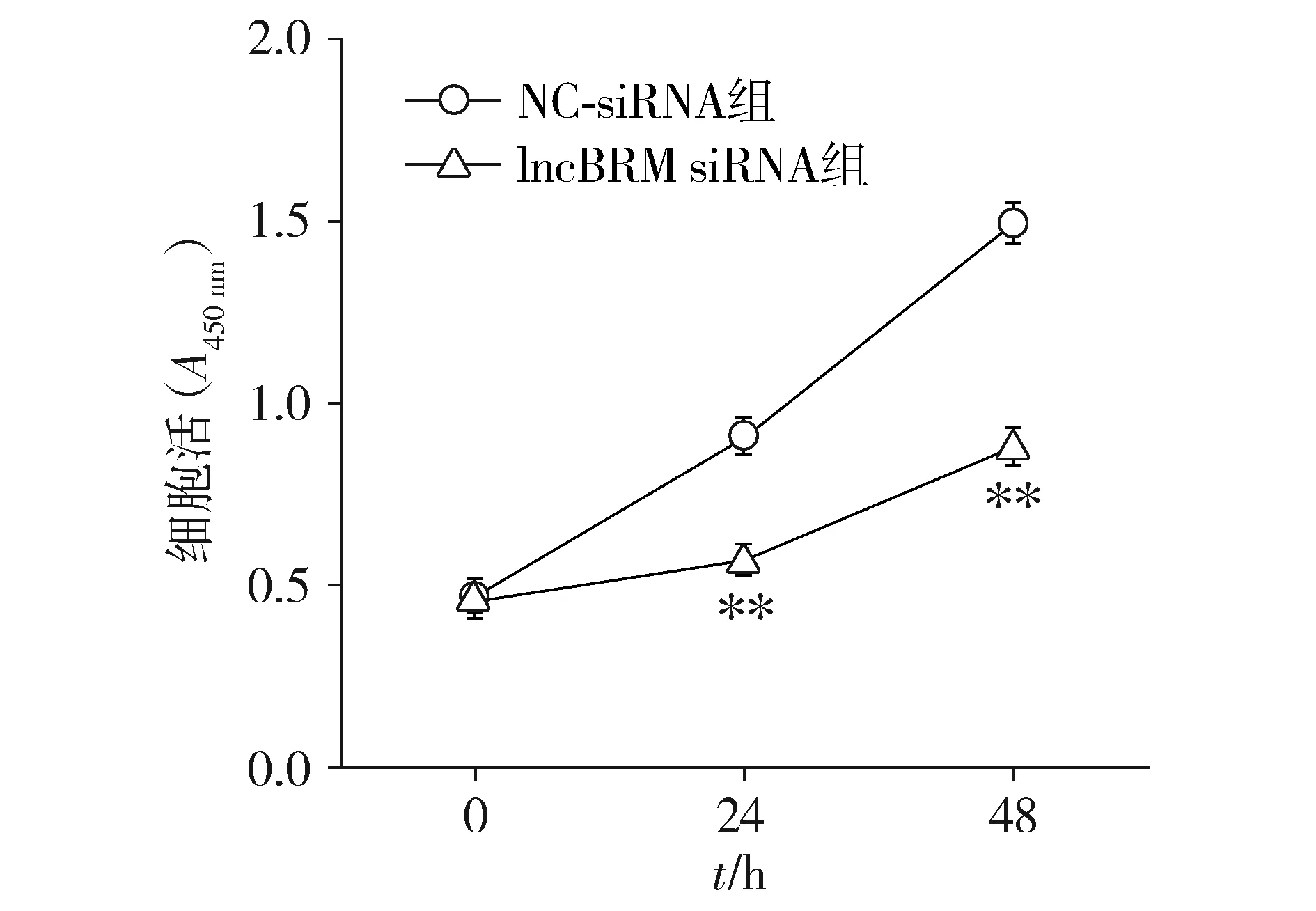
与NC-siRNA组比较,**P<0.01图3 lncBRM对人子宫内膜癌细胞Ishikawa细胞活力的影响Figure 3 Effects of lncBRM on the viability of Ishikawa at different time
2.4 干扰lncBRM对子宫内膜癌Ishikawa细胞迁移的影响
Transwell结果显示,与NC-siRNA组比较,lncBRM siRNA组细胞的迁移率显著降低,差异具有统计学意义(P<0.01,图4)。
2.5 干扰lncBRM对子宫内膜癌Ishikawa细胞Wnt/β-catenin通路的影响
免疫印迹检测结果显示,与NC-siRNA组比较,lncBRM siRNA组细胞的Sox4、Wnt3a和β-catenin蛋白表达量显著降低,差异具有统计学意义(P<0.01,见图5)。
3 讨论
流行病学研究表明,近年来子宫内膜癌发病率已显著高于宫颈癌,成为发病率最高的女性生殖道恶性肿瘤[6]。子宫内膜癌细胞增殖和抗迁移是其预后较差的原因之一[7]。研究影响子宫内膜癌细胞增殖和迁移的调控因子对于子宫内膜癌的治疗具有重要的意义。
lncRNA具有调控癌基因和抑癌基因的作用。lncBRM(LncRNA for association with Brahma)位于5号染色体的ACTBL2和PLK2基因之间。lncBRM最早发现与肝癌的进展和预后密切相关,其在肝癌组织中显著高表达[8]。研究表明,lncBRM在卵巢癌组织中高表达,下调lncBRM能够抑制Sox4的表达,抑制卵巢癌细胞增殖和迁移[5]。lncBRM对子宫内膜癌是否也具有类似的影响还不清楚。本研究通过Q-PCR检测了lncBRM在子宫内膜癌组织中的表达水平,结果表明lncBRM在子宫内膜癌组织中表达显著上调,并通过CCK8和Transwell检测了lncBRM对子宫内膜癌细胞增殖和迁移的影响,结果显示lncBRM能够抑制子宫内膜癌细胞增殖,促进细胞迁移,这与其他学者的研究结果一致。

图4 lncBRM对人子宫内膜癌细胞Ishikawa细胞迁移的影响Figure 4 Effects of lncBRM on the migration of Ishikawa

与NC-siRNA比较,**P<0.01图5 lncBRM对人子宫内膜癌细胞Ishikawa细胞蛋白表达的影响Figure 5 Effects of lncBRM on the protein expression of Ishikawa
Wnt/β-catenin信号通路是一组进化保守通路,在许多物种的众多生命活动过程发挥调控作用。Wnt通路的异常激活与心血管疾病、肝纤维化及癌症的发生发展紧密联系[9,10]。研究表明,Wnt信号通路在许多癌症的发展发展中起着重要的作用[11]。Wnt信号通路与子宫内膜癌的发生发展密切相关,研究显示,下调E-cadherin蛋白表达能够激活Wnt/β-catenin信号通路,Wnt/β-catenin信号通路的活化能够促进子宫内膜癌细胞的迁移和侵袭[12]。还有研究表明,孕酮能够通过下调Wnt1蛋白的表达抑制子宫内膜癌Ishikawa细胞的增殖[13]。
Sox4(sex determining region Y-box 4)是Sox转录因子家族成员,由无内含子基因编码,能够与其他蛋白,如配体结合蛋白syntenin结合形成转录调节复合物,调控增殖和凋亡等相关蛋白的表达[14]。研究表明Sox4与细胞干性和器官发育密切相关,在胚胎发育过程中Sox4基因表达可促成胰腺、骨骼、心脏发育以及淋巴细胞分化[15]。Sox4功能失常后变为癌基因,许多癌症中都有过量表达的Sox4,其促进了细胞增殖,减少了细胞凋亡并促进细胞迁移侵袭[16]。研究表明Wnt/β-catenin信号通路与Sox4密切相关。miR-129-5p通过靶向Sox4抑制Wnt/β-catenin信号通路,进一步抑制软骨肉瘤细胞增殖,迁移和促进细胞凋亡[17]。最新研究表明,异丙酚(propofol)能够通过Wnt/β-catenin信号通路抑制Sox4蛋白的表达,从而抑制子宫内膜癌细胞的增殖、迁移和侵袭,促进细胞凋亡[18]。
本研究通过荧光定量PCR实验证实了干扰lncBRM能够抑制Sox4 mRNA表达水平,而免疫印迹结果也证实了lncBRM siRNA能够抑制Wnt3a、β-catenin和Sox4的蛋白表达,进一步证实了lncBRM对子宫内膜癌Ishikawa细胞增殖和迁移的调控是通过影响Sox4蛋白和Wnt/β-catenin通路的蛋白表达水平来实现的。
综上所述,本研究证实了Sox4是lncBRM下游重要靶点之一,lncBRM通过调控Sox4和Wnt/β-catenin通路抑制人子宫内膜癌Ishikawa细胞增殖和迁移。lncBRM调控子宫内膜癌细胞Ishikawa细胞增殖和迁移的具体作用机制还需要进一步研究。本研究结果有助于了解lncBRM在子宫内膜癌中的作用,为子宫内膜癌的治疗提供理论依据和实验基础。
