SIRT1对LPS诱导的坏死性小肠结肠炎小鼠模型的保护作用
2019-06-01白铂亮席朝霞桂艳红王惠萍
张 岚,白铂亮,王 莉,高 琼,席朝霞,桂艳红,王惠萍
(西安交通大学第二附属医院儿科,西安 710004;*通讯作者,E-mail:gqz9266@163.com)
坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是引起新生儿童死亡的常见且重要的肠道疾病,在早产儿中的发病率约70%[1]。NEC临床主要表现为呕吐、腹胀、便血,病理组织常以回结肠坏死为特征[2]。研究报道,NEC患儿中约90%为早产儿,目前认为NEC是菌群定植紊乱、早产、缺氧缺血等多种因素引起的炎症反应及肠道坏死[3]。目前对于NEC严重患者采取手术切除坏死肠组织的治疗方法,但术后并发症较多。沉默信息调节因子1(silence information regulator 1,SIRT1)是辅酶Ⅰ依赖性的去乙酰化酶(histone deacetylase,HDAC),是维持细胞稳态和生存的关键因子,SIRT1在修复DNA、细胞增殖、分化、炎症反应等过程中发挥重要作用[4,5]。研究报道,SIRT1激动剂预处理可减轻炎症性肠黏膜损伤[6]。但关于SIRT1对NEC是否有保护作用研究尚少。细菌脂多糖(lipopolysaccharide,LPS)可调节炎症反应,在NEC的发生中具有重要作用[4]。本研究旨在建立LPS诱导的小鼠NEC模型,探讨SIRT1的表达及其作用机制。
1 材料与方法
1.1 实验动物
C57BL/6小鼠60只,清洁级,3-4日龄,体质量1.5-3.0 g,雌雄不限,由河南中医药大学实验动物中心提供。
1.2 主要试剂与仪器
雅培婴幼儿奶粉、蛋白质粉购自美国雅培公司,细胞RNA提取试剂盒、反转录试剂盒日本购自TaKaRa公司,组织裂解液购自美国Ray Biotech公司,HBSS平衡盐溶液购自美国Gibco公司,胶原酶、DNA酶购自美国Sigma-Aldrich公司,蛋白酶抑制剂购自中国碧云天公司,组织RNA提取试剂盒德国Qiagen公司,白介素6(IL-6)、白介素10(IL-10)、肿瘤坏死因子-α(TNF-α)ELISA试剂盒购自武汉艾美捷科技有限公司,HRP羊抗鼠IgG(R&D Systems),SIRT1、β-Actin一抗购自美国Abcam公司,SIRT1激动剂Resveratrol购自MUST公司;FO-2型氧浓度测定仪购自澳洲FarStar公司,自制新生鼠保育箱、有机玻璃密闭缺氧仓、低温离心机购自德国Heraeus公司,酶标仪购自德国Eppendorf。
1.3 动物模型的制备
清洁级3-4日龄C57BL/6小鼠60只被随机分为三组(n=20):对照组、NEC模型组和SIRT1激动剂干预组,小鼠放置在保育箱中(温度32-33 ℃,湿度45%-65%)。对照组大鼠与母鼠同笼,鼠乳喂养,不做任何处理;NEC模型组和SIRT1激动剂干预组大鼠出生24 h与母鼠分开,置于保育箱中,采用鼠乳代用品人工饲养,经口插入PICC管灌胃饲养,第1天每4 h饲养0.1 ml代乳品,每12 h增加0.05 ml,喂养不超过0.3 ml;SIRT1激动剂干预组每天灌胃20 mg/(kg·d)SIRT1激动剂,1次/d,连续5 d;NEC模型制备参考文献[6],NEC模型组和SIRT1激动剂干预组于开始第6天每日LPS灌胃1次(10 mg/kg),1次/d,连续3 d;对照组给予同剂量9 g/L盐水灌胃。NEC模型组和SIRT1激动剂干预组小鼠放入自制缺氧箱中,箱内冲入氮气,控制氮气流量为15 L/min;缺氧箱O2为0开始计时,90 s关闭氮气阀取出小鼠,将其置于4 ℃冰箱冷刺激10 min;每天缺氧、冷刺激2次,连续2 d;最后1次刺激后空腹12 h称取53只小鼠体质量,模型组小鼠死亡7只。
1.4 血液样品的采集
模型制备结束后空腹12 h,实验剩余53只小鼠断头取血,每只断头后取血液3 ml,室温静置15 min,3 000 r/min离心15 min,分离血清放于-20 ℃冰箱中保存待测。
1.5 小鼠肠组织形态学检查
按上述1.4处死小鼠后,每只小鼠采集十二指肠下端至回盲部肠管,PBS漂洗,观察肠管的弹性、色泽及肠腔有无积气、出血、坏死等病变。采集小鼠近回盲部肠组织1-2 cm固定于4%多聚甲醛溶液中,进行石蜡包埋、切片、HE染色,光镜下观察肠组织形态学变化。
1.6 肠组织IL-6、IL-10、TNF-α的检测
-80 ℃冰箱取出冻存的肠组织,称约10 mg,加入20 μl组织裂解液及相应体积的PMSF进行匀浆,并于4 ℃、12 000 r/min离心10 min,采用ELISA测定肠组织匀浆液IL-6、IL-10、TNF-α水平,操作步骤按照试剂盒说明书进行。
1.7 qRT-PCR法检测IL-6、IL-10、TNF-α mRNA表达水平
取出-80 ℃冰箱冻存的肠组织剪切50 mg左右进行匀浆,Trizol试剂盒提取总RNA,紫外分光光度计测定RNA的浓度和纯度;总RNA反转录为cDNA,进行qRT-PCR。引物序列见表1。qRT-PCR反应条件为:95 ℃ 5 min,95 ℃ 10 s、60 ℃ 30 s,72 ℃ 2 min,共40个循环,72 ℃延伸10 min。反应体系为20 μl:2×SYBR Mix 10 μl,10×cDNA模板1 μl,上下游引物各0.5 μl,H2O 8 μl。收集数据计算各组mRNA表达量,以β-Actin作为内参。
表1 qRT-PCR引物序列
Table 1 Primer sequences of qRT-PCR

引物名称 序列(5′-3′)β-ActinF:ATTACCCGCCCGACAATAGGR:CATGAGTCAGCTAGGCTAGAAIL-6F:ACAACCACGGCCTTCCCTACTTR:CACGATTTCCCAGAGAACATGTGTNF-αF:ATGGCCTCCCTCTCATCAGTTR:ACAGGCTTGTCACTCGAATTTTGIL-10F:GCCGTCATTTTCTGCCTCATR:GCTTCCCTATGGCCCTCATT
1.8 Western blot检测肠组织SIRT1蛋白表达

1.9 统计学分析
2 结果
2.1 小鼠一般情况及体质量变化
对照组无异常情况,造模后模型组、干预组小鼠均出现不同程度的腹胀、排黄绿色稀便、体质量减轻、嗜睡、胃滞留、呼吸急促等症状,干预组小鼠各症状较模型组减轻。实验过程中对照组小鼠无异常情况,体质量升高,模型组、SIRT1激动剂干预组小鼠体质量均减轻;模型组死亡7只,SIRT1激动剂干预组无死亡。
2.2 肠组织病理学改变
光镜观察肠组织病理切片显示,对照组肠道上皮结构完整,肠绒毛完整,无血管扩张;模型组黏膜下层出血明显、水肿、肌层变薄,黏膜下层和固有层分离,肠绒毛结构不完整,部分脱落、坏死;SIRT1激动剂干预组较模型组损伤较轻,黏膜下层和肌层轻微水肿,绒毛损伤、脱落较轻(见图1)。
2.3 各组小鼠肠组织SIRT1表达水平
Western blot检测显示,与对照组比较,模型组、干预组小鼠肠组织SIRT1表达水平显著降低(P<0.05);与模型组比较,SIRT1激动剂干预组SIRT1水平显著升高(P<0.05,见图2)。
2.4 ELISA检测肠组织IL-6、TNF-α、IL-10的水平
ELISA检测结果显示,与对照组比较,模型组肠组织匀浆液中IL-6、TNF-α水平显著升高,IL-10水平显著降低(P<0.05);与模型组比较,干预组肠组织匀浆液中IL-6、TNF-α、IL-1β水平显著降低,IL-10水平显著升高(P<0.05,见表2)。

A.对照组 B.模型组 C.干预组图1 各组小鼠肠组织病理表现 (HE,×200)Figure 1 Pathology of intestinal tissues of mice in each group (HE,×200)
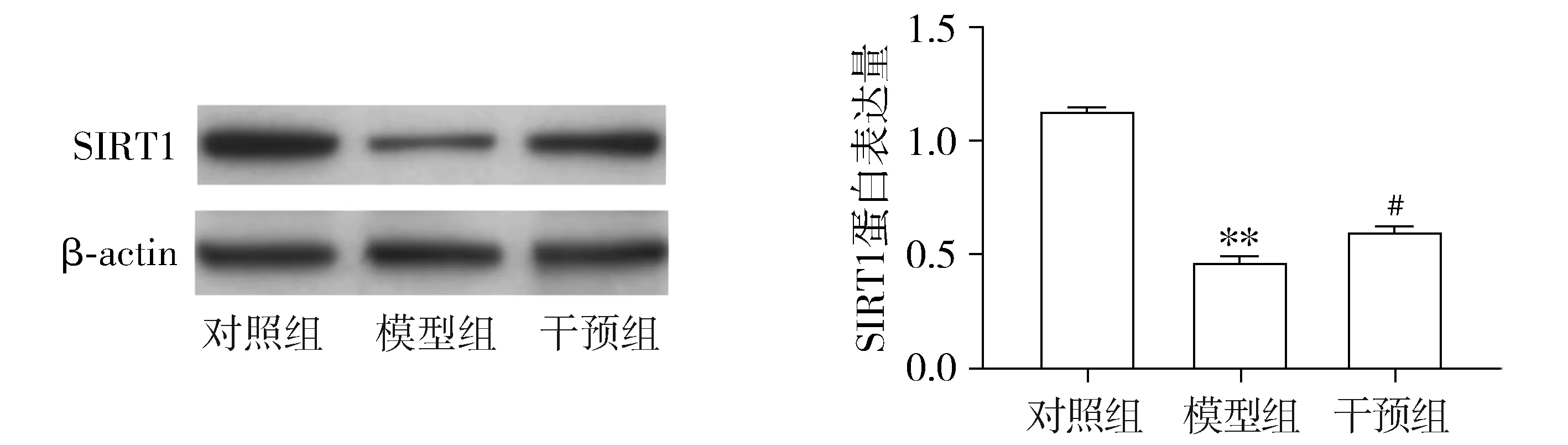
与对照组比较,**P<0.01;与模型组比较,#P<0.05图2 三组小鼠肠组织SIRT1蛋白的表达水平Figure 2 The expression level of SIRT1 protein in intestinal tissues of mice after different treatment

组别IL-6TNF-αIL-10对照组158.03±30.2130.90±6.1130.25±4.22模型组254.19±50.84a45.13±9.46a80.16±6.58a干预组201.25±41.26ab35.26±7.41ab38.28±5.49ab
与对照组比较,aP<0.05;与模型组比较,bP<0.05
2.5 qRT-PCR检测IL-6、IL-10、TNF-α mRNA表达水平
进一步qRT-PCR验证结果显示,模型组肠组织匀浆液中IL-6、TNF-α mRNA水平较对照组显著升高,IL-10 mRNA水平显著降低(P<0.05);与模型组比较,干预组肠组织匀浆液中IL-6、TNF-α mRNA水平显著降低,IL-10 mRNA水平显著升高(P<0.05,见图3)。

与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05图3 各组肠组织中IL-6、IL-10、TNF-α mRNA表达水平Figure 3 The expression levels of IL-6, IL-10 and TNF-alpha in intestinal tissues in each group
3 讨论
NEC是新生儿常见的胃肠道危重疾病,研究报道,NEC患儿中约90%为早产儿[7]。NEC新生儿致死率达20%-30%,致残率也较高,且存活患儿也可能出现发育障碍、短肠综合征等[8]。目前现有的手术治疗和药物治疗虽然能够在一定程度上缓解患儿症状,仍然会有预后不良反应。因此如何有效阻止黏膜的过度炎症反应对NEC患儿的治疗和预后具有重要意义。
LPS是革兰氏阴性细菌细胞壁的成分,是透过肠道黏膜屏障的炎症分子之一[9]。LPS可通过灌胃、腹腔注射等多种方式诱导NEC的发生,其主要通过启动炎性反应,促进肠道上皮坏死脱落发挥作用[10]。LPS在血液中与脂多糖结合蛋白(LBP)特应性结合形成复合物,促进炎症因子IL-6、TNF-α等表达,进而引起炎症级联效应[11]。本研究中采用鼠乳代用品人工饲养,低温缺氧诱导制备NEC模型,结果显示模型组小鼠出现不同程度的NEC症状,如腹胀、嗜睡、腹泻、瘦弱等,SIRT1激动剂干预组小鼠NEC症状较轻,提示SIRT1激动剂可在一定程度上减轻小鼠的NEC症状。与此同时,HE染色结果显示模型组肠组织有出血、水肿、肌层变薄,肠绒毛结构不完整等明显的炎症反应,干预组也出现上述情况,但较模型组轻微。
SIRT1是烟酰胺腺嘌呤二核苷酸(NAD+)的去乙酰化酶,是sirtuin蛋白家族中的一员[12]。研究报道,SIRT1蛋白具有抗炎抗氧化作用,可减少炎症作用引起的细胞损伤[13]。本研究分析了SIRT1在小鼠肠组织中的表达水平,检测结果显示,NEC模型小鼠肠组织SIRT1表达均显著降低,但SIRT1激动剂干预组较模型组显著升高,表明LPS处理可抑制SIRT1的表达,SIRT1激动剂干预可高表达SIRT1蛋白,而干预组小鼠肠黏膜损伤较轻,提示高表达SIRT1蛋白可减轻LPS诱导的小鼠NEC炎症反应。研究报道,SIRT1可通过减少炎症因子的释放水平减轻慢性炎症损伤[14]。SIRT1激动剂预处理可减轻肾脏、心脏、脑等组织损伤、减轻心肌细胞凋亡[15]。
IL-6可趋化中性粒细胞在炎症部位大量繁殖,并发挥细胞毒性作用,引起组织水肿、坏死。在小鼠结肠炎模型中,SIRT1激动剂可降低炎症因子IL-1β、IL-6的表达,减轻因炎症引起的肠黏膜损伤[16]。TNF-α参与活化多种炎性细胞,促进中性粒细胞和巨噬细胞释放过量氧自由基和蛋白酶,促进肠组织损伤[17]。研究报道SIRT1可通过抑制TNF-α的表达减轻肠上皮组织的炎症作用[18]。IL-10主要由巨噬细胞产生,是重要的免疫抑制因子,可抑制IL-1β、IL-6、TNF-α的表达[19]。IL-10基因敲除小鼠可引起致命性肠道炎症反应,提示缺少IL-10的免疫调节作用,肠道抗原可诱发炎症[20]。本研究ELISA及qRT-PCR结果均显示模型组小鼠IL-6、TNF-α水平较对照组显著升高,IL-10水平显著降低,SIRT1激动剂干预后IL-6、TNF-α水平显著降低,IL-10水平显著升高,提示LPS诱导可引起肠道炎症反应,SIRT1激动剂干预可有效增加IL-10水平,减轻IL-6、TNF-α水平,减弱炎症反应,减轻肠损伤。
综上所述,SIRT1在LPS诱导的NEC模型中表达降低,SIRT1激动剂干预后表达升高,其可通过抑制炎症反应减轻NEC症状,发挥对NEC小鼠肠组织的保护作用。
