广东石豆兰多糖的提取工艺及其抗氧化活性
2019-05-30苗永美孙佳琦徐荣华
苗永美,孙佳琦,徐荣华,汪 雁
安徽科技学院生命与健康科学学院,凤阳 233100
石豆兰属(Bublophyllum)为兰科最大的属,该属植物全世界约有1 000种,主要分布于亚洲、非洲和美洲热带地区。我国有一百多种,主要产于长江流域及其以南各省区,尤以云南南部为多[1],也有新种逐渐被发现的报道[2,3]。石豆兰属植物中有些种类是中草药,常作民间药用的有15种,包括广东石豆兰、麦斛等[1]。石豆兰以全草或假鳞茎或鲜草入药,具有清热、滋阴、消肿、抗癌、抗焦虑等功效[4]。
植物多糖因有增强和调节机体免疫功能,抗衰老,抗肿瘤,抗辐射等作用而受到广泛的重视[5]。兰科植物中石斛、天麻、白芨、芋兰、杜鹃兰、石豆兰等都是重要中药材,多糖是其主要药用成分之一。关于兰科植物多糖的研究,不同植物开展的广度和深度不同,石斛[6]、白芨[7]、金线莲[8]、石仙桃[9]、天麻[10]等植物体内多糖的研究比较多。石豆兰的研究相对较少,仅对其资源调查[1]、显微结构特征[11]、非多糖化学成分的分离鉴定[12]、药理[13]等几个方面有少量研究,关于石豆兰多糖的研究尚未见报道。
植物多糖的提取多采用水提法。赵会然等[14]对云南产的五种兰科植物滇西贝母兰(Coelogynecalcicola);喉红石斛(Dendrobiumchristyanum);密花毛兰(Erispicata);镰翅羊耳蒜 (Liparisbootanensis);温氏卷瓣兰 (Bulbophyllumwendlandianum)中的多糖采用传统水提法,苯酚-硫酸法检测,方法稳定、重复性好,并优化了温度、料液比和提取时间等工艺参数。因此本研究采用水溶剂提取、苯酚硫酸法检测,在单因素试验的基础上进行正交设计,考察液料比、提取温度和时间及沉淀多糖的乙醇浓度对多糖提取量的影响。并对广东石豆兰粗多糖的总还原力、DPPH自由基清除率、羟基自由基清除率、超氧阴离子清除率、Fe2+螯合率进行测定,评价其抗氧化活性。旨在为石豆兰功能性食品开发和利用提供理论依据和参考。
1 材料与方法
1.1 材料与试剂
石豆兰鲜样,经形态学鉴定属于广东石豆兰(Bublophyllumkwangtungense),采自福建屏南鸳鸯猕猴自然保护区。
浓H2SO4、苯酚、葡萄糖、氯仿、异戊醇、铁氰化钾、三氯乙酸、FeCl3、L-抗坏血酸、甲醇、乙醇、DPPH、FeSO4、水杨酸、H2O2、Tris、浓HCl、邻苯三酚、菲啰嗪、EDTA。
1.2 仪器
DGG-9140B型电热恒温鼓风干燥箱(上海森信试验仪器有限公司)、QE-100中草药粉碎机(浙江屹立工贸有限公司)、水浴锅(上海司乐仪器有限公司)、R205B旋转蒸发器(上海申顺生物科技有限公司)、ThermoHeraeus Multifuge X1R冷冻离心机、FD-ID-80冷冻干燥机(北京博医康实验仪器有限公司)、T6新世纪紫外可见分光光度计(北京普析通用仪器有限责任公司)。
1.3 试验方法
1.3.1 多糖提取工艺流程
鳞茎洗净、切片、50 ℃烘干 → 粉碎过60目筛 → 干粉 → 热水浸提液 → 离心、取上清液 → 浓缩 → 低温醇沉过夜 → 沉淀溶解 → Sevage法去蛋白 → 多糖溶液→冷冻干燥 → 粗多糖。
1.3.2 多糖含量的测定
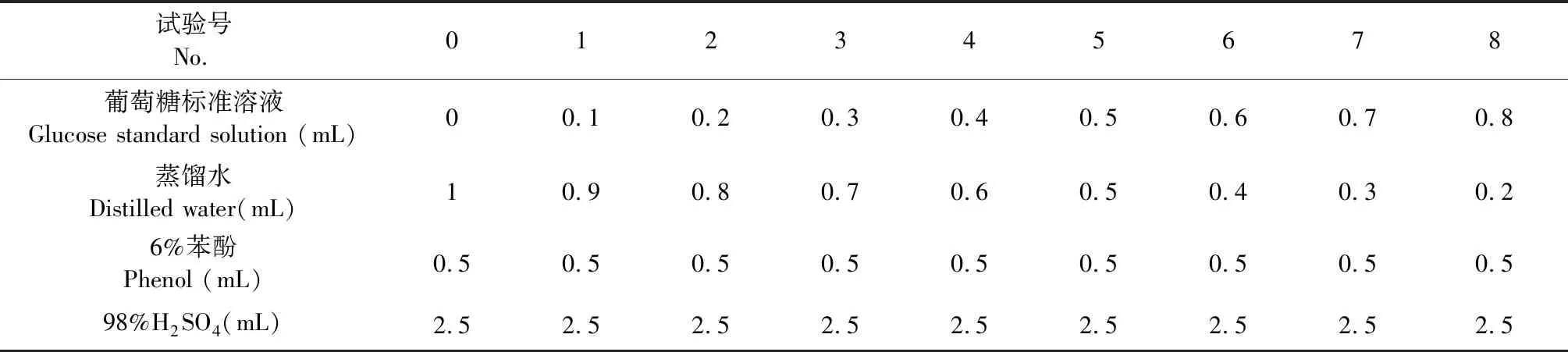
表1 标准曲线的绘制
采用赵会然的苯酚—硫酸法[14],体系略作改动,具体见表1,490 nm处测其吸光度值,绘制标准曲线得回归方程A=0.01C-0.029,R2=0.996 4。
样品液按上面步骤得糖浓度,按下式计算多糖提取量:
多糖提取量(mg/g)=(C×V×N)/1 000M
式中:C—多糖浓度(μg/mL),V—提取液总体积(mL),N—稀释倍数,M—干粉重量(g)。
1.3.3 单因素试验
准确称取干粉1.0 g,分别考察液料比、提取温度、提取时间和醇沉浓度4个因素对多糖提取的影响,每个实验重复三次。
1.3.3.1 液料比的选择
按液料比20∶1、30∶1、40∶1、50∶1、60∶1、70∶1、80∶1、90∶1、100∶1加入蒸馏水,80 ℃水浴提取3 h,80%乙醇沉淀多糖。
1.3.3.2 提取温度的选择
按液料比60∶1加入蒸馏水,分别在60、70、80、90、100 ℃下水浴提取3 h,80%乙醇沉淀多糖。
1.3.3.3 提取时间的选择
按液料比60∶1加入蒸馏水, 90 ℃下水浴提取2、3、4、5、6、7 h,80%乙醇沉淀多糖。
1.3.3.4 醇沉浓度的选择
按液料比60∶1加入蒸馏水, 90 ℃下提取6 h得多糖提取液,加入乙醇使终浓度分别达到70%、75%、80%、85%、90%、95%,冰箱沉淀过夜。
1.3.4 多糖提取的正交试验
据单因素试验结果,选择液料比(A)、提取温度(B)、提取时间(C )、醇沉浓度(D)合适水平,以多糖提取量为指标,进行L9(34)正交试验设计,对多糖的提取工艺进行优化,确定最佳工艺条件。
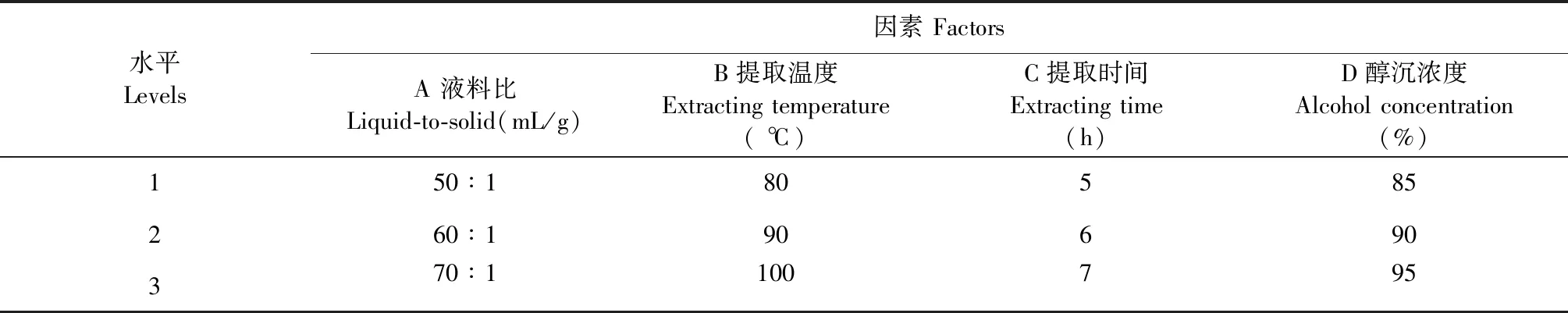
表2 L9(34)正交试验因素与水平
1.3.5 换算因子的计算
醇沉、离心后得到的湿多糖经冷冻干燥,得干品,配成1 mg/mL的多糖原液,稀释成100 μg/mL,按标准曲线操作步骤得葡萄糖浓度,按下列公式计算换算因素:F=C0/C1。
C1—按方程得出的葡萄糖浓度;C0—配制的多糖浓度。经计算得:F=100 μg/mL/36.73 μg/mL=2.72
1.3.6 抗氧化活性的测定
配制100 mg/mL的广东石豆兰多糖溶液,稀释成100、200、300、400、500 μg/mL五个浓度梯度(编号1~5),通过五个指标对石豆兰多糖抗氧化活性进行评价。
1.3.6.1 总还原力测定
还原力测定参考Apati等的方法[15],略作调整。取1~5号样品液1 mL于试管中,加入2.5 mL 0.2 mol/L PBS(pH6.6)和1%铁氰化钾, 50 ℃水浴20 min,取出后加入2.5 mL 10%三氯乙酸,摇匀、离心,吸取3.5 mL上清液加入新试管中,再加0.5 mL 0.1%的FeCl3溶液摇匀,静置4 min,测700 nm吸光度值;以相同浓度的L-抗坏血酸做阳性对照。
1.3.6.2 DPPH自由基清除能力测定
DPPH自由基清除测定参考Hatano等的方法[16],略作调整。各试管中分别加入1~5号样品液2.0 mL,再依次加2 mL的DPPH(0.2 mmol/L),暗反应30 min,测定517 nm的吸光度值,记A1;用甲醇代替DPPH测定样品的本底吸收,记A2;用蒸馏水代替样品作空白对照,记A0;L-抗坏血酸做阳性对照,浓度梯度为样品的1/10(编号1-5),平行3次,计算清除率(%)=[1-(A1-A2)/A0] ×100。
1.3.6.3 羟基自由基清除能力测定
各管中分加入1~5号样品液1.0 mL,再加 9 mmol/L FeSO41 mL,反应15 min后加9 mmol/L 水杨酸-乙醇溶液1 mL,最后加8.8 mmol/L H2O21 mL,37 ℃反应30 min,测510 nm的吸光度值,记A1;用蒸馏水代替H2O2测定样品的本底吸收值,记A2;以蒸馏水代替样品,记A0;相同浓度的L-抗坏血酸做阳性对照;平行3次,计算清除率(%)=[1-(A1-A2)/A0] ×100。
1.3.6.4 超氧阴离子清除能力测定
各管中分加入1~5号样品液1.0 mL,再分别加50 mmol/L Tris-HCl缓冲液(pH 8.2)3 mL,37 ℃水浴20 min,立即加37 ℃预热的7 mmol/L邻苯三酚1 mL,迅速摇匀倒入比色皿,325 nm处每30 s测吸光度值,连测4 min,计算每分钟变化值,记A1;蒸馏水代替样品,增加值记A0;以1/4样品浓度的L-抗坏血酸为阳性对照(编号1-5);平行3次,计算清除率(%)=(1-A1/A0)×100。
1.3.6.5 Fe2+螯合率测定
各管中分加入1~5号样品液1.0 mL,加0.1 mL 1 mmol/L 的FeSO4摇匀,静止15 min,加入0.2 mL 菲啰嗪(2.5 mmol/L)、3.7 mL蒸馏水,室温放置20 min,562 nm处测吸光值,记A1;用蒸馏水代替菲啰嗪,记A2;蒸馏水代替样品,记A0; 以1/10样品浓度的EDTA做阳性对照(编号1-5);平行3次,计算Fe2+螯合率 (%)=[1-(A1-A2)/A0] ×100。
1.3.7 数据处理
数据分析用Excel2010和SPSS19.0,绘图采用Origin2018软件。
2 结果与分析
2.1 单因素试验结果
2.1.1 液料比对多糖提取量的影响
从图1看出,多糖提取量随液料比增大呈先升后降趋势,在液料比20∶1时,多糖提取量仅为25.10 mg/g,多糖得率随液料比增大迅速增加,增加到60∶1时最高(65.40 mg/g),主要是大的溶剂量增加了物料与溶剂的接触面积、溶液传质推动力和浓度梯度,促使细胞壁破裂,多糖得以释放。当超过60∶1时,多糖提取率出现缓慢下降趋势,可能是多糖溶出已达饱和,增加溶剂量,不仅消耗能源,且后续纯化浓缩难度增加,导致多糖的损失增大。综合考虑,选择液料比60∶1(mL/g)更为合适。

图1 液料比对多糖提取量的影响Fig.1 Effect of liquid-to-solid on polysaccharide yield
2.1.2 提取温度对多糖提取量的影响
从图2看出,60~90 ℃范围内,多糖浸提量逐渐升高,可能是因为高温加快了溶剂的渗透和溶质的扩散,利于多糖的溶出,90 ℃时提取量最高(69.92 mg/g);但随着温度继续升高,多糖提取量反而下降,可能由于过高的温度加大了蛋白质凝固使多糖不易溶出,或者部分多糖发生了水解,又增加了杂质的溶出量。因此,温度以90 ℃为最佳。
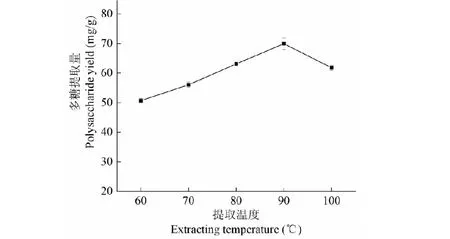
图2 提取温度对多糖提取量的影响Fig.2 Effect of extracting temperature on polysaccharide yield
2.1.3 提取时间对多糖浸提量的影响
由图3得知,多糖提取量随着时间延长而升高,5 h后迅速增加,6 h时最高(74.99 mg/g);时间过长不利于多糖的提取,可能是因为提取早期多糖的扩散速率逐渐增大,随着溶质在两相中浓度梯度差减小,扩散速度会越来越慢,待达到饱和后,多糖含量不再增加,如果继续加热提取,多糖会发生缩合、降解、氧化等化学反应,此外原料中的凝固蛋白质也不利于多糖的溶出,最终导致多糖得率下降。因此,提取时间6 h为宜。
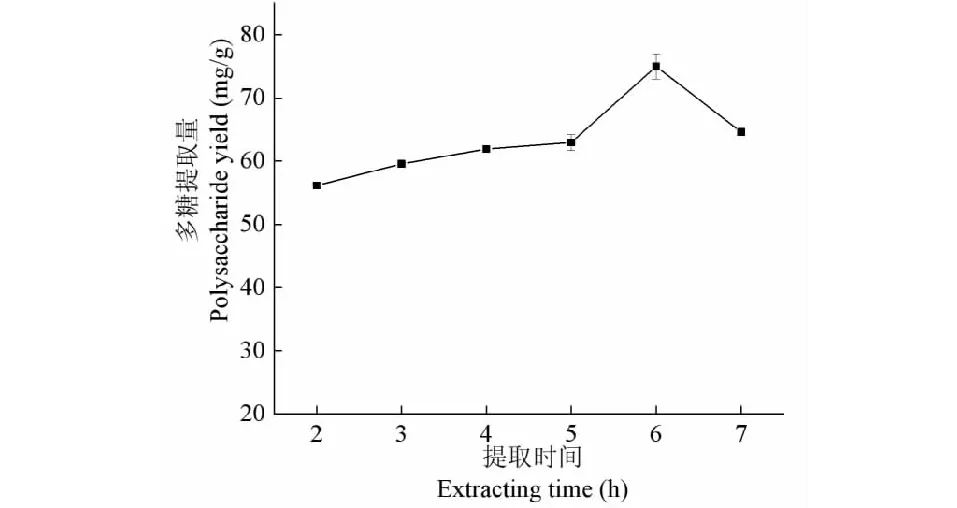
图3 提取时间对总黄酮浸提量的影响Fig.3 Effects of extracting time on polysaccharide yield
2.1.4 醇沉浓度对多糖提取量的影响
从图4看出,随着沉淀多糖所用乙醇浓度的提高,多糖得率逐渐升高,当乙醇浓度超过80%时,多糖得率增加缓慢,95%醇浓度沉淀出的多糖比90%醇浓度只增加了3.19%,因此,选择90%~95%的乙醇浓度沉淀石豆兰多糖均能得到理想结果。

图4 醇沉浓度对多糖提取量的影响Fig.4 Effect of the alcohol concentration on polysaccharide yield
2.2 正交试验
2.2.1 正交试验结果与分析
根据表3中R值大小可知,对多糖提取率的影响程度依次为:提取时间>提取温度>醇沉浓度>液料比,最佳提取工艺为A1B2C2D3,即液料比为50∶1(mL/g),温度为90 ℃,时间为6 h,醇沉浓度为95%。方差分析结果(表4)显示,四个因素的F值均大于F0.01,说明四个因素对多糖提取率的影响都达到了极显著水平。
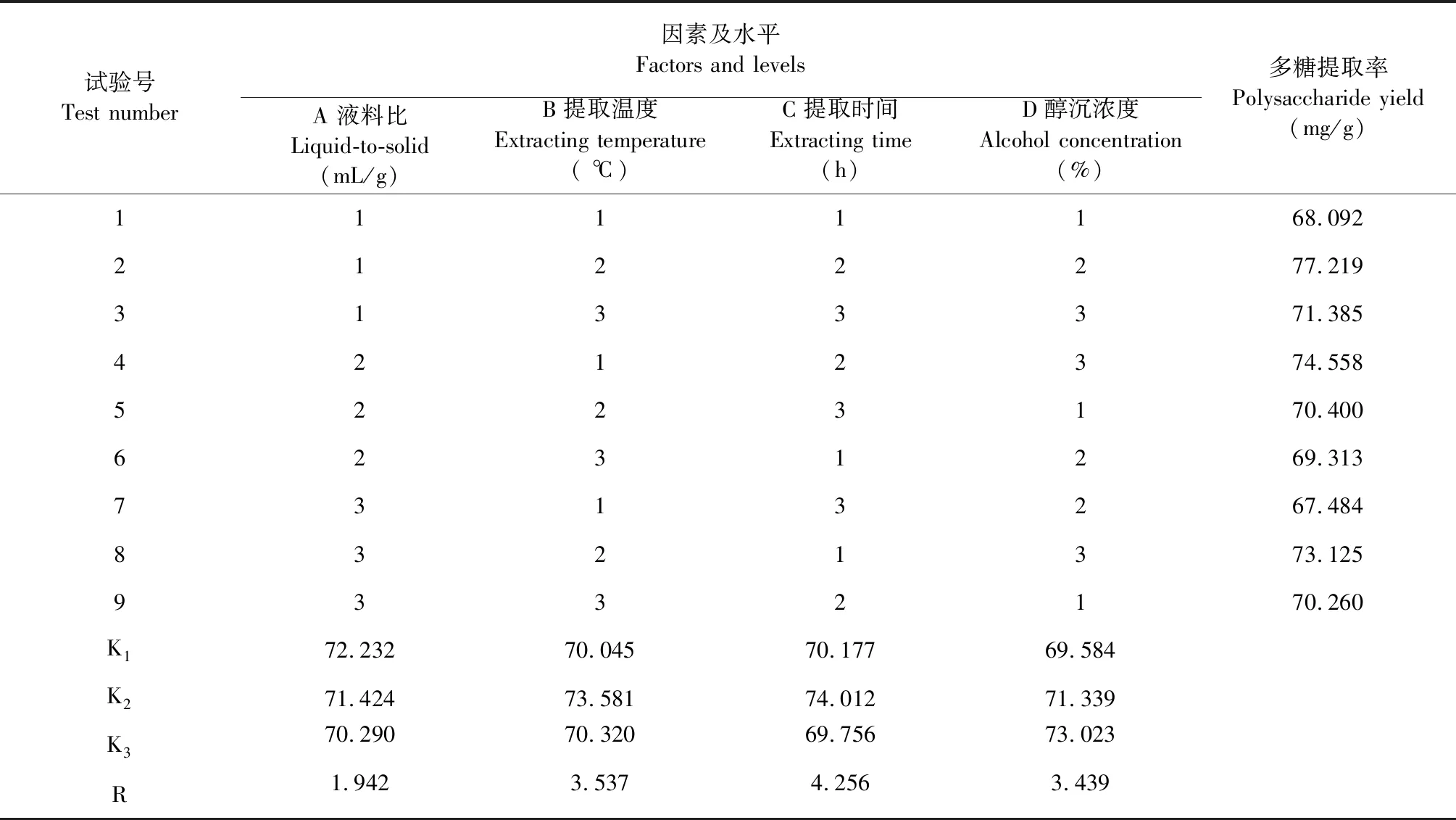
表3 L9(34)正交试验结果
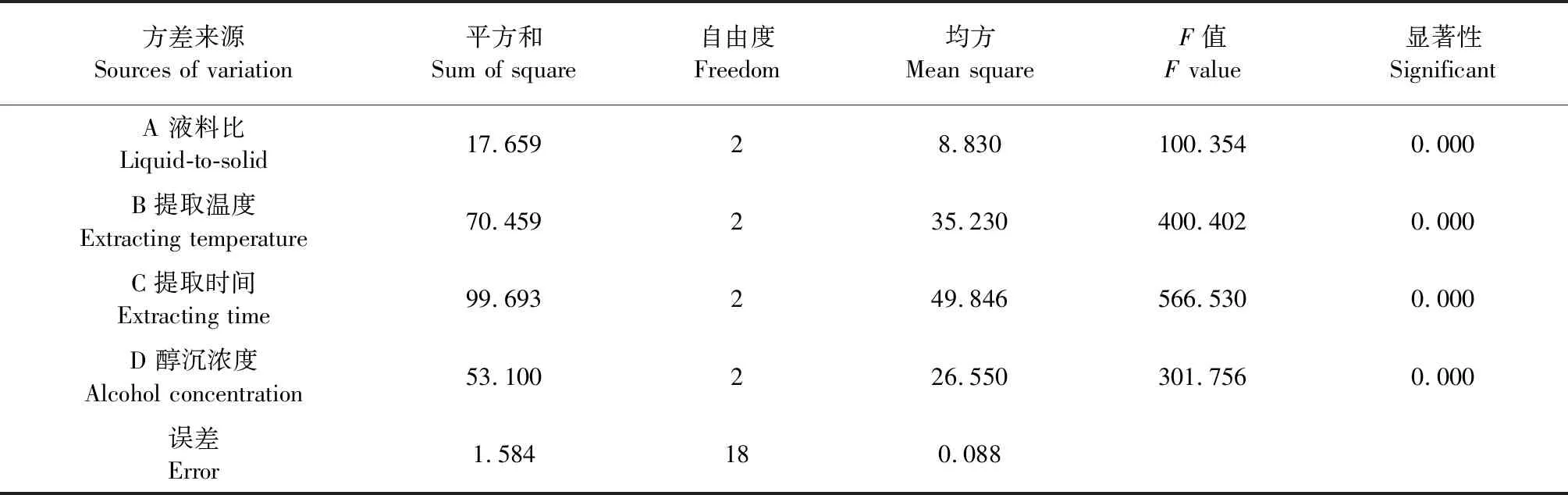
表4 方差分析
注:F0.05(2,2)=19.00,F0.01(2,2)=99.00。
Note:F0.05(2,2)=19.00,F0.01(2,2)=99.00.
2.2.2 最优工艺的验证性
按照正交设计优化出的最佳工艺条件A1B2C2D3进行提取,平行三次,结果见表5,多糖平均提取率为79.060 mg/g,RSD 值为0.132%(n=3)。计算结果表明,该提取工艺稳定可行。
2.3 多糖的抗氧化性
2.3.1 总还原力
以L-抗坏血酸为对照,测定广东石豆兰多糖的总还原力,结果见图5。总还原力随多糖浓度增加而升高,但低于同浓度的L-抗坏血酸,还原力为0.5对应的多糖和L-抗坏血酸质量浓度A0.5分别是5 061、174.87 μg/mL,其还原力为L-抗坏血酸的3.46%。总还原力是反映潜在抗氧化活性的重要指标,由此可见广东石豆兰多糖的还原力较小。
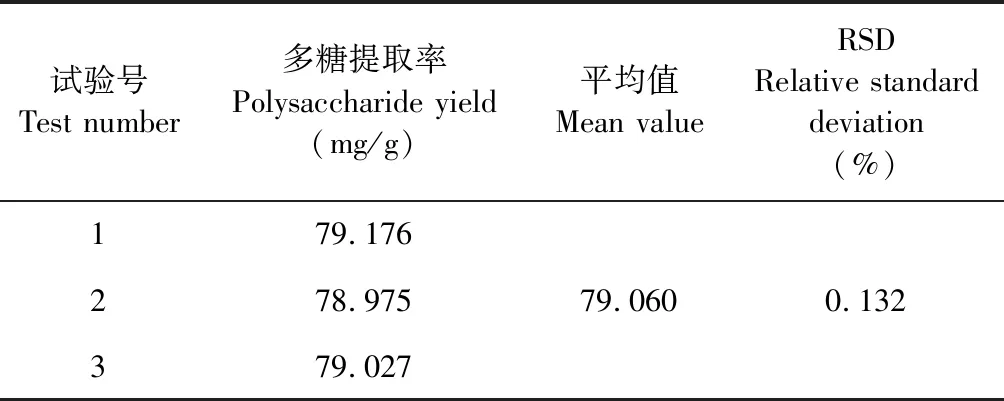
表5 验证性试验

图5 多糖的总还原力Fig.5 Total reducing power of polysaccharide
2.3.2 对DPPH自由基的清除能力
多糖和L-抗坏血酸对DPPH自由基的清除能力如图6所示,随着浓度的升高,清除率都呈上升趋势,但多糖上升缓慢,500 μg/mL比100 μg/mL的多糖对DPPH自由基清除率只提高了26.44%,大大

图6 多糖对DPPH自由基的清除效果Fig.6 Scavenging capacity to DPPH free radical of polysaccharide
低于阳性对照,多糖和L-抗坏血酸对DPPH自由基清除率达到50%时所需的效应浓度(EC50)分别为2769.58、18.80 μg/mL,得出多糖清除DPPH自由基的能力是L-抗坏血酸0.68%。
2.3.3 对羟基自由基的清除能力
多糖对羟基自由基清除能力如图7所示,随浓度增大,清除能力逐渐增强,基本呈线性增长;多糖和L-抗坏血酸对羟基自由基的EC50分别为 594.60、280.49 μg/mL,得出多糖清除羟基自由基的能力是L-抗坏血酸的47.17%。
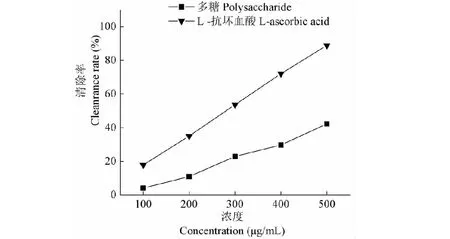
图7 多糖对羟基自由基的清除效果Fig.7 Scavenging capacity to hydroxy free radical of polysaccharide
2.3.4 对超氧阴离子清除能力
多糖对超氧阴离子清除能力如图8所示,随着浓度的增大,清除率逐渐提高,多糖的清除率稍高于1/4相同浓度的L-抗坏血酸的清除率,多糖和L-抗坏血酸对超氧阴离子的EC50分别为 586.94、170.20 μg/mL,得出多糖对超氧阴离子的清除能力是L-抗坏血酸的29.00%。
2.3.5 对Fe2+的螯合能力
如图9所示,多糖对Fe2+有一定的螯合能力,随着浓度升高,对Fe2+的螯合能力逐渐增强,当浓度达到300 μg/mL后,螯合能力上升减缓;所试的浓度范围内,多糖的螯合率低于1/10相同浓度EDTA的螯合率;多糖和EDTA对的Fe2+的螯合率EC50分别为 160.83、3.41 μg/mL,得出多糖对Fe2+的螯合力是EDTA的2.12%。

图8 多糖对超氧阴离子的清除效果Fig.8 Scavenging capacity to superoxide anion of polysaccharide
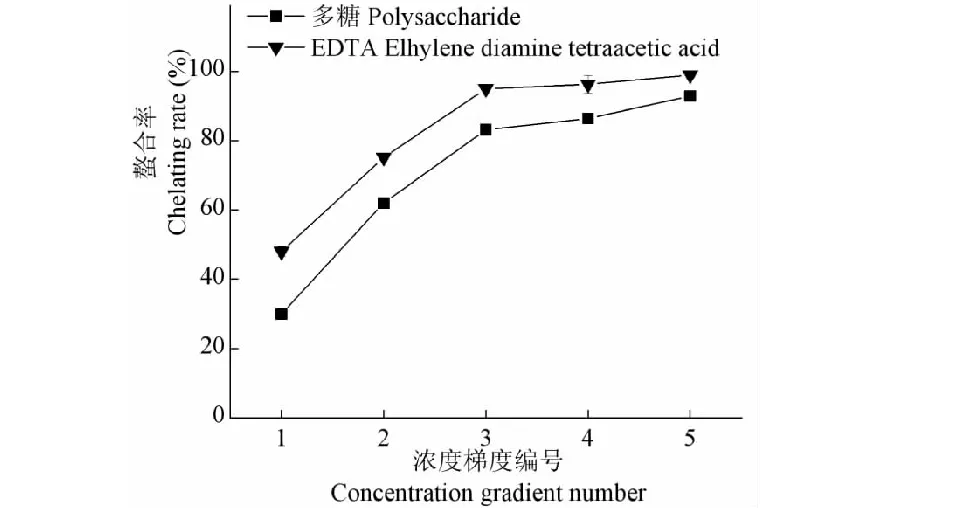
图9 多糖对Fe2+的螯合率Fig.9 Chelating rate to Fe2+ of polysaccharide
3 结论
本试验在参考前人研究基础上选用热水法提取石豆兰多糖,采用单因素结合正交试验设计,四个因素对多糖的提取率的影响依次为提取时间>提取温度>醇沉浓度>液料比,正交试验优化出的最佳工艺为A1B2C2D3,即液料比为50∶1(mL/g),提物温度为90 ℃,提取时间为6 h,醇沉浓度为95%,此工艺下,多糖的提取量为79.060 mg/g,RSD值为0.132%。
石豆兰多糖具有一定的抗氧化能力,总还原力为L-抗坏血酸的3.46%;清除DPPH自由基的能力较弱,清除羟基自由基和超氧阴离子的能力相对较强,清除能力分别是L-抗坏血酸的0.68%、47.17%和29.00%;对Fe2+的螯合能力是EDTA的2.12%。
