怀地黄叶片中总环烯醚萜苷及总苯乙醇苷含量快速分析模型的建立
2019-05-30耿晓桐王丰青谢彩侠陶晓赛李雅静雷敬卫
耿晓桐,王丰青,谢彩侠*,陶晓赛,李雅静,雷敬卫
1河南中医药大学,郑州 450046;2河南农业大学,郑州 450000
地黄为玄参科植物地黄 (RehmanniaglutinosaLibosch.) 的新鲜或干燥块根,具有清热生津之功效[1],主产于河南、山西、山东、河北等地,以“古怀庆府”(今河南的温县、沁阳、武陟、孟县等地)一带地黄栽培历史最长,俗称“怀地黄”,为我国“四大怀药”之一,也是我国具有特殊地理标志的常用大宗药材之一。
地黄中主要含有环烯醚萜苷类、苯乙醇苷类、紫罗兰酮类、糖类等化合物,地黄叶片作为地黄植株重要的部位,在地黄整个生长发育期内的生物量较高,而且含有多种化学成分[2]。研究表明,地黄叶片中部分苯乙醇苷和环烯醚萜苷类成分含量高于地黄块根[3,4],作为商品药材,地黄叶被收载于 1988年版《北京市中药材标准》[5]。近几年,随着地黄的临床应用和研究的不断深入,地黄在方剂中的使用频率明显增多。另外,由于市场上具有清凉滋补的地黄保健食品的开发,使地黄的市场需求量不断增加,但由于地黄的连作障碍和土地资源有限等原因导致地黄资源相对紧缺,因此地黄叶的开发利用开始逐渐被研究者所关注。
中药药效的发挥往往是多个有效部位群整体协同作用的结果,总环烯醚萜苷和总苯乙醇苷作为地黄中重要的两类有效成分[6],其含量的高低在一定程度上可以反映地黄叶片质量的优劣,因此建立一种可以快速检测总环烯醚萜苷及总苯乙醇苷含量的方法对于地黄叶片的质量评价及资源利用具有重要的意义。目前常规测定中药中总环烯醚萜苷及总苯乙醇苷含量所采用的方法有紫外可见分光光度法、HPLC法[7,8]、UPLC-MS法[9]、聚酰胺吸附法[10]、二阶导数光谱法[11]等,但地黄样品用于测定总苯乙醇苷及总环烯醚萜苷的含量测定基本均用紫外分光光度法[12,13],综合考虑到紫外分光光度法处理较为复杂、误差来源较多、试剂用量较大,污染较为严重,近红外光谱法作为一种无损、快速、绿色的分析方法已经广泛的应用于中药的质量分析中[14,15],而地黄叶片中总环烯醚萜苷及总苯乙醇苷含量快速测定方法的研究未见报道。基于此,本研究以不同种质的怀地黄为研究对象,采集其生育期内的地黄叶片,利用紫外可见分光光度法结合化学计量学软件建立怀地黄叶片中总环烯醚萜苷和总苯乙醇苷含量的测定方法,以实现地黄叶片质量的快速评价和合理利用。
1 仪器与试药
1.1 仪器
万分之一电子天平(METTLER TOLEDO梅特勒-托利多仪器上海有限公司)、HH-S2双孔智能水浴锅(巩义市予华仪器有限责任公司)、Nicolet 6700 型傅立叶变换近红外光谱仪(美国Thermo Nicolet 公司) 、紫外-可见分光光度计(EVOLUTIION 260 BIO,Thermo)、石英比色皿(宜兴市银星分析器件厂)。
1.2 试剂
毛蕊花糖苷(四川省维克奇生物科技有限公司,批号:MUST-17020715)、梓醇(成都曼思特生物科技有限公司,批号:MUST-17102510)、甲醇(分析纯,天津市致远化学试剂有限公司)、无水乙醇(天津市致远化学试剂有限公司,分析纯)、2,4-二硝基苯肼(天津市大茂化学试剂厂)、盐酸(烟台市双双化工有限公司)、氢氧化钠(天津市恒兴化学试剂制造有限公司)、蒸馏水(郑州山溪泉蒸馏水有限公司)。
1.3 实验样品
实验以金九、白变、山东、BJ-1、QH-1、85-5等六个常见地黄种质的叶片为研究对象,每次每个种质随机选取5株作为一个样品,每次每个种质共收集10株,即两份样品。从6月~12月整个生育期内收集了六个种质地黄叶片共128份。将地黄叶片洗净,在真空干燥箱中55 ℃烘干,经高速万能粉碎机粉碎后过50目筛,保存于干燥器中备用。
2 结果与分析
2.1 怀地黄叶片近红外光谱的采集
取适量怀地黄叶片粉末平铺于近红外光谱仪的样品杯中,采用积分球漫反射法,在光谱范围12 000~4 000 cm-1、分辨率8 cm-1、扫描次数64的条件下获取128份地黄叶片样品近红外光谱图。每份样品重复扫描3次,取其平均光谱作为每份样品的最终光谱,叶片的近红外原始光谱叠加图见图1。

图1 128份地黄叶片的近红外原始光谱叠加图Fig.1 128 near infrared primordial spectral superposition of Rehmannia glutinosa leaves
2.2 地黄叶片中总环烯醚萜苷含量的测定[4]
2.2.1 供试品溶液的制备
精确称量地黄叶片粉末1 g,加70%乙醇10 mL超声45 min,补足重量,过滤后定容至50 mL容量瓶中,摇匀。精密量取2.5 mL于50 mL容量瓶中,加70%乙醇定容,摇匀,即得地黄叶片的供试品溶液。
2.2.2 对照品溶液的制备
精确称量梓醇对照品 5.21 mg 置于25 mL量瓶中,加70%乙醇溶液定容即得。
2.2.3 样品的含量测定
采用外标法进行含量测定,精密量取地黄叶片的供试品溶液1 mL,置于10 mL容量瓶中,加入1 mol/L盐酸溶液2 mL,摇匀,90 ℃水浴15 min,室温静置放冷,加二硝基苯肼乙醇溶液 0.5 mL,摇匀,90 ℃水浴25 min,室温静置 15 min 放冷,再加入 1mol/L NaOH 70%乙醇溶液 3 mL,摇匀,室温静置1 h。以 70% 乙醇作为空白对照,测定462 nm下的吸光度。每份样品重复三次,结果取三次平均值为一组数据,共测得两份数据,以保证数据的准确性。地黄叶片中总环烯醚萜苷的含量测定结果见表1。
2.2.4 方法学考察
2.2.4.1 标准曲线的制备
分别精密量取2.2.2项下梓醇对照液1.5、2.0、2.5、3.0、4.0 mL 于10 mL 容量瓶中,加70 %乙醇定容,即对照品浓度分别为0.031 3、0.041 7、0.052 1、0.062 5、0.083 4 mg/mL。制备方法同供试品,在462 nm波长下测定吸光度,重复测定三次,取其平均值。以吸光度(A)为纵坐标,对照品浓度(C)为横坐标绘制标准曲线,得回归方程y=10.609x-0.091 8,R2=0.995 5,结果表明梓醇浓度在0.031 3~0.083 4 mg/mL-1范围内与吸光度呈良好的线性关系。

图2 地黄叶片总环烯醚萜苷类含量标准曲线Fig.2 Standard curve of total iridoid glycosides in Rehmannia glutinosa leaves
2.2.4.2 精密度试验
取同一供试品溶液按2.2.3项下方法连续测定5次,记录吸光度,RSD为1.14%。说明仪器的精密度良好。
2.2.4.3 稳定性试验
取同一供试品溶液按2.2.3项下方法于0、30、60、90、120 min连续测定5次,记录吸光度。RSD为0.71%。说明供试品溶液在2 h内稳定。
2.2.4.4 重复性试验
称量同一样品5份,按照2.2.1项下方法制得供试品,按照2.2.3项下方法测定吸光度,RSD为2.08%。说明该方法重复性好。
2.3 地黄叶片中总苯乙醇苷含量的测定[16]
2.3.1 供试品溶液的制备
称取地黄叶片粉末约1 g,精密称定,置于具塞锥形瓶中,精密加入60%甲醇50 mL,称定重量。超声处理30 min后放至室温,补足重量,摇匀,过滤。精密量取续滤液1 mL,至50 mL容量瓶中,60%甲醇定容即得地黄叶片的供试品溶液。
2.3.2 对照品溶液的制备
取毛蕊花糖苷对照品1.21 mg于10 mL容量瓶中,甲醇定容即得。
2.3.3 样品的含量测定
采用外标法进行含量测定,取地黄叶片的供试品溶液于比色皿中,用紫外分光光度计在334 nm处测量吸光度,每份样品重复三次,取三次结果的平均值为一组数据,每份样品共测得两组数据,以确保数据的准确度。地黄叶片中总苯乙醇苷的含量测定结果见表2。
2.3.4 方法学考察
2.3.4.1 标准曲线的制备
精密吸取2.3.2项下毛蕊花糖苷对照品储备液0.5、0.6、0.7、1.0、1.2、1.8 mL分别置于5 mL容量瓶中,用甲醇稀释并定容至刻度,摇匀,即对照品浓度分别为0.012 1、0.014 5、0.016 9、0.024 2、0.029 0、0.043 5 mg/mL。同时以相应的溶剂作空白,于 334 nm 波长处测定各对照品溶液的吸光度,重复测定三次,取其平均值。以吸光度(A)为纵坐标,对照品浓度(C)为横坐标绘制标准曲线,得回归方程y=25.9 4x+0.078 1,R2=0.992 5。结果表明,毛蕊花糖苷质量浓度与吸光度在0.012 1~0.043 5 mg/mL范围内呈良好的线性关系。
2.3.4.2 精密度试验
取同一供试品溶液按2.3.3项下方法连续测定5次,记录吸光度,RSD为2.04%。说明仪器的精密度良好。
2.3.4.3 稳定性试验
取同一供试品溶液按2.3.3项下方法于0、30、60、90、120 min连续测定5次,记录吸光度。RSD为1.25%。说明供试品溶液在2 h内稳定。
2.3.4.4 重复性试验
称量同一样品5份,按照2.3.1项下方法制得供试品,按照2.3.3项下方法测定吸光度,RSD为1.65%。说明该方法重复性好。

表1 地黄叶片中总环烯醚萜苷的含量测定结果(%)
续表1(Continued Tab.1)
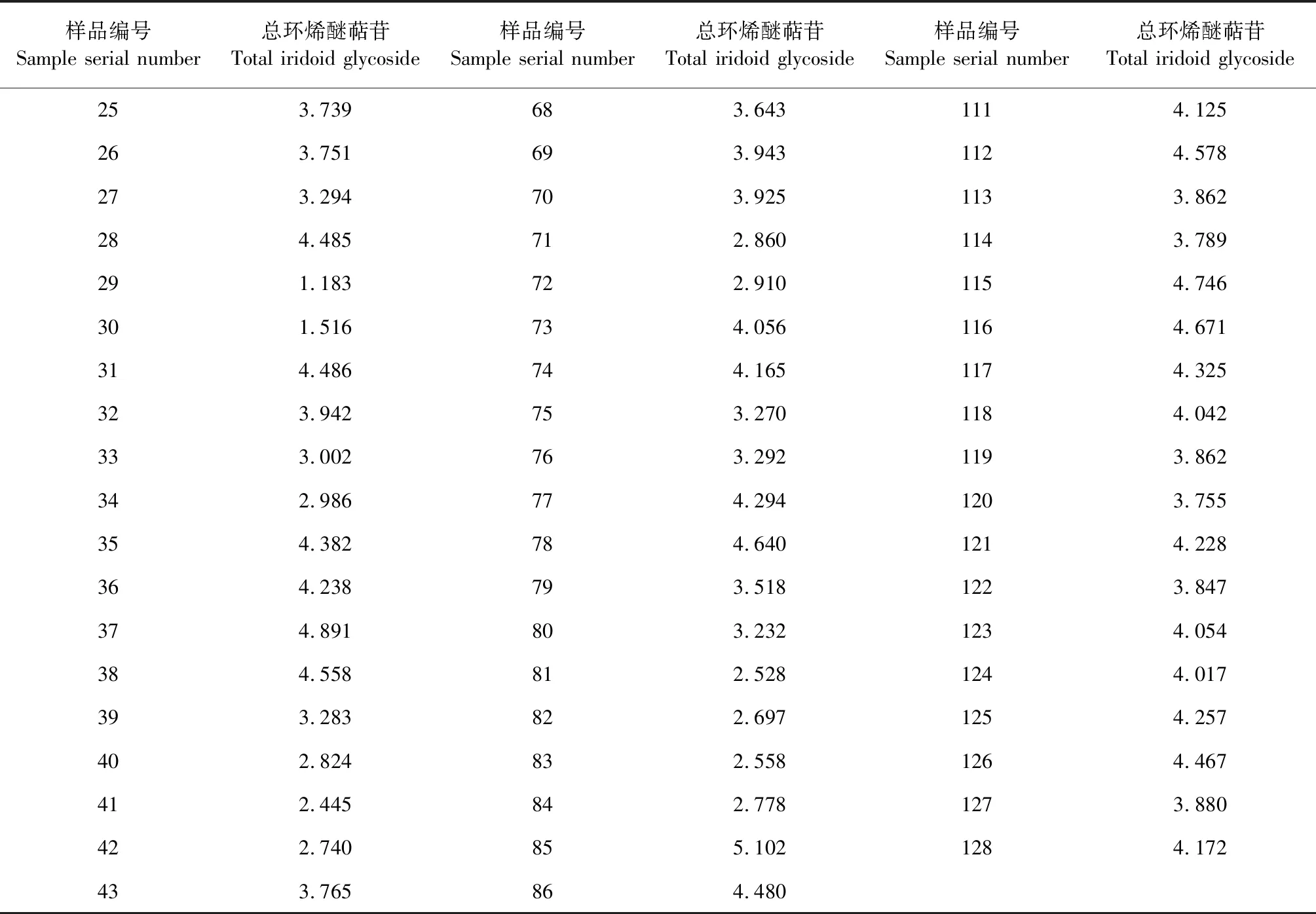
样品编号Sample serial number总环烯醚萜苷Total iridoid glycoside样品编号Sample serial number总环烯醚萜苷Total iridoid glycoside样品编号Sample serial number总环烯醚萜苷 Total iridoid glycoside253.739683.6431114.125263.751693.9431124.578273.294703.9251133.862284.485712.8601143.789291.183722.9101154.746301.516734.0561164.671314.486744.1651174.325323.942753.2701184.042333.002763.2921193.862342.986774.2941203.755354.382784.6401214.228364.238793.5181223.847374.891803.2321234.054384.558812.5281244.017393.283822.6971254.257402.824832.5581264.467412.445842.7781273.880422.740855.1021284.172433.765864.480

表2 地黄叶片中总苯乙醇苷含量测定结果(%)
续表2(Continued Tab.2)

样品编号Sample serial number总苯乙醇苷Total iridoid glycoside样品编号Sample serial number总苯乙醇苷Total iridoid glycoside样品编号Sample serial number总苯乙醇苷Total iridoid glycoside164.097592.4941024.162173.122602.5911037.409183.045612.7171047.197195.275622.8421052.681205.291635.1761062.668213.942645.1471076.089223.917655.0331086.095231.940665.1871093.562241.917672.8321103.527256.001682.7801116.881266.197693.6331126.955273.063703.5401132.406283.197711.4201142.409294.875721.4651153.288304.175734.1091163.385314.039743.8011176.880323.943753.5201186.954331.782763.5411194.822341.849773.3991204.787353.464783.7951214.778363.362793.8901224.884376.235803.9991234.926385.994811.7831244.958394.432821.8241252.535404.413830.985 1262.593412.443840.979 1271.598422.456854.9221281.974435.091865.127
注:1-24为85-5地黄生育期内的样品,25-48为BJ-1地黄生育期内的样品,49-72为白变地黄在生育期的样品,73-96为金九地黄在生育期内的样品,97-112为山东地黄生育期内的样品,113-128为QH-1地黄在生育期内的样品。
Note:1-24 is 85-5 Rehmannia glutinosa growing period sample.25-48 is BJ-1 Rehmannia glutinosa growing period sample.49-72 is Baibian Rehmannia glutinosa growing period sample.73-96 is the sample of Jinjiu Rehmannia glutinosa in the growing period.97-112 is the sample of Shandong Rehmannia glutinosa in the growing period, and 113-128 is the sample of QH-1 Rehmannia glutinosa in the growing period.
2.4 地黄叶片中总环烯醚萜苷及总苯乙醇苷近红外定量分析模型的建立
2.4.1 校正集和验证集样品的选择
根据“2.2”项下地黄叶片中总环烯醚萜苷含量及“2.3”项下地黄叶片中总苯乙醇苷苷含量的分布,按照校正集和验证集样品数为4∶1的比例、验证集样品的含量范围在校正集的含量范围之内的原则,总环烯醚萜苷模型随机选取102个地黄叶片样品作为校正集、24个地黄叶片样品作为验证集,总苯乙醇苷模型随机选取103个地黄叶片样品作为校正集、25个叶片样品作为验证集,分别建立地黄叶片中总环烯醚萜苷及总苯乙醇苷的定量分析校正模型,校正集和验证集的样品信息见表3、表4。

表3 地黄叶片校正集和验证集样品总环烯醚萜苷分布范围

表4 地黄叶片校正集和验证集样品总苯乙醇苷分布范围
2.4.2 光谱预处理方法的选择
不同种质生育期内的地黄叶片由于发育程度、物理性质及测定条件等的差异,会引起光谱基线的漂移以及斜率的变化,进而影响模型的预测性能。当模型的内部交叉验证决定系数(R2)接近于1,校正均方根偏差(RMSEC)和预测均方决定差(RMSEP)差别较小时模型的预测能力较强,因此我们以上述参数为指标,考察了不同光谱预处理方法对模型性能的影响,以选择最优的预处理方法,结果见表5、表6。
表5不同光谱预处理方法对地黄叶片总环烯醚萜苷定量校正模型性能的影响
Table 5 Effect of different spectral pretreatment methods on quantitative calibration model of total iridoid glycosides in leaves of Rehmannia glutinosa

光谱预处理方法R2RMSEPRMSEC多元散射校正MSC0.951 80.303 00.339 0标准归一化SNV0.957 30.265 00.319 0一阶导数First derivative0.972 10.095 40.259 0二阶导数Second derivative0.964 30.156 00.292 0SNV+First derivative0.966 40.130 00.284 0MSC+First derivative0.961 70.200 00.303 0MSC+Second derivative0.968 50.167 00.275 0SNV+Second derivative0.961 40.183 00.304 0MSC+SD+卷积平滑SG0.968 80.184 00.273 0MSC+SD+直接差分法ND0.923 90.443 00.422 0
表6不同光谱预处理方法对地黄叶片总苯乙醇苷定量校正模型性能的影响
Table 6 Effect of different spectral pretreatment methods on quantitative calibration model of total phenylethanol glycosides in leaves ofRehmanniaglutinosa

光谱预处理方法R2RMSEPRMSECMSC0.997 00.1600.116 0SNV0.997 70.1700.101 0MSC+FD0.998 00.2110.095 3MSC+SD0.998 20.1420.089 9SNV+FD0.997 50.2680.106 0MSC+FD+SG0.998 10.2580.091 4SNV+FD+ND0.996 30.2430.129 0
结果表明地黄叶片中总环烯醚萜苷及总苯乙醇苷原始光谱分别选用constant+FD、MSC+SD的光谱预处理方法可以获得预测性能较好的模型。
2.4.3 建模区间的选择
近红外光谱主要反映基团伸缩振动产生的倍频峰、组频峰的信息,由于倍频峰及组频峰峰强较弱不易区分,各峰重叠严重,因此冗余信息以及噪音干扰较大。为了获取与待测组分含量相关的最大信息量,以建立最优的预测模型,我们对不同波段范围所建模型的性能进行考察,以筛选最优建模区间,结果见表7、表8。

表7 光谱范围对地黄叶片总环烯醚萜苷定量校正模型性能的影响

表8 光谱范围对地黄叶片总苯乙醇苷定量校正模型性能的影响
通过TQ 8.0软件分析各波段范围所对应的R2、RMSECV值可知,地黄叶片总环烯醚萜苷及总苯乙醇苷定量分析模型的最佳建模区间均为11 998.9 3~3 999.63 cm-1。
2.4.4 主因子数的选择
在相同的校正集样品下,主因子数的选择对模型的稳定性和NIR预测结果有较大影响,主成分数过少或过多均影响模型的预测准确性。本研究以RMSECV为评价模型性能参数,选择RMSECV最小时的因子数即为最佳主因子数。结果见图4。由图知,地黄叶片总环烯醚萜苷及总苯乙醇苷定量校正模型的最佳主因子数分别为7和9。

图4 主因子数对RMSECV的影响Fig.4 Effects of principal factor numbers on RMSECV注:A.总环烯醚萜苷;B.总苯乙醇苷。Note:A.Total iridoid glycosides;B.Total phenylethanol glycoside.
2.4.5 地黄叶片中总环烯醚萜苷及总苯乙醇苷定量模型的建立
分别以103个地黄叶片总环烯醚萜苷样品和102个地黄叶片总苯乙醇苷样品为校正集,利用TQ 8.0分析软件结合PLS 法,分别选择最佳的光谱预处理方法、建模波段和主因子数建立地黄叶片中总环烯醚萜苷及总苯乙醇苷的定量分析模型。地黄叶片中总环烯醚萜苷及总苯乙醇苷NIR预测值与参考值的相关图及偏差图见图5、图6。

图5 地黄叶片中总环烯醚萜苷含量NIR预测值与参考值之间的相关图与偏差图Fig.5 Correlation and deviation between NIR predicted value and reference values of total iridoid glycosides in leaves of Rehmannia glutinosa注:A 相关图;B 偏差图。Note:A.correlation;B.deviation.

图6 地黄叶片中总苯乙醇苷含量NIR预测值与参考值之间的相关图与偏差图Fig.6 Correlation and deviation between NIR predicted value and reference values of total phenethyl glucoside in leaves of Rehmannia glutinosa 注:A 相关图;B 偏差图。Note:A.correlation;B.deviation.
2.4.6 地黄叶片中总环烯醚萜苷和总苯乙醇苷定量模型的验证
分别将24份总环烯醚萜苷验证集样品和25份总苯乙醇苷验证集样品的近红外光谱图输入到相应的近红外定量模型中,将总环烯醚萜苷及总苯乙醇苷含量的NIR预测值与实测值进行比较,结果见表9、表10。由表知,NIR模型预测总环烯醚萜苷及总苯乙醇苷的含量结果与常规的UV法测定的数据比较接近,绝对及相对偏差较小;且总环烯醚萜苷配对样本t检验结果显示t=0.240,P=0.813>0.05,总苯乙醇苷配对样本t检验结果显示t=1.296,P=0.207>0.05。以上结果表明预测值与实测值的差异无统计学意义,说明两个模型的预测性能较好,可以用于地黄叶片中总环烯醚萜苷及总苯乙醇苷的含量测定。
3 讨论
近红外光谱技术作为一种间接的分析方法,它主要运用化学计量学软件从样品复杂的背景与谱峰重叠的近红外光谱图中提取和样品性质相关的信息,建立光谱特征与样品性质等之间关系的数学模型,可用于物质的定量及定性分析。一般情况下,在待测组分含量高、样品数量多、样品代表广泛、基础数据测定准确、仪器性能稳定的条件下所建立的模型性能相对较好。本研究结果表明,总环烯醚萜苷及总苯乙醇苷作为地黄重要的有效成分,在地黄叶片中含量较高,比较适合于利用近红外光谱法进行快速测定。另外,不同种质生育期内地黄叶片中苯乙醇苷类和环烯醚萜苷类成分差异较大,为了保证样品的代表性,我们以道地产区的金九、白变、山东、BJ-1、QH-1、85-5等六个常见地黄种质在不同生育期内的地黄叶片为研究对象,经过基础数据测定、建模条件的优选,建立了可以相对准确的预测怀地黄中总环烯醚萜苷及总苯乙醇苷含量的近红外地定量分析模型,为怀地黄叶片的快速质量评价提供一种可参考的方法。

表9 24份总环烯醚萜苷验证集样品的NIR预测结果(%)

表10 25份总苯乙醇苷验证集样品的NIR预测结果(%)
续表10(Continued Tab.10)

样品编号Sample serial number测定值Measured value预测值Predictive value绝对偏差Absolute deviation相对偏差Relative deviationP523.3643.300-0.064-0.020533.4033.399-0.004-0.001655.0335.1120.0790.016693.6333.6940.0610.017711.4201.361-0.059-0.042773.9993.907-0.092-0.023840.9791.0140.0350.036914.8624.802-0.060-0.012943.6053.6250.0200.0061003.1653.137-0.028-0.0091014.2044.116-0.088-0.0201024.1624.116-0.046-0.0111052.6812.653-0.028-0.0101142.4092.4130.0040.0021214.7784.8080.0300.0061252.5352.5570.0220.009
地黄种植区域广泛,因受自然环境、生产种植、采收加工、杂交和变异及人文环境等多因素影响,最终形成了一系列地黄栽培种及其变种,而且不同种质和产地的地黄叶片色泽、厚度、化学质量特征及近红外光谱特征都存在一定的差异。本研究主要利用怀地黄产区不同种质及生育期的地黄叶片的相关信息,经过对光谱背景的处理,初步建立了怀地黄叶片中总环烯醚萜苷及总苯乙醇苷的定量分析模型,但模型中并没有包括不同产地的地黄叶片信息,因此模型的使用范围还受到一定的限制,后期还有待于继续丰富地黄叶片样本,进一步完善和优化模型,为快速检测地黄叶片的质量以合理开发利用地黄叶片资源提供一种简便可行的方法。
