肌萎缩侧索硬化患者早期选择性损害快速传导运动神经元的电生理研究
2019-05-30王恒恒潘华张在强陈娜翦凡张磊王颖陈琳
王恒恒 潘华 张在强 陈娜 翦凡 张磊 王颖 陈琳
肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)是进行性上下运动神经元变性导致的致死性疾病。ALS患者运动神经传导检测结果可出现由运动神经元丢失导致的复合肌肉动作电位(compound muscle action potentials,CMAP)下降;同时,部分患者可出现传导速度轻度下降[1]。研究结果显示,34%的ALS患者上肢运动末端潜伏期(distal motor latency,DML)延长[2],但延长超过上肢DML正常值的25%者很少见[3],远未达到脱髓鞘病变的程度,研究者将此归因于快传导运动神经元的丢失。
既往研究通过检测早期ALS患者无严重失神经支配的肌肉发现其F波潜伏期轻度延长[4-5]。F波最小潜伏期(F wave minimal latency,Fmin)是反映快传导的大运动神经元及其支配纤维功能状况的敏感指标,而F波最大潜伏期(F wave maximal latency,Fmax)则是反映慢传导的小运动神经元及其支配纤维功能状况的指标。因此理论上Fmin延长更能提示ALS早期即可能出现选择性累及快传导的大运动神经元,然而目前并没有研究证实这一假设。本研究通过分析ALS患者正中神经DML、Fmin与CMAP负波波幅、负波面积之间的关系,旨在寻找ALS早期快传导的大运动神经元优先受累的证据。
1 对象和方法
1.1 对象收集2016年1月至2018年7月就诊于作者医院门诊的ALS患者42例,其中男26例,女16例,平均年龄(56.5±11.6)岁,平均身高(164.6±7.6)cm。其中确诊ALS 9例,很可能14例,实验室支持很可能19例。上肢起病21(50.0%)例,球部起病12(28.6%)例,下肢起病9(21.4%)。病程3~48个月,平均(14.0±8.5)个月。ALS入组标准:(1)符合世界神经病学联盟ALS临床诊断标准(修订的EI Escorial诊断标准)[6];(2)双下肢肌力≥4级〔英国医学研究委员会(Medical research council,MRC)肌力分级法〕且至少一侧拇短展肌肌力≥3级;(3)排除颈椎病、脑血管病、糖尿病或其他代谢性原因所致神经系统疾病。另选取健康自愿受检者46名为对照组,其中男27名,女19名,平均年龄(56.3±12.0)岁,平均身高(164.6±7.4)cm。两组间性别构成、年龄和身高比较差异无统计学意义(P>0.05)。本研究获首都医科大学北京天坛医院伦理委员会批准通过,研究对象均知情同意。
1.2 方法
1.2.1 临床评估:采用ALS功能量表(ALS functional rating scale,ALSFRS;总分40分)及上肢功能亚组评分(包括书写、使用餐具和穿衣洗漱,共12分)评估ALS患者的功能状态,评分越高,表示功能损害越轻,病程越早。采用MRC肌力分级法评估患者上下肢肌力。
1.2.2 常规神经传导检测:采用Nicolet EDX肌电图仪进行常规肌电图检查。所有受试者取仰卧位,保持皮肤温度>32℃,进行正中神经运动传导检测。收集症状较轻一侧(拇短展肌肌力≥3级侧)正中神经传导检测结果,参数指标包括DML、腕部CMAP峰峰波幅、负波波幅、负波面积和腕-肘传导速度。
1.2.3 正中神经F波检测:对所有受试者腕横纹近端3 cm处进行连续20次的超强脉冲刺激[7],刺激频率1 Hz,在肌力评级≥3级的同侧拇短展肌记录Fmin、Fmax潜伏期。测定参数:灵敏度为200~500μV/格,扫描速度为5 ms/格,滤波范围为20~10 k Hz。
1.2.4 针极肌电图检查:对ALS患者进行常规针极肌电图检测,包括舌肌、胸锁乳突肌、第一骨间肌、伸指总肌、T10~T12脊旁肌、胫前肌和腓肠肌等,观察正锐波、纤颤电位、束颤电位、运动单位电位波幅和时限及募集相。
1.3 统计学处理数据输入SPSS21.0统计软件进行统计分析,符合正态分布的计量资料采用均数±标准差表示,两均数间比较采用独立样本t检验;计数资料采用χ2检验;正中神经F波检查结果与CMAP负波波幅、负波面积的相关性分析采用Pearson相关分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 临床资料42例ALS患者平均拇短展肌肌力为3~5级,平均(4.1±0.6)级(与F波检查同侧);ALSFRS评分为25~40分,平均(32.9±4.1)分;上肢功能亚组评分4~12分,平均(9.6±2.1)分。
2.2 神经电生理检查
2.2.1 正中神经运动传导检测:ALS组正中神经DML、传导速度均在正常范围内。与对照组比较,ALS组肘-腕传导速度降低(P<0.01),正中神经Fmin延长(P<0.01),正中神经的CMAP负波波幅及CMAP负波面积明显下降(均P<0.01),而DML虽有延长趋势但差异无统计学意义(P>0.05)。结果见表1。参照身高对应的实验室正常值,ALS组患者Fmin延长异常率为40.5%,所有Fmin异常值超过实验室正常值上限的范围为0.2%~16.4%;参照实验室正常值,ALS患者CMAP峰峰波幅下降异常率为23.8%,下降范围为正常值下限的1.4%~71.9%。
2.2.2 DML、Fmin与CMAP负波波幅、负波面积的相关性:ALS患者正中神经CMAP负波波幅、负波面积均与DML、Fmin呈线性负相关(均P<0.05)。结果见图1~2。矫正身高因素后,ALS患者正中神经CMAP负波波幅、负波面积与DML、Fmin仍呈线性负相关(表2)。
2.2.3 Fmax与CMAP负波波幅、负波面积的相关性:ALS患者正中神经CMAP负波波幅、负波面积与Fmax无相关性(图3)。矫正身高因素后,仍提示两者间无相关性(表2)。
表1 两组正中神经运动神经传导与F波比较(±s)

表1 两组正中神经运动神经传导与F波比较(±s)
注:ALS:肌萎缩侧索硬化,CMAP:复合肌肉动作电位;图1~3、表2同。DML:运动末端潜伏期,图1、表2同;Fmin:F波最小潜伏期,图2、表2同
分组 例数 DML(s) 肘-腕传导速度(m/s) Fmin(s) CMAP峰峰波幅(m V)CMAP负波波幅(m V)CMAP负波面积(m V·ms)ALS组 42 3.5±0.4 56.1±3.5 26.7±2.3 8.4±3.2 5.5±2.2 15.5±7.0对照组 46 3.3±0.4 61.3±1.9 25.3±1.3 16.9±4.2 9.6±2.4 28.2±7.7 t值 1.841 -8.428 3.410 -10.513 -8.219 -8.034 P值 0.069 <0.001 0.001 <0.001 <0.001 <0.001
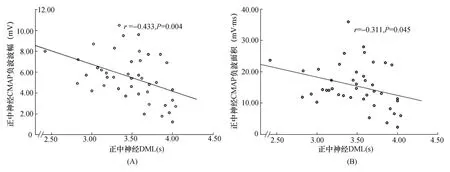
图1 ALS患者正中神经DML与CMAP负波波幅(A)、负波面积(B)相关性分析

图2 ALS患者正中神经Fmin与CMAP负波波幅(A)、负波面积(B)相关性分析

表2 ALS患者矫正身高因素后正中神经CMAP负波波幅、负波面积与DML、Fmin及Fmax偏相关分析结果
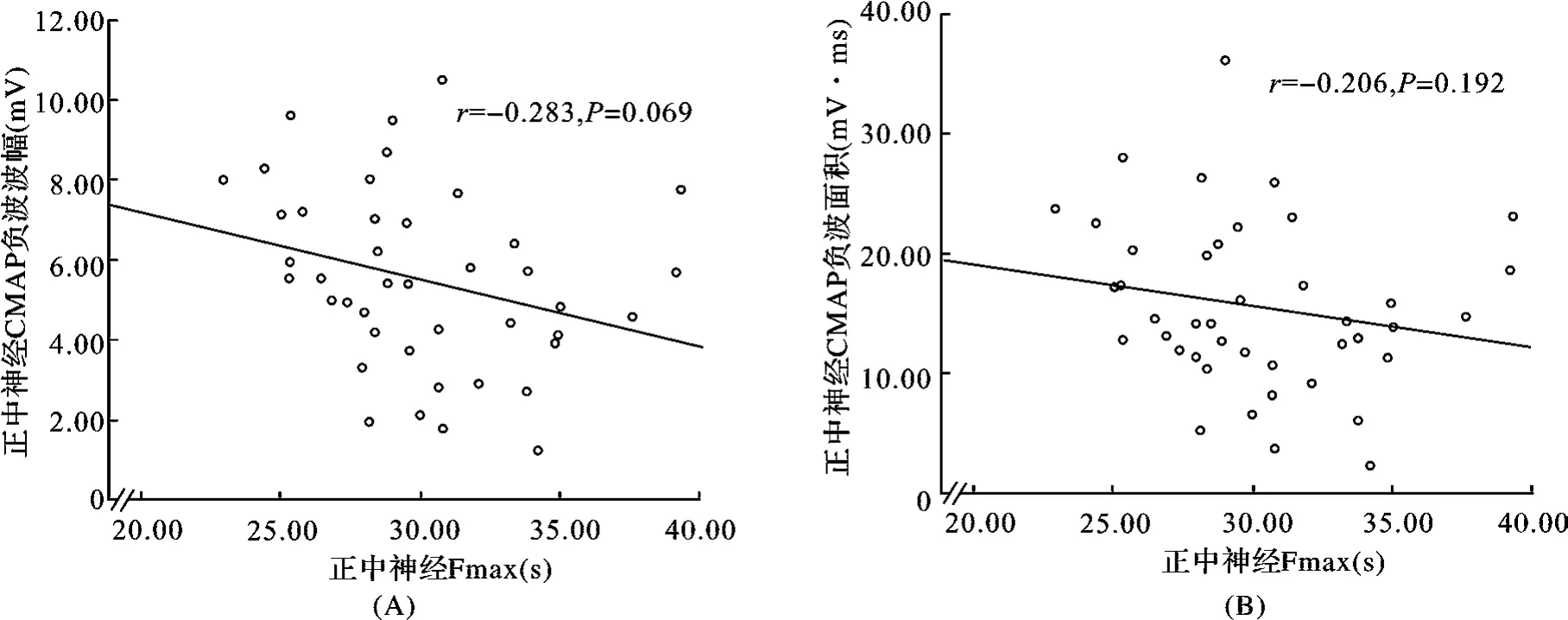
图3 ALS患者正中神经Fmax与CMAP负波波幅(A)、负波面积(B)相关性分析
3 讨论
Lambert等[8]通过研究ALS患者发现,随着CMAP下降,患者出现DML的轻度延长。本研究结果显示,ALS患者DML出现延长趋势,但差异无统计学意义,而Fmin与对照组比较明显延长,差异有统计学意义。CMAP负波波幅及面积可反映参与神经冲动的运动单位数目[9],ALS患者CMAP负波波幅和面积的下降反映了运动神经元的丢失程度及相应的运动单位的减少。从电生理学上看,导致DML潜伏期延长的原因包括:远端神经纤维节段性脱髓鞘或快速传导的大有髓纤维的丢失;导致Fmin延长的主要原因除前两个因素外,可能与神经近端受累相关。本组ALS患者DML与Fmin延长且与CMAP负波波幅及面积降低呈负相关,表明ALS患者早期运动神经元坏死与快速传导的大的有髓纤维丢失有关。
运动神经元有大小之分,运动纤维也有粗细之分,大的运动神经元支配传导快的较粗的运动纤维,稍小的运动神经元支配较细的传导略慢的运动纤维。有关运动神经传导快慢分布的研究结果显示,其传导速度相差并不明显,但当传导距离增加后,传导快慢差异开始显现[10],因而当大的运动神经元受损后Fmin延长较DML变化明显。本研究结果显示ALS患者正中神经DML虽然较正常对照组有延长趋势,但均在正常值范围,且与对照组比较差异无统计学差异;而Fmin较对照组明显延长,且有40.5%超过正常值上限,但延长范围不超过正常上限的16.4%,表明ALS患者潜伏期延长可归因于大的有髓纤维丢失,但所致延长程度轻,远未及神经脱髓鞘的程度。
本组患者ALSFRS及上肢亚组评分均较高,提示入组患者及上肢功能损害处于病程早期。既往研究报道ALS患者同一神经DML与CMAP波幅存在负相关[11-12]。本研究结果显示,ALS患者正中神经支配的拇短展肌CMAP负波波幅、负波面积不仅与正中神经DML呈负相关且与Fmin亦呈负相关,证实了早期丢失的运动神经元是大运动神经元及其支配的快速传导的有髓纤维。该特点在动物模型的研究中也有验证。有关G85R SOD1YFP转基因的ALS模型鼠研究发现快传导的运动神经单元早期选择性丢失,且发现了该类型运动神经支配肌肉的快纤维;反过来,通过荧光标记技术发现ALS存在早期肌肉快纤维的选择性丢失,反向印证了快传导的运动神经单元早期优先受累[13]。按照Hengneman等原则,支配快速运动单位的运动神经元应该具有最大的细胞胞体和轴突直径[14];在另一ALS模型鼠的研究中也发现了直径大的运动神经元表现出优先受累[15],因此推测决定运动神经元受累先后的关键因素是运动神经元胞体大小和轴突粗细[16],胞体大、直径粗的运动神经单位易受累,原因可能与代谢需求有关[17]。
目前,研究者正尝试探索运动神经元选择性丢失的顺序。研究结果显示,ALS鼠模型40 d开始出现快缩的运动单位的选择性丢失,80 d开始出现慢缩运动单位的丢失[16]。由于快纤维芽生代偿功能少或没有,而慢纤维代偿功能则较强[18-19],因此早期肌力、CMAP波幅下降与快缩的运动单位丢失一致。这种相关性随着病情进展、慢纤维侧枝芽生等继发病理改变的形成而逐渐减弱、消失。因此,与Fmin相比,反映慢传导的小纤维功能的Fmax与CMAP负波波幅、负波面积无相关性也间接证实此观点。
综上所述,本研究结果证实快传导的大运动神经元及其支配纤维在ALS早期优先受累,主要表现为Fmin、DML轻度延长和CMAP波幅下降,且两者具有负相关性。有关ALS病变过程中选择性受累的分子机制尚不明确,需要今后进一步研究,这将利于ALS病因的探讨。
