远端复合肌肉动作电位时限在急性炎症性脱髓鞘性多发性神经根神经病诊断中的应用
2019-05-30羊洁刘英冯建华
羊洁 刘英 冯建华
急性炎症性脱髓鞘性多发性神经根神经病(acute inflammatory demyelinating polyradiculoneuritis,AIDP)是我国吉兰-巴雷综合征最常见的类型,其病理改变主要为多发性周围神经和神经根节段性脱髓鞘。病程早期开展免疫治疗可尽快终止免疫反应对周围神经的破坏,减轻、逆转临床症状,减少致死致残的发生。因此,AIDP的早期诊断至关重要。
目前,神经传导检测是发现脱髓鞘病变的重要手段之一,反映脱髓鞘的检测指标主要包括:远端运动潜伏期(distal motor latency,DML)延长、运动传导速度(motor conduction velocity,MCV)减慢、F波延迟或消失。尽管这些指标改变程度与疾病严重程度相关,但在AIDP早期脱髓鞘改变尚不够突出的情况下,前述指标可能改变并不明显,进而影响诊断的敏感度,因此有必要探索更多的脱髓鞘检测指标以提供更有力的诊断依据。
远端复合肌肉动作电位时限(distal compound muscle action potential duration,DCMAPD)是反映远端运动神经纤维传导同步性的指标。在脱髓鞘性周围神经病变中,部分性髓鞘脱失导致同一神经束内神经纤维传导速度不一致,即传导同步性下降,进而出现复合肌肉动作电位(compound muscle action potential,CMAP)波形离散,定量描述即DCMAPD延长。从理论上讲,DCMAPD是反映脱髓鞘病变的敏感指标,因为其反映的是神经束内所有具备传导功能的神经纤维的功能状态。目前国外将DCMAPD应用于脱髓鞘性周围神经病的研究并不少见[1-6],但其在AIDP诊断中应用的研究相对较少[7-10],尤其是国内尚未见相关报道。本研究对DCMAPD在AIDP诊断中的应用价值进行了探讨。
1 对象和方法
1.1 对象(1)AIDP组:收集2013年1月至2018年12月四川省人民医院收治的AIDP患者78例,男46例、女32例,年龄14~74岁,平均(43.7±18.2)岁,病程1~14 d,中位数9.0 d,四分位数间距为5.0 d。纳入标准:1)均符合文献[11]中有关AIDP诊断标准;2)临床资料齐全。排除标准:1)存在其他已知的神经肌肉疾病,尤其是多发性神经病,包括Miller-Fisher综合征;2)合并严重心、肝、肾、肺功能不全者;3)合并严重内科系统疾病者,尤其可能导致周围神经损害的内科疾病(如糖尿病、风湿免疫系统疾病、慢性酒精中毒等);4)临床资料不全。(2)对照组:为健康体检者,共106名,男54名、女52名,年龄20~81岁,平均(47.2±15.4)岁。纳入标准:1)无神经系统阳性症状和体征;2)常规神经传导检查正常;3)无其他严重系统性疾病。两组间性别构成、年龄比较差异均无统计学意义(P>0.05)。本研究经作者单位医学伦理委员会通过,入组者均签署知情同意书。
1.2 方法
1.2.1 仪器与检测条件:采用Keypoint workstation肌电图及诱发电位仪(Alpine Biomed Corporation),带通20 Hz~10 k Hz,扫描速度每格5 ms,灵敏度每格5 m V,刺激频率1 Hz,刺激时限0.2 ms。检查时室温27~30℃,保证患者皮肤温度在32℃以上。
1.2.2 运动传导检测:按照常规方法对周围神经进行远端运动传导检测,受检者均检测上、下肢各一条。采用可粘式表面电极,记录电极分别置于拇短展肌、小指展肌、趾短伸肌和踇展肌肌腹,参考电极置于相应肌肉的肌腱处,接地电极置于参考电极与刺激器之间,分别于腕部正中(最远端腕皱褶线上方1 cm处,桡侧腕屈肌腱和掌长肌腱之间)、腕部尺侧(腕皱褶处,紧靠尺侧腕屈肌腱内或外侧)、踝部(趾长伸肌和踇长伸肌肌腱之间)、内踝后方刺激,依次检测正中神经、尺神经、腓神经、胫神经运动传导。检测结果的判定参照北京协和医院肌电图室神经传导速度正常值范围。
1.2.3 DCMAPD的测定:在500μV/cm的灵敏度条件下手动测量DCMAPD[7-8,12]。具体方法为:以所获得的CMAP第一个负向波偏离基线处定位起始点,最后一个负向波回到基线处定位终点,起始点和终点之间的时间为DCMAPD。最后的正向波不计入DCMAPD。
1.3 统计学处理采用SPSS19.0统计学软件进行分析,符合正态分布的计量资料以均数±标准差表示,两均数间比较采用独立样本t检验;计数资料比较采用卡方检验;采用受试者工作特征(receiver operating characteristic,ROC)曲线分析运动传导检测指标对AIDP的诊断价值,确定DCMAPD最佳临界值,并得出该临界值的灵敏度和特异度。以P<0.05为差异有统计学意义。
2 结果
2.1 两组运动神经传导检测结果AIDP组4条神经DML和DCMAPD均较对照组明显延长,而 MCV明显减慢(P<0.01)。结果见表1~4。
表1 两组正中神经运动传导检测结果(±s)
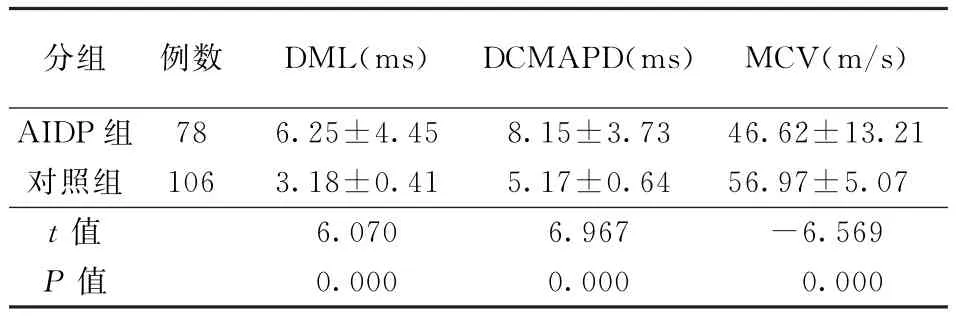
表1 两组正中神经运动传导检测结果(±s)
注:AIDP:急性炎症性脱髓鞘性多发性神经根神经病,表2~5,图1同;DML:远端运动潜伏期,MCV:运动传导速度;表2~5同。DCMAPD:远端复合肌肉动作电位时限,表2~6,图1同
分组 例数 DML(ms)DCMAPD(ms)MCV(m/s)AIDP组 78 6.25±4.45 8.15±3.73 46.62±13.21对照组 106 3.18±0.41 5.17±0.64 56.97±5.07 t值 6.070 6.967 -6.569 P值 0.000 0.000 0.000
表2 两组尺神经运动传导检测结果(±s)

表2 两组尺神经运动传导检测结果(±s)
分组 例数 DML(ms)DCMAPD(ms)MCV(m/s)AIDP组 78 4.45±3.19 8.74±4.05 47.49±12.73对照组 106 2.40±0.39 5.63±0.86 59.80±5.47 t值 5.667 6.656 -8.014 P值 0.000 0.000 0.000
表3 两组胫神经运动传导检测结果(±s)

表3 两组胫神经运动传导检测结果(±s)
分组 例数 DML(ms)DCMAPD(ms)MCV(m/s)AIDP组 78 6.91±4.62 9.45±4.77 40.63±9.82对照组 106 3.41±0.55 5.57±0.98 52.86±4.70 t值 6.792 7.054 -10.173 P值 0.000 0.000 0.000
表4 两组腓神经运动传导检测结果(±s)

表4 两组腓神经运动传导检测结果(±s)
分组 例数 DML(ms)DCMAPD(ms)MCV(m/s)AIDP组 78 6.82±3.56 7.30±2.96 37.76±12.67对照组 106 3.33±0.62 5.03±0.82 50.39±4.03 t值 8.568 6.595 -8.494 P值 0.000 0.000 0.000
2.2 ROC曲线分析4条神经DML、MCV和DCMAPD的曲线下面积(area under the curve,AUC)均>0.7,其中胫神经DML的AUC值>0.9,提示DML、MCV和DCMAPD具有一定诊断价值。结果见表5,图1。以约登指数最大时的DCMAPD值为最佳临界值,4条神经DCMAPD的最佳临界值及相应的敏感度、特异度见表6。
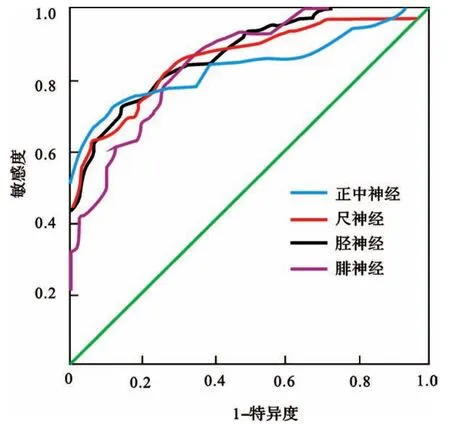
图1 正中神经、尺神经、胫神经及腓神经DCMAPD诊断AIDP的ROC曲线分析

表6 4条神经DCMAPD最佳临界值及相应的敏感度、特异度
2.3 DCMAPD在AIDP中的诊断价值参照上述各神经DCMAPD最佳临界值以及AIDP电生理诊断标准[13],以两条或以上运动神经出现至少一项运动传导参数异常即诊断AIDP时,DML联合MCV的诊断敏感度为83.33%(65/78),其特异 度 为 89.62%(95/106);DML、MCV、DCMAPD三者联合诊断时,可提高其诊断敏感度,达93.59%(73/78),与DML+MCV联合诊断比较差异有统计学意义(P<0.05),其特异度为88.70%(94/106),虽有下降但差异无统计学意义(P>0.05)。
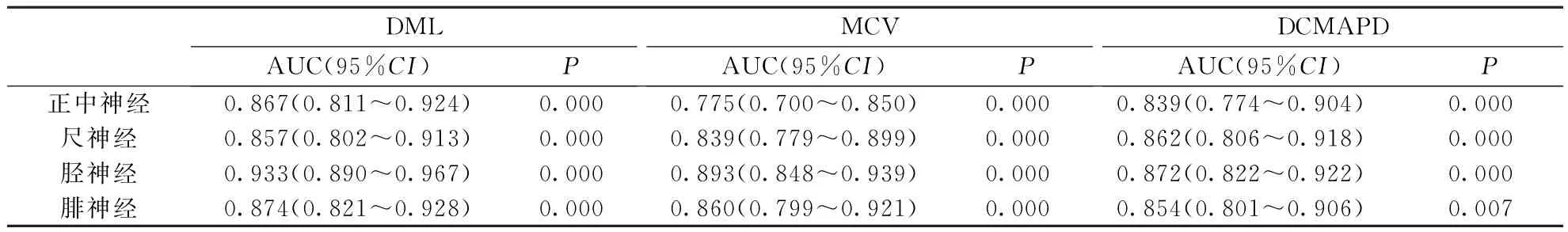
表5 4条神经运动传导检测指标诊断AIDP的ROC AUC分析结果
3 讨论
在周围神经脱髓鞘病变早期,神经束内往往仅有部分纤维脱髓鞘,剩余的健存纤维仍保留了正常传导功能,这种神经纤维传导功能不一致即导致了神经传导同步性下降,在神经传导检测中表现为CMAP波形离散,采用定量描述即CMAP时限延长。可见CMAP时限反映的是神经束内所有神经纤维(包括快、慢纤维)的总体传导功能。
相比之下,既往常用的脱髓鞘指标如DML、MCV仅反映了神经束中最快传导纤维的传导功能,若神经束中的快纤维健存,即使其他纤维(包括慢纤维和部分快纤维)损害明显,DML和MCV仍可在正常范围内,只有当75%以上的快纤维丢失或传导减慢时,两者才会出现明显异常[15],这使得DML、MCV对脱髓鞘疾病诊断的敏感度受到一定影响。此外,F波传导速度和潜伏期也反映的是快纤维传导情况,而且因为检测距离过长(周围神经远端至脊髓前角)导致一些小的脱髓鞘病变被“稀释”而难以被发现。为了提高AIDP早期诊断的效力,能够通过检测尽可能少的神经来获取最有力的检测数据以支持诊断,有必要探索常规脱髓鞘指标以外的其他指标,比如CMAP时限。
目前国外已有不少研究将CMAP时限应用于脱髓鞘性周围神经病变的诊断,尤其针对免疫因素相关周围神经病变,使用的均为刺激肢体远端时所获得的DCMAPD[10,13-14],这是因为周围神经远端是抗体参与的免疫相关周围神经脱髓鞘损害的好发部位。已有研究认为DCMAPD可提高这类疾病诊断的敏感性和特异性,并给出了相应的诊断临界值[16-18]。然而,直接在AIDP诊断中套用现有的国外研究数据可能并不可靠,原因包括:(1)现有数据多来源于欧美人群,人种差异可能影响检测结果。(2)国外神经传导检测高通滤波设置与国内不同,欧洲国家和地区常采用5、10 Hz,而国内多采用20 Hz,不同高通滤波设置会明显影响DCMAPD的检测值[19-20]。(3)现有DCMAPD的诊断临界值是基于对CIDP患者的研究[7],AIDP和CIDP虽然均为周围神经脱髓鞘性病变,但两者病程存在差异,进而可能导致两者运动传导检测结果存在明显不同。因此,有必要针对我国AIDP患者开展进一步的研究。
本研究结果显示,AIDP组与正常对照组间DML、MCV和DCMAPD比较差异均有统计学意义,行 ROC 曲线分析发现,DML、MCV和DCMAPD对于AIDP早期诊断具有较好的诊断价值(AUC>0.7);通过所获取DCMAPD最佳临界值的基础上,进一步将DCMAPD与传统运动传导检测指标DML和MCV联合应用于AIDP的诊断发现,3者联合可提高诊断敏感性,而其诊断特异度未明显下降,提示DCMAPD与DML和MCV联合用于早期AIDP患者的诊断可能是一种更为理想的诊断策略。
本研究得出的DCMAPD最佳临界值低于既往研究结果[7],其原因可能为:既往研究是对CIDP患者与健康人进行检测,由于CIDP为慢性进展型病程,行神经传导检测时其病程往往明显长于AIDP患者,其周围神经脱髓鞘的程度和范围亦远较AIDP患者明显,因此,CIDP患者DCMAPD延长会更为明显;相反,AIDP通常为急性起病,就诊时行神经传导检测时的病程短,其周围神经脱髓鞘程度尚未达到高峰,因此,AIDP患者DCMAPD延长没有CIDP患者那样明显,进而导致DCMAPD最佳临界值低于既往研究结果。这也再一次表明在AIDP患者中套用既往研究数据并不可靠。
综上所述,本研究结果显示,DML、MCV和DCMAPD在AIDP中具有一定诊断价值,三者联合诊断可提高其诊断的敏感度;且在常规神经传导检测的基础上即可实现DCMAPD的检测,不会增加检测时间与成本,值得在常规检测中推广应用。由于本研究样本量相对较小,有关DCMAPD在AIDP诊断和鉴别诊断中的确切价值尚需进一步探讨。
