丹参酮 IIA抑制长春新碱诱导化疗痛维持期痛觉过敏及其机制
2019-05-29付宝军姜静静黄玉琼林宗航
付宝军,姜静静,黄玉琼,林宗航,李 恒
(广州医科大学附属第六医院·清远市人民医院 麻醉科,广东 广州511518)
随着我国恶性肿瘤发病率的逐年增高,抗肿瘤药物在临床药物治疗中扮演着越来越重要的角色,但是这些药物引起的近期和远期毒副作用也在不断增加,其中化疗药物如长春碱类、铂类及紫杉醇类等引起的神经病理性疼痛(Neuropathic pain NP)是极其常见的不良反应之一。化疗诱导的神经病理性疼痛(Chemotherapy-induced Neuropathic Pain,CINP)可表现为痛觉超敏(allodynia)和痛觉过敏(hyperalgesia)[1]。目前,由于CINP的机制尚不明确,国内外均尚未发现有效的治疗药物。近年来研究发现,胶质细胞活化在CINP发生和发展中发挥重要作用,激活的胶质细胞继而促进TNF-α、IL-6等炎性因子的产生和释放,这些促炎因子增强神经元的敏感性,诱发神经病理性疼痛[2,3]。丹参酮IIA(Tanshinone IIA)是从传统中药丹参中提取的脂溶性成分之一,是近年来国内外学者对中药单体中研究较多、最为稳定、且有明确的分子结构的有效活性成分,最近研究发现丹参酮有明显镇痛效应[4,5],并且丹参酮IIA通过抑制免疫反应和胶质细胞活化提高脊神经结扎大鼠机械缩足反射阈值和延长热缩足反射潜伏期[6]。基于以上证据,本研究采用化疗诱导的神经病理性疼痛模型,探讨丹参酮 IIA对化疗痛维持期的抑制作用及其作用机制。
1 材料与方法
1.1 实验动物及试剂实验采用SPF级健康Sprague-Dawley大鼠,由广州医科大学实验动物中心提供[(动物生产许可证号:SCXK(粤)2014-0012)]。所有实验操作程序均经广州医科大学实验动物福利与应用委员会批准,遵守国际卫生学会《实验动物福利和应用指南》。抗GFAP和OX42抗体购于美国Abcam公司,抗β-actin抗体购于谷歌生物科技有限公司,TNF-α、IL-6ELISA试剂盒购于武汉博士德生物科技有限公司,注射用硫酸长春新碱购于浙江海正药业股份有限公司,Tanshinone IIA注射液购于江西国药有限公司。
1.2 长春新碱动物模型的制备及给药方法证实成功诱导化疗痛Sprague-Dawley大鼠50只,按随机数字表法分为5组:对照组(Control)、化疗痛组(CINP)、Tanshinone IIA 10 mg/kg组(CINP+Tan10)、Tanshinone IIA 20 mg/kg 组(CINP+Tan20)、Tanshinone IIA 50 mg/kg组(CINP+Tan500),每组10只。大鼠进行隔日腹腔注射125 μg/kg长春新碱(共计7次),第1次注射长春新碱当天视为1 d,于第7天通过检测MWT和TWL变化确定化疗药物诱导的神经病理性疼痛模型(对照组大鼠除外)建立是否成功。从第8天开始连续7天采用不同剂量的Tanshinone IIA治疗大鼠。对照组和化疗痛组用生理盐水(腹腔注射剂量5 ml/kg)作为对照。给药前、给药后1、7、10、14天用von frey测痛仪和热刺痛仪分别测定大鼠MWT和TWL;给药后14天Western Blot方法检测GFAP蛋白和OX42蛋白表达;ELISA检测脊髓TNF-α、IL-6浓度变化。
1.3 MWT的测定用von Frey纤维丝以up-down法推算50%缩足阈值[7]:将一有机玻璃箱(22 cm×12 cm×22 cm)置于金属筛网上,待大鼠在有机玻璃箱中适应15 min后,用von Frey纤维丝垂直刺激大鼠后肢足底中部,持续时间≤4 s,大鼠出现抬足或舔足行为视为阳性反应,否则为阴性反应。测定首先从2 g开始,当该力度的刺激不能引起阳性反应,则给予相邻大一级力度的刺激;如出现阳性反应则给予相邻小一级力度的刺激,如此连续进行,直至出现第一次阳性和阴性反应的骑跨,再连续测定4次。最大力度为15 g,大于此值时记为15 g。每次刺激间隔30 s。
1.4 TWL的测定将有机玻璃箱置于3 mm厚的玻璃板上,按Hargreaves法[8]用热痛刺激仪照射大鼠足底。照射开始至大鼠出现抬腿回避时为TWL。自动切断时间为20 s,以防止组织损伤。热刺激强度在整个实验过程中维持一致。每只动物测定5次,每次间隔3 min,取后3次平均值为大鼠TWL值[9]。
1.5 Western Blot检测乌拉坦麻醉,断头处死大鼠,冰上取出脊髓腰膨大部位,加入裂解液进行匀浆,4℃下12 000 rpm离心5 min,并进行BCA蛋白定量。配置12%的分离胶和5%的浓缩胶,浓缩胶电泳条件为80伏恒压,分离胶电泳条件为120伏恒压,当溴酚蓝染料前端电泳至分离胶末端处时即停止电泳,转膜后5%脱脂奶粉封闭2 h,加入-Actin(兔抗大鼠,1∶2 000),P38MAPK(小鼠抗大鼠,1∶1 000),GFAP (小鼠抗大鼠,1:500),OX42 (兔抗大鼠,1∶500),4℃9阵育 过夜后TBST洗膜3次,每次10 min。加入HRP标记的山羊抗兔IgG(1∶3000),HRP标记的山羊抗小鼠IgG(1∶2 000)室温孵育2 h后TBST洗膜4次,每次10 min。ECL反应、显、定影后使用图像分析系统进行数据分析。
1.6 ELISA检测脊髓TNF-α、IL-6浓度变化大鼠深麻醉(大鼠腹腔注射1%戊巴比妥钠40 mg/kg)后,在冰上迅速取出脊髓腰膨大段(L4-5),按按组织净重(g):稀释液体积(mL)=1∶9的比例加入预冷的生理盐水。匀浆后于4℃,3500 r/min下离心10 min(离心半径5 cm),提取上清液并在80℃保存。按试剂盒说明书检测蛋白并绘制标准曲线,计算出样品浓度。
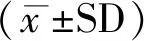
2 结果
2.1 Tanshinone IIA对大鼠运动行为的影响
Tanshinone IIA(10 mg/kg、20 mg/kg、50 mg/kg)连续腹腔注射4天对正常大鼠运动行为无影响。结果见图1。
2.2 Tanshinone IIA对化疗痛维持期大鼠MWT的影响
给药前各组大鼠的MWT差异无统计学意义(P>0.05)。与对照组相比,腹腔注射长春新碱4次后(7天),大鼠MWT均显著性降低(P<0.001),并且一直持续到本实验观察时间点14天,提示长春新碱诱导化疗痛大鼠模型成功。与化疗痛组相比较,应用Tanshinone IIA剂量组(20 mg/kg、50 mg/kg)治疗3、7天,大鼠MWT明显升高(P<0.01,P<0.001),并且两个剂量组之间差异有统计学意义(P<0.05),而Tanshinone 10 mg/kg组有升高趋势,但差异无统计学意义(P>0.05)表明Tanshinone IIA能减轻化疗痛维持期大鼠的机械痛觉过敏,结果见图2。
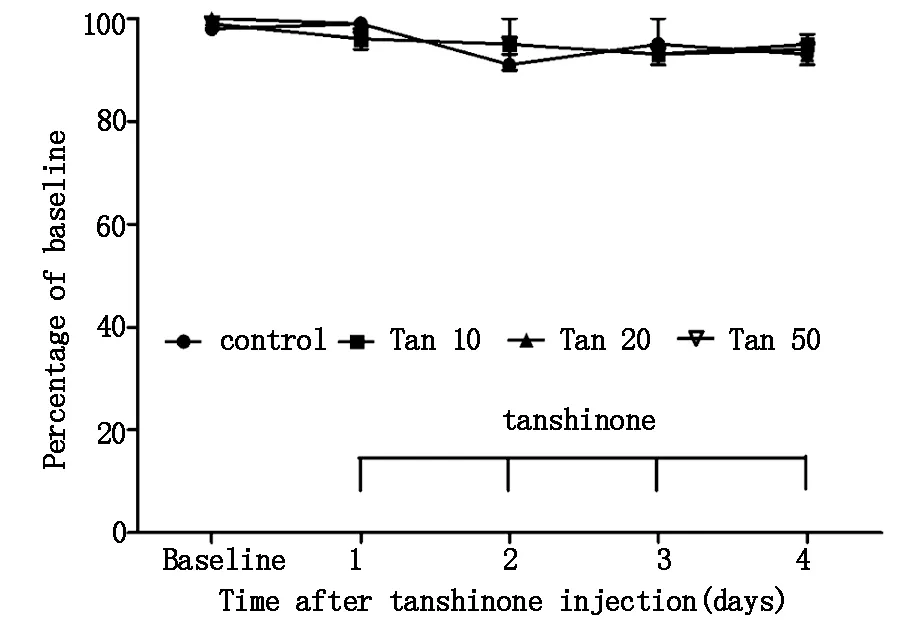
图1 丹参酮IIA对正常大鼠运动行为的影响
The score of each group was normalizd as the precentage of the baseline value(n=4/goup).Control,normal rats;Tan10,normal rats treated with tanshinone IIA 10mg/kg;Tan20,normal rats treated with tanshinone IIA 20 mg/kg;Tan50,normal rats treated with tanshinone IIA 50 mg/kg.

图2 丹参酮IIA对长春新碱诱导的神经病理性疼痛大鼠机械缩足反射阈值的影响
###P<0.001 compared with CINP group;*P<0.05 and**P<0.01 compared with CINP+Tan20 group.Control,normal rats;CINP,vincristine-induced neuropathic pain rats treated with vehicle;CINP+Tan10,Vincristine-induced neuropathic pain rats treated with tanshinone IIA 10mg/kg;CINP+Tan20,Vincristine-induced neuropathic pain rats treated with tanshinone IIA 20mg/kg;CINP+Tan50,Vincristine-induced neuropathic pain rats treated with tanshinone IIA 50 mg/kg.
2.3 Tanshinone IIA对化疗大鼠维持期TWL的影响
给药前各组大鼠的TWL差异无统计学意义(P>0.05)。与对照组相比,腹腔注射长春新碱4次后(7天),大鼠MWT均显著性降低(P<0.001),并且一直持续到本实验观察时间点14天,提示长春新碱诱导化疗痛大鼠模型成功。与化疗痛组相比较,应用Tanshinone IIA剂量组(20 mg/kg、50 mg/kg)治疗3、7天,大鼠TWL明显升高(P<0.01,P<0.001),并且两个剂量组之间差异有统计学意义(P<0.05),但Tanshinone10 mg/kg组有升高趋势,但差异无统计学意义(P>0.05)。提示Tanshinone IIA可以减轻化疗痛维持期大鼠的热痛觉过敏。结果见图3。

图3 丹参酮IIA对长春新碱诱导的神经病理性疼痛大鼠热缩足反射潜伏期的影响
###P<0.001 compared with CINP group;*P<0.05 and**P<0.01 compared with CINP+Tan20 group.Control,normal rats;CINP,vincristine-induced neuropathic pain rats treated with vehicle;CINP+Tan10,Vincristine-induced neuropathic pain rats treated with tanshinone IIA 10 mg/kg;CINP+Tan20,Vincristine-induced neuropathic pain rats treated with tanshinone IIA 20 mg/kg;CINP+Tan50,Vincristine-induced neuropathic pain rats treated with tanshinone IIA 50 mg/kg.
2.4 Tanshinone IIA对化疗痛维持期大鼠脊髓GFAP蛋白表达的影响
Western Blot结果显示:与对照组相比,腹腔注射长春新碱7次(14天)化疗痛组大鼠脊髓GFAP表达显著升高(P<0.01),与化疗痛组相比,Tanshinone IIA 50 mg/kg组和Tanshinone IIA 20 mg/kg组大鼠脊髓GFAP表达则明显降低(P<0.05,P<0.01),且Tanshinone IIA 50 mg/kg组和Tanshinone IIA 20 mg/kg两组之间差异有统计学意义(P<0.05),Tanshinone IIA 10 mg/kg组虽有降低趋势,但差异无统计学意义,提示Tanshinone IIA可以抑制化疗痛维持期大鼠脊髓GFAP的表达。结果见图4。
2.5 Tanshinone IIA对化疗痛维持期大鼠脊髓OX42蛋白表达的影响
Western Blot结果显示:与对照组相比,腹腔注射长春新碱7次(14天)后化疗痛组、Tanshinone IIA 10 mg/kg组、Tanshinone IIA 20 mg/kg组、Tanshinone IIA 50 mg/kg组大鼠脊髓OX42蛋白表达差异无统计学意义(P>0.05)。提示Tanshinone IIA不能抑制化疗痛维持期大鼠脊髓OX42蛋白的表达或者提示化疗痛组大鼠脊髓OX42蛋白表达与基础值相当,结果见图5。
图4 丹参酮IIA对长春新碱诱导的神经病理性疼痛大鼠脊髓GFAP表达的影响
#P<0.05 and##P<0.001 compared with CINP group;**P<0.01 compared with Control group.Control,normal rats;CINP,vincristine-induced neuropathic pain rats treated with vehicle;CINP+Tan10,Vincristine-induced neuropathic pain rats treated with tanshinone IIA 10 mg/kg;CINP+Tan20,Vincristine-induced neuropathic pain rats treated with tanshinone IIA 20 mg/kg;CINP+Tan50,Vincristine-induced neuropathic pain rats treated with tanshinone IIA 50 mg/kg.

图5 丹参酮IIA对长春新碱诱导的神经病理性疼痛大鼠脊髓OX42表达的影响
Control,normal rats;CINP,vincristine-induced neuropathic pain rats treated with vehicle;CINP+Tan10,Vincristine-induced neuropathic pain rats treated with tanshinone IIA 10mg/kg;CINP+Tan20,Vincristine-induced neuropathic pain rats treated with tanshinone IIA 20 mg/kg;CINP+Tan50,Vincristine-induced neuropathic pain rats treated with tanshinone IIA 50 mg/kg.
2.6 Tanshinone IIA对化疗痛维持期大鼠脊髓TNF-α、IL-6蛋白表达的影响
ELISA结果显示:与对照组相比,腹腔注射长春新碱7次(14天)后化疗痛组大鼠脊髓TNF-α、IL-6表达显著升高(P<0.01),与化疗痛组相比,Tanshinone IIA 50 mg/kg组和Tanshinone IIA 20 mg/kg组大鼠脊髓TNF-α、IL-6表达明显降低(P<0.05,P<0.01),Tanshinone IIA 10 mg/kg组有降低趋势,但差异无统计学意义(P<0.05)。提示Tanshinone IIA可以抑制化疗痛维持期大鼠脊髓TNF-α、IL-6的表达。结果见图6,图7。
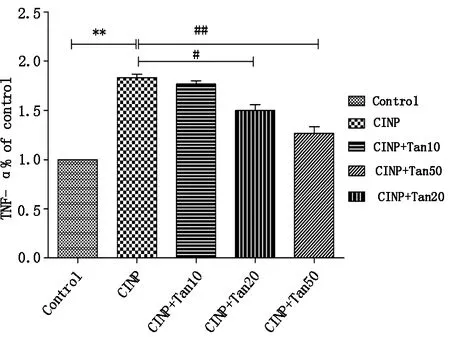
图6 丹参酮IIA对长春新碱诱导的神经病理性疼痛大鼠脊髓TNF-α表达的影响
##P<0.01 compared with CINP group;*P<0.05 and**P<0.01 compared with Control group(n=5/group).Control,normal rats;CINP,vincristine-induced neuropathic pain rats treated with vehicle;CINP+Tan10,Vincristine-induced neuropathic pain rats treated with tanshinone IIA 10mg/kg;CINP+Tan20,Vincristine-induced neuropathic pain rats treated with tanshinone IIA 20 mg/kg;CINP+Tan50,Vincristine-induced neuropathic pain rats treated with tanshinone IIA 50 mg/kg.
3 讨论
化疗药物诱导的神经病理性疼痛其机制至今仍不完全清楚,因此缺乏有效治疗手段。尽管如此,药物治疗在治疗手段中占有很大比重,目前,已尝试的治疗药物主要有:阿片类药物吗啡、局部治疗药物5%利多卡因贴剂、抗惊癫痫药加巴喷丁和三环类抗抑郁药阿米替林。
阿片类药物镇痛药强,但由于其依赖性和戒断性、恶心呕吐和呼吸抑制等副作用限制在化疗药物诱导的神经病理性疼痛患者中应用[10];5%利多卡因贴剂其局限性为应用于定位比较明显的神经病理性疼痛[11];抗癫痫药物加巴喷丁治疗化疗诱导的神经病理性疼痛患者研究结果有很大分歧[12-14],因此此类药物用于化疗诱导的神经病理性疼痛的治疗仍需进一步探讨;三环类抗抑郁药阿米替林可减轻糖尿病性神经病理性疼痛因其心脏毒性患者无法耐受。因此,迫切开发和寻找新的药物治疗化疗药物诱导的神经病理性疼痛药物具用重大意义。
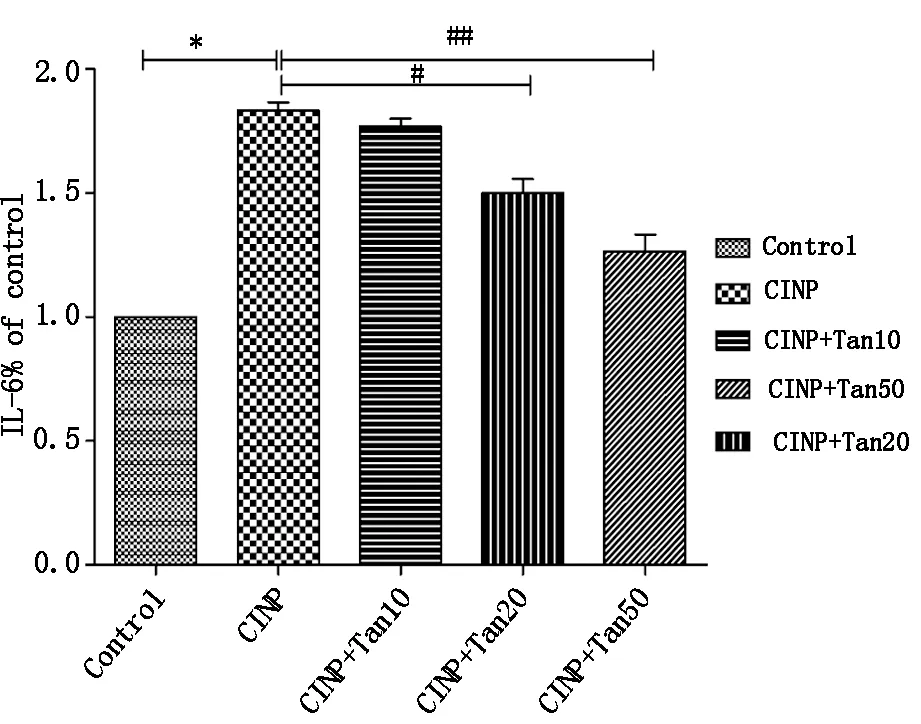
图7 丹参酮IIA对长春新碱诱导的神经病理性疼痛大鼠脊髓IL-6 表达的影响
#P<0.05 and##P<0.01 compared with CINP group;*P<0.05 compared with Control group(n=5/group).Control,normal rats;CINP,vincristine-induced neuropathic pain rats treated with vehicle;CINP+Tan10,Vincristine-induced neuropathic pain rats treated with tanshinone IIA 10 mg/kg;CINP+Tan20,Vincristine-induced neuropathic pain rats treated with tanshinone IIA 20 mg/kg;CINP+Tan50,Vincristine-induced neuropathic pain rats treated with tanshinone IIA 50 mg/kg.
丹参酮IIA是丹参酮(是中药丹参根的脂溶性成分)中含量最高,活性最为稳定的成份,分子结构明确有抗氧化和抗炎作用,并且对心脑血管疾病、肿瘤等疾病有潜在治疗作用。丹参酮IIA的镇痛作用已在脊神经结扎模型、糖尿病神经病理痛模型、骨癌痛模型中得到证实,但在化疗诱导的神经病理性疼痛中应用还未见报道,本研究行为学显示:腹腔注射长春新碱4次后,证实稳定化疗痛模型制作成功,在继续使用长春新碱的同时,加用丹参酮IIA治疗,连续给药7天后,大鼠的热痛阈值和机械痛阈值明显提高,我们初步证实:丹参酮IIA在化疗诱导的神经病理性疼痛中发挥重要作用;并且发现连续丹参酮IIA治疗7天,不仅产生稳定的抗痛敏效应,同时尚未发生类似阿片类药物长期治疗产生的镇痛耐受。最近研究显示:丹参酮IIA通过抑制胶质细胞活化和免疫反应,削弱脊神经结扎大鼠机械痛敏和热痛敏,但是丹参酮IIA是否通过抑制胶质细胞活化在化疗诱导的神经病理性疼痛模型中发挥抗痛敏效应?Westem blotting结果显示:在丹参酮IIA治疗7天后,化疗痛大鼠脊髓星型胶质细胞标志物GFAP蛋白表达显著升高,小胶质细胞标志物OX42蛋白表达在不同组之间变化一致;而丹参酮IIA各剂量组大鼠脊髓GFAP蛋白表达明显少于化疗痛组。已有研究表明:小胶质细胞激活在神经病性疼痛的形成期发挥作用;而星型胶质细胞激活在在神经病性疼痛的维持期发挥作用,本研究时间段恰恰是长春新碱诱导的神经病理性疼痛的维持期,因此,很可能在本实验模型中,我们研究时间段小胶质细胞没有被激活,星型胶质细胞激活占主导,导致对照组、化疗痛组、Tanshinone IIA 10 mg/kg组、Tanshinone IIA 20 mg/kg组、Tanshinone IIA 50 mg/kg组大鼠脊髓OX42蛋白表达差异相当,但长春新碱诱导的神经病理性疼痛的形成期是否小胶质细胞被激活占优势还有待于实验进一步证实。
胶质细胞的激活促进炎症因子TNF-α、IL-6等的合成和释放,产生的促炎症因子可参与兴奋性氨基酸或其受体的调控,同时促炎症因子还可介导神经突触信号传递及影响神经纤维的电位时程,参与中枢敏化的形成。ELISA结果显示,在使用丹参酮IIA治疗7天后,化疗痛组大鼠脊髓TNF-α、IL-6表达显著升高,丹参酮IIA各剂量组脊髓TNF-α、IL-6蛋白表达明显少于模型组,以上结合ELISA、Westem blotting结果推测:化疗痛组大鼠脊髓TNF-α、IL-6表达显著升高可能由激活星型胶质细胞合成和释放TNF-α、IL-6增加,介导长春新碱诱导的痛敏形成,而Tanshinone IIA作用的靶点恰恰是激活星型胶质细胞,抑制TNF-α、IL-6合成和释放,产生抗痛敏效应。但Tanshinone IIA是否通过抑制TNF-α、IL-6影响神经突触信号传递及神经纤维的电位时程来发挥抗痛敏效应,还有待于实验进一步证实。
总之,在本实验条件下,丹参酮IIA能够抑制长春新碱诱导的神经病理性疼痛,其作用的机制可能与其抑制大鼠脊髓星型胶质细胞活化,进而减少炎性细胞因子TNF-α,IL-6的表达相关。
