缺氧诱导血管内皮细胞损伤的机制研究
2019-05-29李亚博杨松柏
李亚博,王 佩,陈 一,杨松柏*
(1.吉林大学中日联谊医院,吉林 长春130033;2.吉林大学第二医院 妇产科)
心肌功能障碍可由于心肌缺氧诱导的内皮细胞凋亡造成,常见的有心力衰竭、心肌梗塞(MI)等[1]。因此,研究缺氧时血管内皮细胞(VEC)在机体中的作用机制,对人类心血管疾病的诊治具有重要意义。内皮细胞在缺氧的情况下会产生应激反应,包括细胞增殖、迁移、炎症和凋亡[2]。细胞凋亡若发生于心肌内皮细胞凋亡,将会导致一些心脏疾病[3]。因此,研究血管内皮细胞(VECs)缺氧诱导分化的分子机制对了解心血管疾病的发病机制及诊疗新方案的发掘具有重要意义。
1 材料与方法
1.1人脐静脉内皮细胞(HUVECs)是从中国科学院细胞库购买的。在治疗前,通过过夜血清饥饿使细胞静止。
对照siRNA和SP-1 siRNA,在游离EGM-2中生长至70%-80%融合后,用对照siRNA或SP-1 siRNA转染HUVECs。培养5 h后,将细胞转化为完整培养基,培养过夜。然后,细胞暴露在正常或缺氧环境中。最后经western blot检测证实SP-1表达下调。miR-135 b模拟或miR-135 b抑制剂转染到HUVECs。转染48 h后,取细胞进行进一步分析。
1.2 细胞增殖使用MTT检测试剂盒(Sigma,St.Louis,USA)根据制造商协议检测细胞增殖。
1.3 流式细胞术转染48 h后,室温下,用FITC-Annexin V和碘化丙酸钠在暗处染色15 min,观察细胞凋亡情况。然后,细胞凋亡的比例由流式细胞术检查分析。
1.4 统计分析数据表示为平均数±标准差。组间比较采用GraphPad Prism 6和one-way ANOVA分析。P<0.05为差异有统计学意义。
2 结果
2.1 缺氧HUVECs细胞SP-1和miR-135b的表达Western印迹和qRT-PCR结果显示SP-1在HUVEC中的表达随着缺氧时间的延长而增加(图1,表1)。缺氧暴露的人脐静脉内皮细胞miR-135b水平降低(图1,表1)。提示转录因子SP-1和miR-135b可能参与了缺氧诱导的血管内皮损伤。
2.2 SP-1的缺失影响缺氧条件下HUVECs细胞的增殖和凋亡将SP-1 siRNA转染于缺氧暴露的HUVECs中,观察SP-1的作用,SP-1表达明显下降(图2A)。MTT法显示缺氧条件下细胞增殖下降。然而,si-SP-1转染上调细胞增殖(图2B)。缺氧增加细胞凋亡率,si-SP-1转染后细胞凋亡率降低(图2C)。这些结果表明,SP-1的损失可能会减弱缺氧对HUVECs细胞增殖和凋亡的影响。
2.3 SP-1的缺失可以减弱缺氧诱导的炎症因子和VEGF的表达粘附分子VCAM-1、ICAM-1、VEGF表达升高在血管内皮损伤中起关键作用。在研究中,缺氧增加了VCAM-1、ICAM-1和VEGF的表达,而SP-1的损失降低了HUVECs中VCAM-1、ICAM-1和VEGF的表达(与对照组比较,P<0.05)。此外,血清炎症因子水平TNF-α,IL-1β,il - 6,以及活性氧的生产,也显著增加;但是si-SP-1降低(与对照组比较,P<0.05)。这些结果表明,SP-1的缺失降低了缺氧暴露HUVECs中炎症因子和VEGF的表达。
2.4 SP-1 siRNA缺失转染到缺氧暴露的HUVECS中增加miR-135b表达和减少HIF-1α表达HIF-1α、缺氧的关键响应要素密切参与血管内皮损伤引起的组织缺氧。发现HUVECs缺氧增加HIF-1α但si-SP-1转染逆转这种效应(表2)。缺氧可降低miR-135b的表达,而丢失SP-1可增加HUVECs中miR-135b的表达(表2)。这些结果表明,sp 1损失增加miR-135b和降低HIF-1α表达缺氧诱导HUVECs。
2.5 SP-1/miR135b/HIF-1α是HUVECs缺氧损伤的一种新轴为了探讨SP-1在缺氧诱导人脐静脉内皮细胞增殖、凋亡和炎症反应中的作用机制,研究发现miR-135b可抑制HIF-1α蛋白的表达,而抗miR-135b可增加HIF-1α蛋白的表达,这些结果表明miR-135b直接靶向HIF-1α。
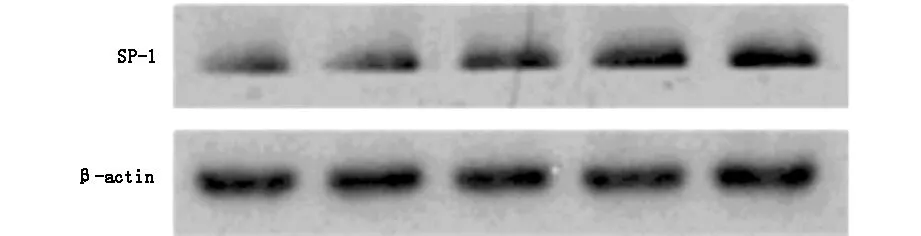
图1 缺氧暴露下HUVECs中SP-1和miR-135b的表达情况 western blot检测缺氧人脐静脉内皮细胞中SP-1蛋白的表达,RT-qPCR检测缺氧HUVECs中miR-135b水平

表1 缺氧暴露下HUVECs中SP-1蛋白和miR-135b相对表达水平
与对照组(0 h)比较,*P<0.05。

图2 SP-1的缺失影响缺氧下HUVECs细胞的增殖和凋亡 (A)Western blot检测SP-1表达;(B)MTT法检测细胞增殖;(C)流式细胞术检测细胞凋亡
结果平均数±标准差。与对照组比较,*P<0.05。与缺氧+si-SP-1组比较,#P<0.05

表2 SP-1 siRNA转染到缺氧暴露的HUVECs中HIF-1α蛋白和miR-135b相对表达水平
3 讨论
本实验意在探究血管内皮细胞(VECs)在缺氧诱导分化的分子机制,采用缺氧诱导人脐静脉内皮细胞(HUVECs)模拟缺氧诱导的血管内皮损伤。缺氧条件下HUVECs表达SP-1。SP-1siRNA转染缺氧培养的人脐静脉内皮细胞后,细胞增殖减少,炎症反应、细胞凋亡和活性氧生成增加。研究发现,Si-SP-1转染逆转了所有这些效应。此外研究还发现,抗miR-135b或HIF-1α激动剂CoCl2可抑制si-SP-1对缺氧培养的人脐静脉内皮细胞的作用。缺氧诱导的血管内皮细胞损伤是心肌梗塞、冠心病等心血管疾病(CVD)的病理生理机制的重要因素[4]。若缺氧部位发生于心肌细胞,心肌细胞缺氧诱导的血管内皮功能障碍参与了几种CVD的发病机制[5]。因血管内皮细胞(VEC)直接与血液接触,因此它们对缺氧刺激作出迅速反应。越来越多的研究证据表明,保护血管内皮细胞免受缺氧诱导的心血管损伤至关重要[6]。据报道,转录因子SP-1对调节与细胞功能相关的细胞因子很重要。SP-1的抑制已被证明可以减少HIF-1α对上皮细胞的影响[7]。缺氧诱导因子HIF-1α的调节参与血管内皮损伤。我们发现沉默SP-1能减轻缺氧诱导的HUVECs损伤[8]。本次实验结果表明,低氧暴露后人脐静脉内皮细胞炎症表型ICAM-1、VCAM-1蛋白水平及TNFα、IL-6和IL-1β分泌增加。此外,细胞内ROS生成增加可诱导内皮细胞功能的氧化应激和细胞功能的丧失[9]。在本研究中,发现在低氧暴露HUVECs中ROS产生增加,并且沉默SP-1对低氧诱导的内皮细胞损伤有保护作用。miRNA也是心肌缺氧诱导的内皮细胞损伤的关键调节因子。我们的研究表明,在缺氧条件下HUVECs中miR-135b表达降低。因此,我们推测miR-135b可能参与了缺氧诱导的血管内皮损伤。在本研究中,我们发现SP-1的沉默上调了缺氧条件下HUVEC中miR-135b的表达,表明SP-1可能通过miR-135b影响HUVEC。miR135b靶向HIF-1α。我们的结果证实miR-135b通过直接靶向调节HIF-1α。
总之,在我们的研究中,低氧使脐静脉内皮细胞的SP-1水平升高。缺氧暴露可增加HUVECs凋亡、炎症和活性氧的产生,减少HUVECs的增殖。然而,缺氧对HUVECs的这些作用在用SP-1siRNA转染后均被逆转。此外,我们发现SP-1能负性调节miR-135b的表达,进而介导miR-135b的靶基因,HIF-1α是miR-135b的靶基因。因此,SP-1/miR-135b/HIF-1α轴可能在缺氧诱导的血管内皮损伤中起重要作用。因此,我们的研究对心血管疾病的发病机制及诊疗新方案的发掘具有重要意义。
