YWHAE在大肠癌中的表达及临床意义
2019-05-29吴昕阳李丽红王晶莹何成彦
吴昕阳,李丽红,王晶莹,谢 风,何成彦,方 玲
(吉林大学中日联谊医院 检验科,吉林 长春130033)
酪氨酸3-单加氧酶/色氨酸5-单加氧酶活化蛋白(YWHAE),也称为14-3-3ε是14-3-3家庭的成员。这个家族的成员是约30 kDa酸性多肽,具有高度调节多种细胞功能的保守序列,包括细胞周期调节、信号转导、粘附和恶性转化[1]。14-3-3蛋白是真核生物体内存在的可溶性酸性蛋白,它通过与靶蛋白结合,调节靶蛋白来发挥其生理学的功能.14-3-3蛋白最初由Moore和Perez于1967年在牛脑中分离的出来的,被认为是细胞分裂和凋亡中的关键调节和抗凋亡蛋白[2]。在哺乳动物细胞中,已鉴定出14-3-3家族的七种同种型(,å,ã,ç,,和)[3]。研究表明,在14-3-3蛋白家族中,14-3-3δ亚型具有抑制肿瘤活性的特点,而其他亚型蛋白则具有促癌活性。YWHAE与肿瘤的发生、发展密切相关,主要在肿瘤细胞生长、细胞周期、细胞凋亡、扩散迁移及信号转导等途径发挥作用[4]。YWHAE在结直肠癌细胞,肾癌细胞以及胃癌组织中发挥着突出的作用。有研究表明,Nagappan等人观察到感染幽门螺旋杆菌的胃黏膜层组织中的YWHAE的表达显著增加,表明YWHAE与幽门螺旋杆菌导致的相关疾病有关[5]。尽管14-3-3蛋白的不同亚型在各种肿瘤的分布与作用不尽相同.但是越来越多的文献报道认为,YWHAE在肿瘤的发生、发展中起到一个很重要的作用。我们采用液相色谱与质谱联用和蛋白质印记技术,检测YWHAE在结直肠癌(CRC)中的表达情况。并初步探讨了YWHAE在CRC中的潜在的分子机制,为临床诊疗工作提供新的肿瘤标志物及治疗靶点。
1 材料与方法
1.1 实验材料
采集吉林大学中日联谊医院26例结直肠癌患者手术切除的新鲜标本,所有这些病例经病理诊断为腺癌。同时,取距离癌组织10 cm以上的癌旁组织,所有患者术前均未接受放化疗。待标本离体后,液氮速冻。-80℃冰箱内保存。所有组织均经过吉林大学中日联谊医院伦理审查委员会批准后方可用于研究。
1.2 试剂与仪器
二硫代苏糖醇(DTT)、TPCK修饰的测序级胰酶购自于promega。DNA酶、RNA酶均购自于Sigma公司。Thermo Fisher Scientific公司购置的LTQXL离子肼质谱仪。液相色谱分析仪由安捷伦公司提供。蛋白质定量试剂盒购置于Bio-Rad公司。胰酶、蛋白裂解液购于beyotime公司。超净工作台购于苏州净化设备有限公司。
1.3 实验方法
1.3.1组织蛋白的提取、测定蛋白浓度及电泳分离 分别取出液氮保存的26对组织标本20 mg后,在匀浆器中研磨。然后利用蛋白提取试剂盒提取总蛋白质。使用二辛可宁酸蛋白定量试剂盒,在UV-2000型分光光度计的590 nm处比色,以牛血清白蛋白含量为横坐标,光吸收值为纵坐标绘制标准曲线,根据样品的吸光度计算出样品的蛋白质含量(mg/ml)。将剩余样品加入4×上样缓冲液,100℃加热10 min后,用聚丙烯酰氨凝胶电泳(PAGE)进行电泳蛋白分离。
1.3.2组织蛋白的还原、烷基化和胰蛋白酶消化 将凝胶带切成20 mm×2 mm的条带,加入10 mM DTT,56℃避光还原1 h。待反应物降至室温后,加入25 mM的碘乙酸溶液,使其烷基化,室温下避光反应20 min。最后,按1∶50(胰酶:蛋白质)的比例向混合物中加入测序级胰酶,在37℃酶切5 h,酶切后样品用真空抽干后分装,-80℃保存。
1.4 液相色谱与质谱联用技术分析、数据库搜索以及蛋白质鉴定
本研究使用6550 iFunnel四级杆-飞行时间液相色谱-质谱仪联用仪进行质谱数据的采集。液相色谱采用溶液A:0.1%甲酸和溶液B:90%乙腈的梯度流动相,在流速为0.5 μl/min的75 μm×150 mm分离柱上分离富集肽(0-2 min,0%-3%B;2-70 min,3%-35%B;70-75 min,35%-45%B;75-85 min,45%-95%B;85-88 min,95%-103% B.)。分离的多肽在C18色谱柱上富集后,通过双击离子漏斗与前端的六孔毛细管的配合,高效的将多肽导入到进入质谱仪进行分析。质谱仪氮气保持在250℃,流量为9L/min;质量范围为50-3000(m/z),扫描速率为4谱/秒,扫描方式为数据依赖方式(DDA)。将获得的质谱数据传输到质谱数据分析软件,在SwissProt数据库中的‘人类’进行检索。多肽>2的蛋白质谱图进行数据库检索,对相关蛋白进行鉴定。
1.5 蛋白质印迹法试验
对选定的目标蛋白YWHAE进行蛋白质印迹试验。30 μg的蛋白样品在10%的SDS-PAGE凝胶上分离,并转移到PVDF膜上。PVDF膜用5%脱脂牛奶封闭2 h。PVDF膜在4℃的温度下与YWHAE和β-Actin一抗孵育过夜,再用1∶2 000辣根过氧化物酶结合的二级抗体室温下孵育1 h。最后,蛋白条带以化学发光法显色获得。
1.6 统计学处理

2 结果
2.1 结直肠癌组织酶解产物中表达蛋白的鉴定
酶解产物进行液相色谱与质谱联用分析,得到多肽质谱数据,经数据库检索得到肽段和蛋白的鉴定信息。经鉴定,其中肿瘤组织与癌旁健康组织中共得到686个多肽种类,483个蛋白质种类。
2.2 大肠癌组织与癌旁健康组织差异蛋白质的质谱分析
应用谱图计数法,根据鉴定蛋白的二级质谱图数目与蛋白丰度呈正相关的原理,对质谱鉴定数据进行定量分析。将两样品中蛋白谱图数的比值≥2视为表达具有差异。结果表明,共有68种差异表达蛋白,其中42种蛋白在肿瘤组织中表达上调,26种蛋白在肿瘤组织中表达下调(所有P<0.05)。本文重点研究上调表达的YWHAE,其质谱结果见图1。
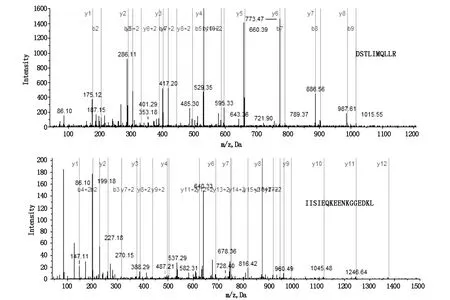
图1 YWHAE质谱图
2.3 蛋白印迹实验比较YWHAE在结直肠癌组织与癌旁组织的表达
通过蛋白质印迹法检测结直肠癌及癌旁组织中YWHAE蛋白的表达。如图2所示,YWHAE在结直肠癌中明显上调表达,进一步验证了液相色谱与质谱联用技术的结果。

A:大肠癌组织;B:大肠癌癌旁组织
3 讨论
研究表明,YWHAE在包括胃癌[6]、肝癌[7]、肾癌[8]等多种肿瘤中表达显著增高,高表达的YWHAE可以促进细胞的增殖、迁移和抑制凋亡。其机制可能是通过抑制YWHAE基因减少胞内线粒体、通过竞争性抑制剂破坏YWHAE蛋白配体关联等相关。Ko等[7]通过对114例肝癌病人的组织诊断发现,YWHAE的高表达与肝癌的迁移有关。Liang等[8]发现YWHAE上调肾脏癌组织是与其对应的肾组织的1.44倍,并且体外YWHAE的过表达可以有限地促进肾肿瘤细胞的异常生长。有文献表明,YWHAE蛋白的过度表达促进了CagA对NF-êB的激活;相反,YWHAE蛋白的敲除抑制了CagA对NF-êB的激活这些结果表明CagA增强YWHAE介导的NF-êB反式激活,为CagA诱导的幽门螺杆菌相关肿瘤发生的分子机制提供了新的线索。在SGC7901细胞中,Yan等人发现YWHAE的过度表达激活了ERK / MAPK通路并增加了细胞增殖,迁移和侵袭,表明YWHAE的原始作用[5]。在体外,我们证明了YWHAE可以通过下调MYC和CDC25B,诱导细胞停滞和抑制细胞入侵和迁移。另一方面,MYC致癌基因能诱导胃癌细胞增殖,侵袭和凋亡通过CDC25B和CDC25B的上调进行迁移YWHAE的下调[9]。文献表明,14-3-3蛋白作为特定的磷酸化蛋白质结合蛋白,通过抑制其磷酸化使蛋白质失活或通过阻止其去磷酸化来增强蛋白质的活性。YWHAE可以通过参与ERK/MAPK途径上调胃癌SGC7901细胞的生物活性。抑制YWHAE活性可能更有效地抑制胃癌细胞生长[10]。Abdul等[11]发现YWHAE蛋白在大脑中高表达,并且与在神经元信号传导中起重要作用的蛋白质相互作用。
YWHAE表达的改变可能在各种肿瘤类型中很常见;然而YWHAE在CRC中的意义还没有被研究。在本研究中,我们通过液质联用及蛋白印迹分别验证了YWHAE在CRC组织中上调表达。这表明YWHAE可能在CRC的发生、发展中发挥重要的作用,且有潜力作为早期的生物标志物以及CRC治疗的基因靶点。
