发酵肉用耐高温酵母菌的筛选与鉴定
2019-05-29许艳丰杨万根
许艳丰 陈 瑶 刘 艳 杨万根
吉首大学化学国家级实验教学示范中心 吉首大学食品科学研究所 湖南吉首 416000
传统发酵肉制品的加工周期一般较长,为了缩短生产周期,降低成本,曾经采用高温成熟、添加蛋白酶和脂肪酶以及纯种发酵等方法加速发酵肉制品的成熟[1,2]。其中,高温成熟能促进发酵肉中风味物质之间的反应速度,提高酶的活力,但是高温不利于发酵肉中有益微生物的生长,所得产品品质差[3~5]。纯种发酵方法的主要优势是提高了产品的安全性,虽然接种发酵菌种能一定程度上缩短发酵优势菌的形成过程,但发酵优势微生物的生长和蛋白酶、脂肪酶的作用仍然需要一段时间,因此成熟时间仍然较长[6,7]。如何在保证发酵肉制品质量前提下,有效缩短生产周期仍有待研究。根据前人的研究成果,将纯种发酵和高温成熟两种方法的优势结合起来,有可能缩短生产周期。此方法的原理是利用耐高温发酵剂,在高温下发酵肉制品,腐败微生物因高温和优势发酵菌种的作用受到抑制,挥发性风味物质因高温而加速生成,从而加快发酵肉制品的成熟。然而,此法的前提是要筛选到适合高温加工的耐高温发酵剂。酵母菌是我国传统肉制品中的一种有益菌。因此,本文从传统方法加工的发酵肉中分离出酵母菌菌株,然后从中筛选耐高温、耐盐、耐亚硝酸盐的酵母菌,并对其进行种属鉴定,为发酵肉加工新工艺的开发和发酵肉制品质量与安全的提高提供菌种资源。
1 材料和方法
1.1 材料与仪器
腊肉,吉首市农贸市场购得;95%乙醇、蛋白胨、2,3,5-氯化三苯基四氮唑(TTC)、葡萄糖、琼脂等,上海国药集团;TH15C酵母菌微量生化鉴定管,杭州滨和微生物试剂有限公司。
YXQ-SG46-280S手提式压力蒸汽灭菌器,上海沪粤明科学仪器有限公司;SPX-250B-Z恒温生化培养箱,上海博讯实业有限公司;VS-1300L-U洁净工作台,苏州安泰空气技术有限公司;UV755CRT紫外可见分光光度计,成都苏净科学器材有限公司。
1.2 方法
1.2.1 酵母菌分离
取适量腊肉样品,搅碎后加入到YPD液体培养基中,加入链霉素和四环素盐酸盐至终浓度为25mg/L,于30℃,150r/min摇床富集培养24h后,取1mL富集液,用无菌水稀释成不同的倍数,涂布于YPD固体平板培养基上于30℃静止培养24h,挑取单菌落,利用TTC双层平板法进一步筛选,把双层平板放于30℃培养箱静止培养24~48h,长出菌落后,选择颜色较深,具有典型酵母菌落特征的单菌落进一步划线分离2~3次,镜检为纯种后转入YPD固体斜面培养基中,于4℃保存[8~10]。
1.2.2 酵母菌筛选
1.2.2.1 产酒精能力测定
将上面筛选到的菌株分别接到YPD平板上30℃培养24h,长出菌落后将45℃TTC上层培养基倒入培养皿,30℃下避光保温2~3h。观察培养基显色情况。产酒精能力强的酵母菌落一般为深红色,次之为粉红色,再者为微红色。通过颜色深浅来比较各菌株的产酒精能力,筛选产酒精能力强的酵母菌株[11]。
1.2.2.2 耐盐性测定
将分离的菌株接种到食盐浓度为0%、2%、4%、6%、8%、10%的YPD液体培养基中,在30℃下培养24h,以YPD液体培养基做为空白对照,测定吸光值的变化,比较其生长情况,选取生长能力好的菌株进入下一步的实验[12]。
1.2.2.3 耐亚硝酸盐能力测定
将分离的菌株分别接种到亚硝酸盐含量为50、100、150mg/kg的YPD液体培养基中,30℃培养24h,测定吸光度值的变化,以YPD液体培养基做空白对照,比较其生长情况,选取生长能力好的菌株进入下一步的实验[12]。
1.2.2.4 温度梯度筛选
将前面筛选出来的单菌落分别接入灭菌的YPD液体培养基中,在37、42、50℃条件下160r/min摇床振荡培养,培养24h后在600nm处测定培养液的吸光值,筛选50℃生长较好的菌株。
1.2.3 菌种鉴定
1.2.3.1 形态与培养特征
将菌株接种到YPD液体培养基中,30℃培养3~7d,观察是否发酵、培养液是否混浊,是否形成环或岛,是否有沉淀及沉淀的松紧情况,并在显微镜下观察菌体,记录酵母菌细胞的形状。将酵母菌在YPD平板上划线,30℃培养3~4d,记录其菌落形态。
1.2.3.2 生理生化鉴定
将筛选得到的菌株接种于酵母菌微量生化鉴定管中,37℃培养18~72h,将实验结果填写在生化鉴定单上,并得出相应的编码值,通过编码值检索酵母菌菌属细菌生化鉴定编码表,鉴定菌株种属。
2 结果与讨论
2.1 酵母分离
从湘西腊肉中采集样本,进行涂布、划线分离,得到40株酵母菌,编号为Y1~Y40。图1为Y7的TTC培养基划线分离图。
图1 经过多次分离划线的Y7菌落
2.2 酵母菌筛选
2.2.1 TTC法测定产酒精能力
TTC是一种显色剂,它对酵母的代谢产物发生呈色反应,通过它可以判断酵母中呼吸酶活力的大小,即酵母产酒精能力的高低。将培养在YPD平板上24h的酵母菌落上覆盖一层TTC上层培养基,避光保温2~3h后观察,各株酵母菌的菌落或是不变色,或是呈现从浅粉到深红的颜色。通过菌落颜色的深浅,可以初步判断酵母菌产酒精能力的高低。从变色的菌株中,挑选出20株颜色深的酵母菌,编号为Y1、Y2、Y3、Y4、Y7、Y8、Y16、Y18、Y20、Y22、Y23、Y25、Y28、Y29、Y33、Y34、Y35、Y38、Y39、Y40。图2为Y7的TTC培养基生长图。
图2 Y7的TTC培养基生长图
2.2.2 耐亚硝酸盐能力
如图3所示,我们可以发现,随着亚硝酸盐浓度的增加,菌株的生长开始逐渐减弱。综合考虑,此实验排除了编号为Y3、Y18、Y38的菌株,余下编号为Y7、Y8、Y20、Y25、Y39、Y40的6株菌株进行下面的实验。
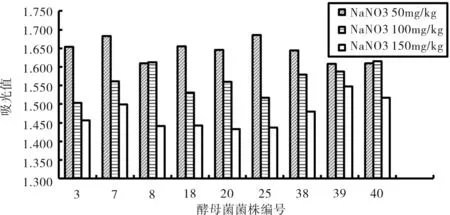
图3 酵母菌耐亚硝酸盐实验结果
2.2.3 测定耐盐性能力
不同NaCl浓度液体培体物的吸光度值如图4所示。
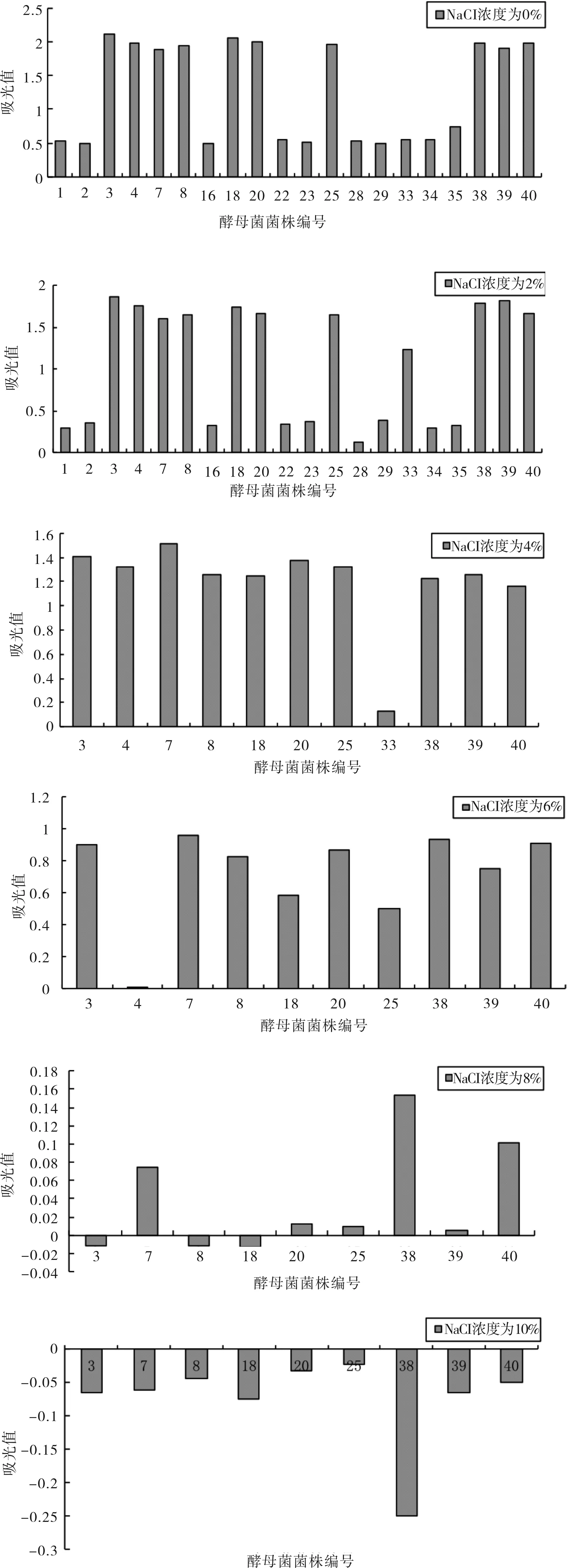
图4 菌株对不同浓度NaCl的耐受性实验结果
如图4所示,在NaCl浓度为0%、2%时,酵母菌总体生长良好,但Y1、Y2、Y16、Y22、Y23、Y28、Y29、Y34、Y35生长比较弱,故而排除。在NaCl浓度为4%时,Y33的吸光值出现了明显的降低,生长较弱。在NaCl浓度为6%时,开始出现生长非常缓慢的情况,其中Y4菌株测得的吸光值接近空白,几乎不生长,故而排除Y4。继续提高盐浓度至8%,Y3、Y8、Y18的吸光值出现负值,当盐浓度为10%时所有菌培养液的吸光值都为负值,说明这时酵母菌均不再生长。为了提高获得耐高温菌株的成功概率,留下NaCl浓度为6%时生长良好的Y3、Y7、Y8、Y18、Y20、Y25、Y38、Y39、Y40进行下面的实验。
2.2.4 温度梯度筛选
温度筛选实验结果如图5。

图5 培养温度筛选结果
图5显示,随着培养温度的上升,菌株的生长开始逐渐减弱。综合考虑,此实验排除了编号为Y8、Y20、Y25、Y40的菌株,最后留下Y7和Y39做接下来的菌种鉴定实验。
2.3 菌种鉴定
依据菌落特征、菌体形态、生理生化特性等方法,将分离得到的耐高温优质酵母菌鉴定到种属。
2.3.1 形态与培养特征
Y7,Y39形态与液体培养特征见表1。

表1 Y7、Y39菌落形态与培养特征
2.3.2 生理生化鉴定
Y7、Y39的生理生化鉴定结果见表2。
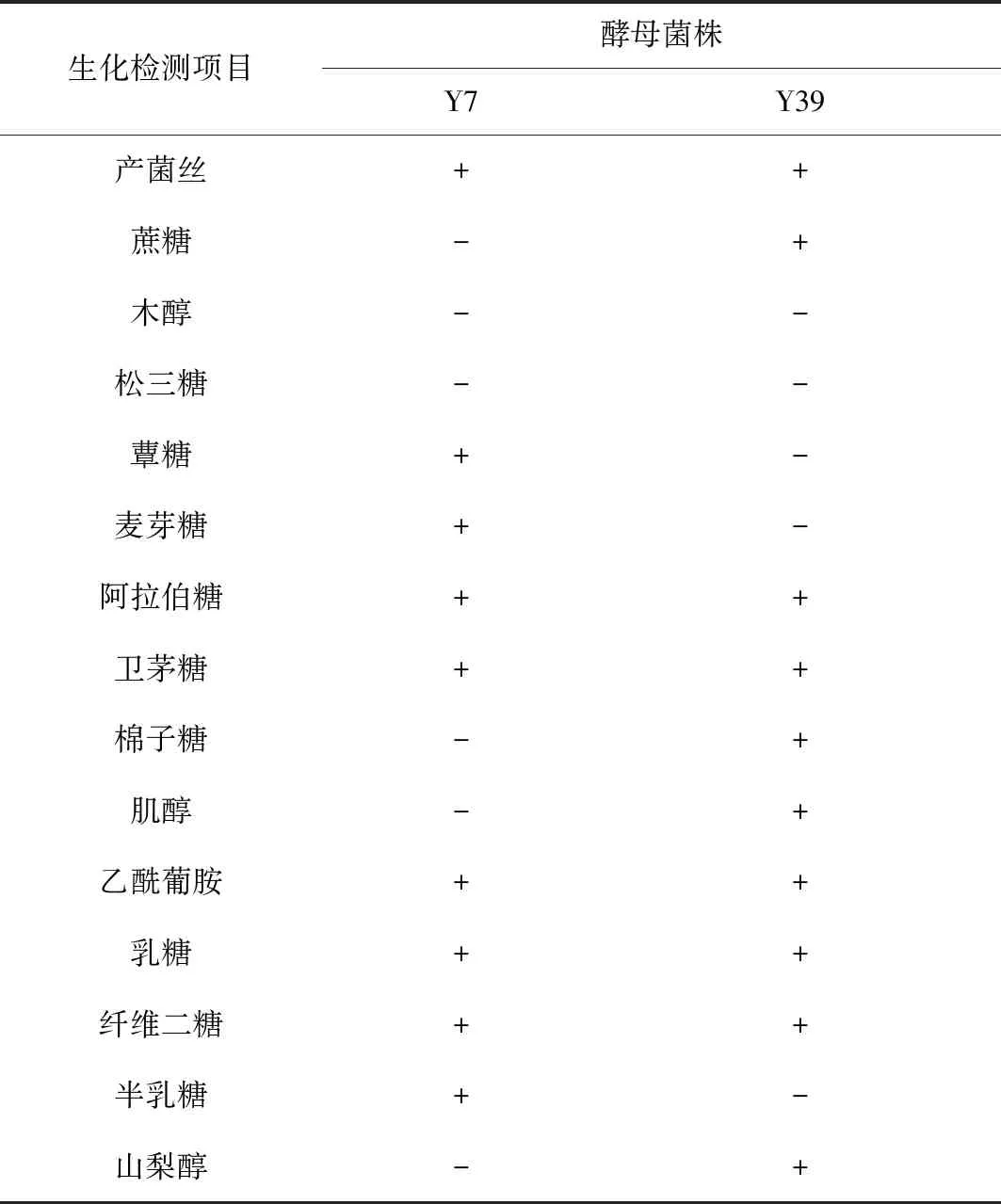
表2 Y7、Y39生理生化鉴定结果
注:表中“+”为阳性,“-”为阴性。
根据酵母菌的形态学特征和表2中的生理生化特征,参考《常见细菌系统鉴定手册》和酵母菌属细菌生化鉴定编码表,鉴定以上2株酵母菌分别为:Y7为热带念珠菌,Y39为乳酒念珠菌。
3 结论
本文从湘西腊肉中共分离出40株酵母菌,经分离、筛选后得到2株耐高温酵母菌,分别为Y7和Y39,经过菌种鉴定后得出Y7为热带念珠菌,Y39为乳酒念珠菌。这些菌株有望用于发酵肉制品高温加工工艺的开发。
