超声微泡联合干细胞移植对心肌梗死大鼠心肌微环境的影响及循环Irisin水平的相关性研究
2019-05-21薛静张周龙陈胜江
薛静,张周龙,陈胜江
心肌梗死(MI)是目前世界范围内致死及致残的主要原因。研究发现超声靶向破坏微泡(UTMD)已经发展成为用于位点特异性药物和基因递送的新的有前景的工具,其具备优良的毛细血管通透性,能无创性地和选择性地将基因递送至梗塞部位[1-3]。骨髓间充质干细胞(MSCs)具有经血液循环归巢至损伤心肌的能力,但目前缺乏促使干细胞向缺血心肌特异性趋化的有效方法,若单纯的通过干细胞在损伤区的归巢能力来进行治疗,相应的疗效一般不很好[4]。本文主要是对超声破坏微泡联合MSCs移植进行心肌细胞修复的实验研究,探讨其是否可促进心肌梗死大鼠血管新生,并分析VEGF和Irisin的表达情况。
1 材料与方法
1.1 一般材料10只Wistar大鼠(2周龄),体重(25±5)g,用于分离与培养骨髓间充质干细胞,60只成年Wistar健康大鼠,体重(219±21)g,用于心肌梗死模型构建,以上实验动物不限定雌雄,购于河南科技大学实验动物中心。声诺维(Sonovue)超声造影剂,购于意大利博莱科公司。心脏彩超机,型号IE33,荷兰Philips公司。
1.2 实验方法
1.2.1 细胞分离与培养幼龄大鼠取胫骨及股骨的骨髓液,采用密度梯度离心法结合贴壁培养技术来分离、纯化与培养大鼠骨髓MSCs,得到符合心肌梗死移植的种子细胞。
1.2.2 动物模型制作Wistar 大鼠以10%水合氯醛(3 ml/kg)腹腔注射麻醉后, 连接心电监护仪,仰卧位固定于手术台, 颈胸部备皮,行气管插管呼吸机辅助通气,打开胸腔 , 暴露心脏 , 找准左心耳,在与肺动脉圆锥交界处下方约2 mm处结扎左冠状动脉前降支,控制3~5 mm左右的进针深度,观察心电图R波增宽、ST段和J点持续抬高为模型制作成功标志。术后常规关胸,腹腔注射青霉素抗感染8万 U/只 ,1/d,连续3 d 。
1.2.3 分组与处理将40只MI模型制备成功的Wistar大鼠随机分为4组:A:超声微泡+MSCs组(US/MB+MSCs);B:单纯 MSCs 组(MSCs);C:超声微泡组(US/MB);D:空白对照组(C)。心梗模型制成后第2 d A组和C组经尾静脉注入声诺维超声微泡溶液1 ml(浓度约2×108个/ml),同时经胸诊断超声辐照,频率为 5MHz,机械指数(MI)1.3,辐照5 s,间隔5 s,共10 min,第4 d及第6 d重复超声辐照微泡操作,共辐照3次,待完成建模第7 d,D组经尾静脉注入1 ml生理盐水作为对照;A组和B组经尾静脉注入干细胞悬液(1×107个细胞混悬于2 ml PBS中)于2 min内缓慢注入。
1.2.4 病理学检测及蛋白水平检测分别于心肌梗死模型建立时取不同时间段及治疗后28 d经尾静脉抽取大鼠静脉血,采用ELISA(酶联免疫吸附)法用于Irisin水平检测,处死大鼠后,取梗死边缘心肌组织,借助免疫组织化学(IHC)染色技术对CD34及VEGF表达水平进行检测,计数微血管密度(MVD);借助Western Blot与ELISA对VEGF蛋白表达水平进行检测。
1.3 统计学分析所有数据均采用SPSS 22.0统计学软件分析,计量资料采用均数±标准差(±s)表示,组间比较采用方差分析,采用SNK-q检验进行组间的两两对比。采用线性相关分析法进行相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠心肌梗死后血清Irisin 表达水平与对照组相比,MI大鼠血清Irisin水平从1 h逐渐下降至24 h,最低值为1 h约(412.1±25.5 )ng/ml,2 h后再次略有增加(427.5±28.6 )ng/ml。总体而言,与对照相比,MI构建后Irisin水平显着降低(P<0.05)(图1)。
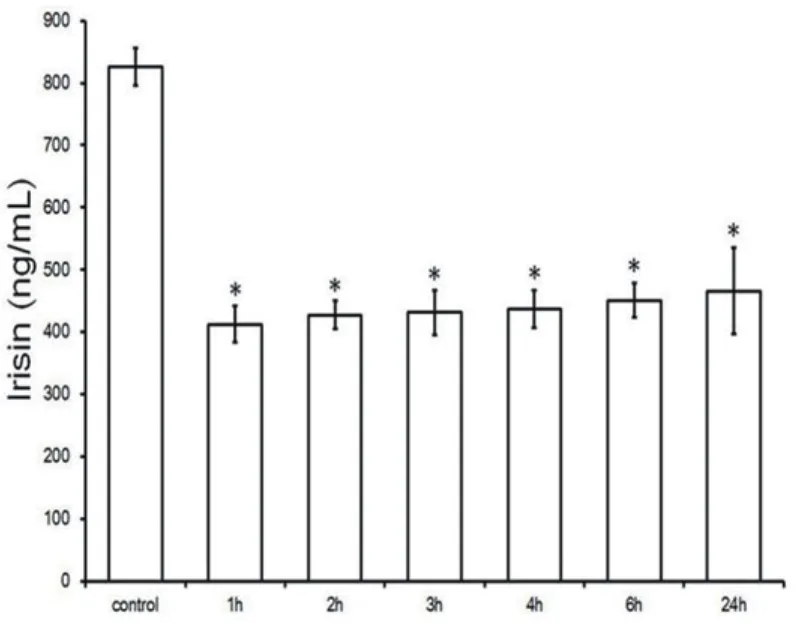
图1 MI大鼠血清Irisin水平

图2 各组大鼠CD34免疫组化图片(×400)

图3 各组大鼠VEGF免疫组化图片(×400)

表1 各组心肌组织微血管计数(个/HP)
2.2 免疫组化检测A组的心肌组织内有大量的CD34和VEGF阳性颗粒表达,显示为棕黄色或棕褐色颗粒(图2~3), CD34定位于血管内皮细胞胞浆或胞膜,以CD34为标记,在显微镜每高倍镜视野下计数微血管数量,结果显示A组新生血管最多, D组最少,差异具有显著性(P<0.05,表1)。
2.3 ELISA法检测心肌VEGF及血清Irisin含量治疗后心肌组织VEGF含量检测结果示A组含量最高,为(3.23±0.21)ng/g,与其他组相比存在显著差异(P<0.05),Irisin含量A组最高,为(607.4±35.6)ng/ml(P<0.05)(图4)。
2.4 Western Blot检测结果通过Western Blot检测,发现A组的VEGF条带最明显,同样A组的Irisin条带也最明显,用Quantity Qne软件定量分析了各组蛋白的表达,显示A组的VEGF及Irisin蛋白表达明显高于其他各组(P均<0.05)(图5)。
2.5 心肌VEGF和血清Irisin水平相关性分析心肌VEGF和血清Irisin水平呈正相关,相关系数r=0.902(图6)。

图4 ELISA法测得各组MI大鼠VEGF和血清Irisin的含量

图5 Western Blot测得各组MI大鼠中VEGF和Irisin蛋白的表达
3 讨论

图6 心肌VEGF和血清Irisin线性相关散点图
急性心肌梗死后很容易引发心肌细胞死亡,目前临床上治疗AMI存在相应的局限性,无法彻底恢复心肌供血。血管新生是心肌缺血的一种血运重建[5]。根据相关数据可得,成熟的脏器已经建成的血管内,炎性反应和损伤等很容易刺激内皮细胞,且可起到诱导血管新生的效果。
大量研究结果表明,超声引发微泡造影剂破损,引发的生物学效应,可以使微血管发生破裂,诱导炎症反应,增加了血管生长因子的表达水平,促进血管新生,并且能够靶向作用于器官或细胞,定位释放药物或基因,从而实现靶向治疗[6-8]。骨髓 MSCs移植在一定程度上能改善心功能,具有取材方便、不涉及伦理道德问题等优点,具有广泛的应用前景。已有文献报道,MSCs可能是通过血管再生[9,10]、分泌细胞因子[11,12]及抑制心室重构[13]来改善心功能。但目前缺乏促使干细胞向缺血心肌特异性趋化的有效方法,因此,提高移植的干细胞向心肌缺血受损区的靶向归巢能力及增加其在靶区的存活率是目前亟待解决的问题。
部分学者提出,急性心肌梗死时损伤局部的VEGF因子其表达水平也在提高[14],从而起到调节干细胞归巢的作用,为增强缺血局部的心肌梗死打下良好的基础。根据以上论述可推断,急性心肌梗死时,损伤部位其环境改变,黏附分子与趋化因子表达的提升,会促进循环血中干细胞聚集到受损心肌中[15]。Kamihata等研究表明[16],移植细胞可以分泌很多类的细胞生长因子,主要如VEGF和转化生长因子等,这些为相应细胞的增殖和分化起到了一定的促进作用,同时为组织细胞的再生提供了基础。移植细胞分泌的生长因子可以起到相应诱导血管形成的效果,有利于促进侧支循环,为血管系统的增殖提供了良好的条件[17]。本研究结果初步表明超声破坏微泡联合MSCs移植可有效促进VEGF表达上调,心肌梗死后血管密度增加。本研究通过ELISA及Western Blot测定来确定VEGF的表达,在A组中观察到约3.5倍的VEGF蛋白表达,A组心肌VEGF含量明显高于其他各组(P<0.05)。
Irisin是一种肌肉因子,可从纤连蛋白Ⅲ型结构域蛋白5(FNDC5)中进行蛋白水解切割和分泌[18]。最近的研究发现Irisin主要在心肌内产生。Irisin是一种新的解偶联thermogenin肽,可以耗尽ATP并增加产热[19]。ATP对于肌细胞活力和正常心脏功能,包括肌原纤维收缩和离子转运是必不可少的[20]。由于肌酸激酶(CK)导致的细胞内ATP产生减少,ATP和磷酸肌酸在人类心肌梗死中减少,是由于心肌细胞丢失引起的底物耗竭[20]。有研究表明血清Irisin的表达水平与心脏冠状动脉的病变程度呈负相关[21],因此,Irisin可以用作一种心肌梗死的诊断性生物标志物[22]。我们研究发现与对照组相比,心肌梗死构建后Irisin水平显着降低(P<0.05),说明Irisin在心肌梗死大鼠中被抑制(图1)。整体趋势与Kuloglu等[22]一致,表明心肌梗死大鼠模型成功建立。并且,观察到在UTMD联合MSCs能够明显恢复Irisin的表达(P<0.05),然而,关于血清Irisin水平,与D组(424.9±28.9)ng/ml相比,A组血清Irisin(607.4 ±35.6)ng / mL只有1.4倍。 这可能是由于Irisin在各种组织中表达,包括心脏和骨骼肌,肝脏,肾脏,外周神经鞘和血清等[23]。所以,确定所有表达Irisin的组织是我们进一步关注的问题之一。另外我们对心肌VEGF和血清Irisin水平进行了相关性分析,显示VEGF和Irisin呈正相关,相关系数r=0.902,这也间接说明了UTMD联合MSCs能逆转梗死心肌,改善心肌存活。
