Bi2S3/TiO2复合光催化剂的制备及光催化还原Cr(Ⅵ)性能研究
2019-05-21赵增迎
杨 璇,赵增迎
(中国地质大学(北京)数理学院,北京 100083)
1 引 言
1972年,Honda和Fujishima发现TiO2具有光催化活性。之后,半导体光催化技术受到了广泛的关注[1-5]。近年来,由于成本低,光活性高,且水溶液稳定,TiO2被广泛应用于环境保护等领域[6-9]。然而,由于宽带隙(3.0~3.2 eV)的限制,TiO2仅可利用太阳光谱中的紫外光(UV)。此外,光生电子-空穴对的快速复合,严重制约了TiO2的催化效率[10]。为此,人们采用掺杂金属或者非金属离子,来引入晶格缺陷[11-12];在TiO2表面沉积贵金属,来促进光生电子-空穴对的分离[13],用以提高TiO2的光催化效率。
除上述方法之外,与其它半导体复合也可以明显改善TiO2的光催化性能[14-17]。例如许多氧化物和硫化物与TiO2复合后都具有优异的光催化性能[18-19]。不同带隙的半导体与TiO2复合,可促进复合材料中光生电子-空穴对的分离,并可抑制其再次复合[20]。此外,不同光吸收带隙半导体材料的复合,也可使其光吸收范围得到扩展,最终使光催化性能得到提高。
在与TiO2复合的半导体材料中,Bi2S3带隙较窄(1.3 eV),在降解有机染料和光解水制氢方面具潜在的优良性能。据报道,在可见光激发下,Bi2S3产生的光电子可注入到TiO2的导带(CB),并在Bi2S3和TiO2的界面构成的异质结,有利于光生电子-空穴对的分离[21]。然而,相关研究很不完善,特别是将其用于光催化还原Cr(Ⅵ)等重金属离子,以及不同形貌的TiO2与不同含量的Bi2S3对催化性能的影响研究,尚未有报道。
本文以熔盐法制备了单晶二氧化钛[22-23],并采用水热法将其与Bi2S3复合,得到Bi2S3/TiO2复合催化剂,研究了不同配比Bi2S3/TiO2复合材料的微观形貌、带隙变化及光催化还原Cr(Ⅵ)的性能,探究了复合材料光催化性能提高的机理。
2 实 验
2.1 试剂与仪器
主要试剂:钛酸四丁酯、乙酸、硝酸钠、硝酸钾、乙醇、硝酸铋、硫代乙酰胺、重铬酸钾等,均为分析纯试剂。
主要仪器:聚四氟乙烯内衬的不锈钢高压釜、光催化反应仪(XPA-7型,南京胥江)、电热恒温鼓风干燥箱(DHG-9070A)、箱式烧结炉(KSL-1200 W)、超声仪、多头磁力加热搅拌器(HJ-4A)、500 W氙灯。
2.2 单晶TiO2纳米粒子的制备
实验采用熔盐法制备TiO2纳米粒子。实验步骤如下:将钛酸四丁酯和乙酸以5∶2的比例混合,并将所得溶液磁力搅拌1 h。将所得溶液转移到聚四氟乙烯内衬的不锈钢高压釜中,在150 ℃下水热处理24 h。所得样品用蒸馏水和乙醇离心洗涤,80 ℃干燥。将样品研磨后,采用熔盐法处理,即与NaNO3和KNO3按2∶5∶5的比例充分混合,并在450 ℃下煅烧4 h,获得白色单晶TiO2粉末[22-23]。
2.3 Bi2S3/TiO2复合材料的制备
不同量的五水硝酸铋(Bi(NO3)3·5H2O)溶于乙醇中制得A溶液50 mL。将0.551 g硫代乙酰胺(TAA)溶解在乙醇中制得B溶液50 mL。
将2.2中所制得的单晶TiO2材料加入到A溶液中浸泡10 min,过滤收集得到的固体颗粒加入到B溶液中, 200 ℃水热处理14 h。将所得黑色沉淀物分别用蒸馏水和乙醇离心洗涤,80 ℃干燥,得到Bi2S3/TiO2复合光催化材料。
2.4 测试表征
采用X射线衍射(XRD,D/max-RB,Cu Kα,λ=0.15418 nm)方法对样品进行检测,衍射角2θ在20°~80°的范围内,扫描速率为6°/min。采用搭载能谱分析仪(EDS)的扫描电子显微镜(SEM,SU8020)及透射电镜观察样品的微观结构。以硫酸钡做参比,通过扫描型紫外可见分光光度计(Perkin-Elmer,Lambda 900)在200~800 nm范围内,对样品的紫外可见吸收进行。通过计算(Ahm)1/2得到材料的带隙能量值Eg。通过表面光电压光谱技术(SPV)研究样品的光致电荷转移特性。500 W的氙灯光源、单色仪及表面光电压谱仪(CHF XQ500 W)等均由北京泊菲莱公司提供。
2.5 光催化还原Cr(Ⅵ)
光催化还原Cr(Ⅵ)的反应在常温常压下上述光催化反应仪中进行。为了达到光催化剂和水中Cr(Ⅵ)之间的吸附-解吸平衡,先将50 mg光催化剂加入到pH=3的50 mL 的10 mg/L的Cr(Ⅵ)溶液中暗吸附30 min,之后再进行光催化还原实验。反应过程中用420 nm滤光片对500 W氙灯光源进行过滤得到可见光后,对反应溶液进行辐照,同时不断对混合液进行磁力搅拌。每隔1 h取样5 mL反应液离心后,取得的上清液用二苯卡巴肼(DPZ)分光光度法测定Cr(Ⅵ)的含量。
3 结果与讨论
3.1 XRD测试
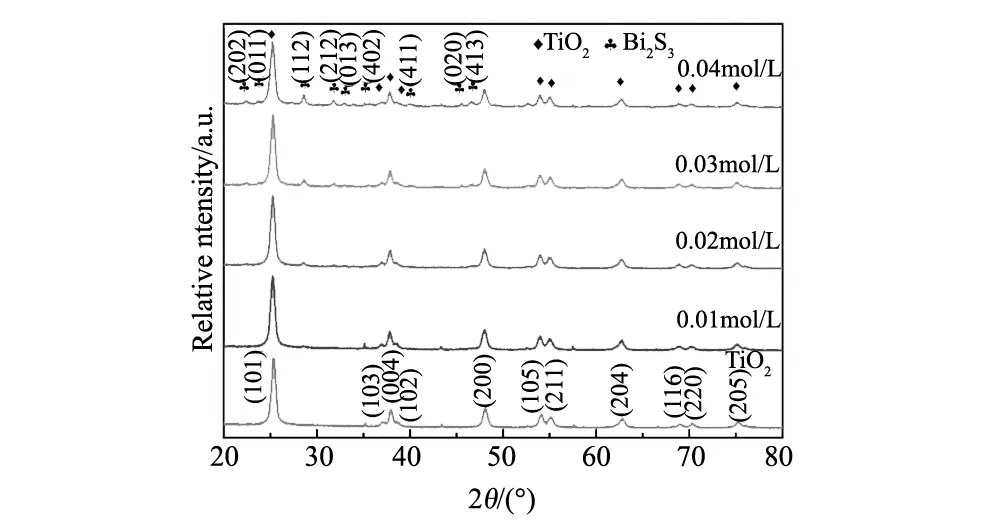
图1 用不同浓度反应液Bi(NO3)3制备样品的XRD图谱Fig.1 XRD patterns of samples prepared withdifferent concentration of Bi(NO3)3
图1为制备样品的XRD图谱,由图可见样品的TiO2是锐钛矿型(JCPDS. No. 71-1166)。并且Bi(NO3)3反应液的浓度依次增大,其所制备的样品中Bi2S3的含量也在逐渐增加。当Bi(NO3)3反应液的浓度小于0.001 mol/L时,因Bi2S3的含量较低,样品中仅检测出锐钛矿型TiO2[24]。当Bi(NO3)3浓度超过0.02 mol/L时,XRD检测出样品中的Bi2S3为三方晶系(JPCDS. No. 17-0320)。
3.2 扫描及透射电镜测试
图2为单晶TiO2和Bi2S3/TiO2复合材料的SEM照片。可以清楚地看到,TiO2(图2a)与Bi2S3复合后,TiO2颗粒表面会复合宽约十几纳米、长可达1 μm的长条形Bi2S3(图2b),并且随着Bi(NO3)3反应溶液浓度的升高,TiO2上长条形Bi2S3有增多的趋势(图2c,d)[25]。

图2 (a)单晶TiO2,不同Bi(NO3)3反应液制备的Bi2S3/TiO2复合样品SEM照片(b)0.01 mol/L;(c)0.02 mol/L;(d)0.04 mol/LFig.2 SEM images of (a) single crystal TiO2, and Bi2S3/TiO2composite samples prepared fromdifferent Bi(NO3)3with concentration of 0.01 mol/L(b), 0.02 mol/L(c), and 0.04 mol/L(d)
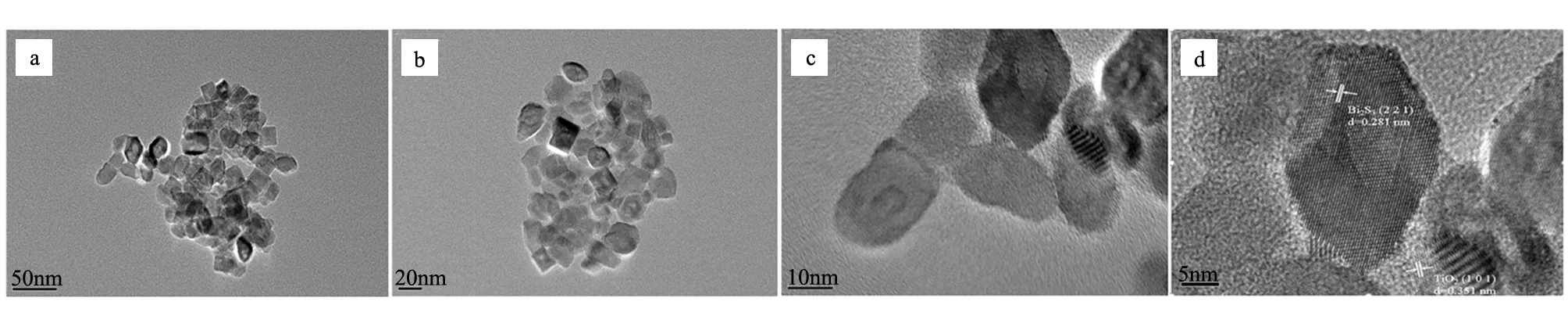
图3 所制备光催化材料的TEM照片(a,b)单晶TiO2,(c,d)Bi2S3/TiO2复合样品Fig.3 TEM images of single crystal TiO2(a,b), Bi2S3/TiO2composite samples(c,d)
图3a,b为单晶TiO2样品的TEM照片,图3c,d为0.02 mol/L Bi(NO3)3反应液所制备Bi2S3/TiO2样品的TEM照片。图中显示了Bi2S3/TiO2复合材料的晶格条纹,并可识别出间距为0.351 nm晶格条纹对应所制备TiO2样品的(101)晶面[26],而晶面间距为0.281 nm的晶格条纹对应于Bi2S3的(221)晶面[27]。且由图3可看出,该Bi2S3/TiO2复合样品由Bi2S3和TiO2晶体颗粒紧密复合构成。
3.3 紫外可见吸收光谱测试
图4(a)为单晶TiO2和不同浓度Bi(NO3)3反应液制备的Bi2S3/TiO2复合样品的紫外可见吸收光谱。由于电子从价带激发到导带(O 2p → Ti 3d),TiO2在350 纳米附近具有强吸收带。当其与Bi2S3复合后,测试结果表明,Bi2S3/TiO2复合催化剂的吸收边缘向可见光区域(400~800 nm)延伸。而且随Bi2S3含量的增加,复合催化剂对光的吸收增强。这是由于Bi2S3带隙宽度与TiO2(3.2 eV)相比较窄,禁带宽度为1.3 eV,电子激发所需的能量更小,具有较强的光谱吸收适应性。因此Bi2S3/TiO2复合材料的吸光范围可由UV延伸到可见光区域。图4(b)为单晶TiO2和所制Bi2S3/TiO2复合催化剂的Kubelka-Munk曲线。由此计算各样品所得带隙能量值列于表1中。可以看出,随着Bi2S3含量的增加,样品的带隙变窄,所得复合催化剂的光催化效率也有所提高,这也与图4(a)所示的红移现象一致。

图4 (a)单晶TiO2和不同浓度Bi(NO3)3反应液制备的复合样品Bi2S3/TiO2的紫外-可见吸收光谱,(b)相应的Kubelka-Munk曲线Fig.4 (a)Ultraviolet-Visible absorption spectra of single crystal TiO2and Bi2S3/TiO2composite samplesprepared from different Bi(NO3)3concentrations, (b)Kubelka-Munk curves

samplesPure TiO20.01 mol/L0.02 mol/L0.03 mol/L0.04 mol/LEg/eV3.062.902.822.472.17
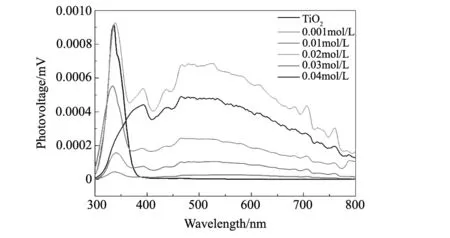
图5 所制备的单晶TiO2和复合光催化剂样品Bi2S3/TiO2的SPS响应Fig.5 SPS response of single crystal TiO2and Bi2S3/TiO2composite sample prepared from different Bi(NO3)3concentrations
表面光电压光谱测试(SPS)是一种研究半导体特征参数的技术方法,可以反映出光照下条件下光生载流子的分离和转移行为[28-29]。单晶TiO2和不同浓度Bi(NO3)3反应液制备的Bi2S3/TiO复合样品的SPS响应值如图5所示。可以看出纯TiO2在350 nm处显示出SPS响应峰,这是由于电子从价带激发到导带(O 2p → Ti 3d)而产生的 。同时,Bi2S3/TiO2复合催化剂的表面光电压信号在可见光区有所增强,当Bi(NO3)3浓度为0.02 mol/L时达到最高值。SPS信号越高,光致电荷载流子的分离率越高。TiO2导带的光生电子可以很容易地转移到Bi2S3的价带,而Bi2S3和TiO2之间的界面阻碍了光生空穴和电子的重组,因此Bi2S3/TiO2复合样品的SPS响应信号高于单晶TiO2。且由图可见0.02 mol/L Bi(NO3)3反应液制备的Bi2S3/TiO2复合样品具有最高的SPS信号响应。而当Bi2S3的含量继续增加,TiO2表面的一些活性点可能会被覆盖[25-27,30],SPS响应信号则相应减弱。
图6(a)和(b)为420 nm滤光片滤光后氙灯可见光辐照下,所得样品Cr(Ⅵ)光催化还原去除效率及相对应的-ln(C/C0)曲线图。开始光照前,先避光进行样品吸附Cr(Ⅵ)的反应,使样品吸附Cr(Ⅵ)达到饱和。随后打开氙灯开始辐照样品及Cr(Ⅵ)溶液。在相同的时间间隔内(60 min),单晶TiO2样品仅有约9%的Cr(Ⅵ)被光催化还原效率,而Bi2S3/TiO2复合催化剂的还原效率远高于单晶TiO2,在相同条件下0.02 mol/L浓度的Bi(NO3)3反应液制备的最佳样品的光催化还原效率达到86%。由于光催化反应前样品已经吸附饱和,因此光照开始后反应液中Cr(Ⅵ)浓度的进一步下降,应是光催化还原的作用。且光催化还原反应后的铬离子应脱离吸附饱和的样品表面。
如图7所示,TiO2的导带处于比Bi2S3更正的位置,因此可以用(1)式和(2)式来描述电子从Bi2S3注入到TiO2的过程。
Bi2S3-TiO2→Bi2S3(e-+h+)-TiO2
(1)
Bi2S3(e-+h+)-TiO2→Bi2S3(e-)-TiO2(h+)
(2)
(3)
H2O +h+→ H++ ·OH
(4)
Cr(Ⅵ)在酸性条件下被还原为Cr(Ⅲ)((3)式),同时如(4)式所示,Bi2S3的价带产生的空穴会与水反应形成羟基自由基(·OH)。因此,适量的Bi2S3可以改善TiO2的光催化活性。而过量Bi2S3的复合,则会导致TiO2的光催化活性降低,这可能是由于TiO2表面上的一些活性点被过多的Bi2S3覆盖而损害了催化活性[28-29,31]。
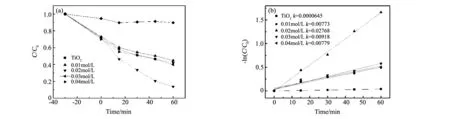
图6 (a)在可见光照射下,不同浓度Bi(NO3)3制备的Bi2S3/TiO2复合样品和单晶TiO2催化Cr(Ⅵ)的还原曲线,(b)相应的-ln(C/C0)图Fig.6 (a)Photocatalytic reduction of Cr(Ⅵ) by single crystal TiO2and Bi2S3/TiO2composite samplesprepared from different Bi(NO3)3under visible light, (b)-ln(C/C0) diagram of the photocatalytic reduction
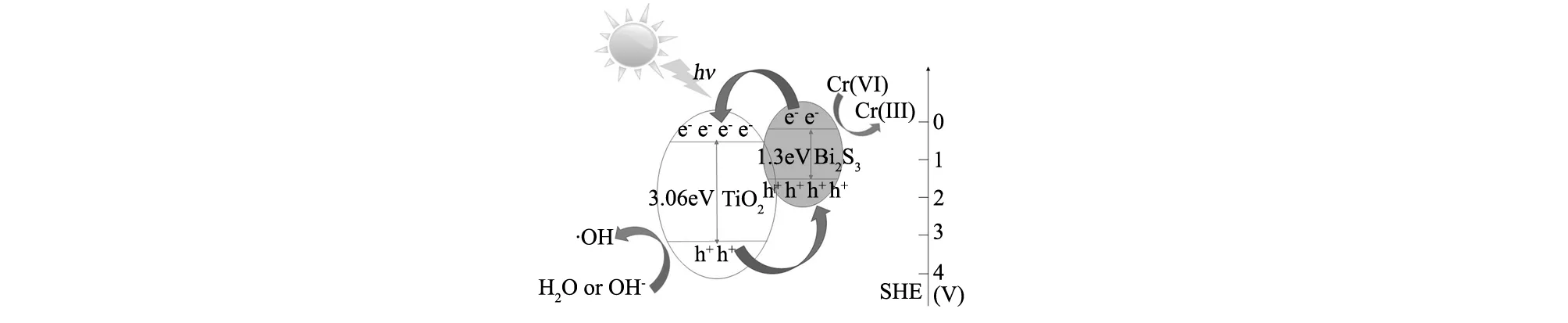
图7 Bi2S3/TiO2复合光催化剂还原Cr(Ⅵ)机理图Fig.7 Mechanism diagram of reduction of Cr(Ⅵ) by Bi2S3/TiO2composite photocatalyst
4 结 论
首先通过熔盐法制备了单晶二氧化钛,然后通过水热法制备了不同配比的Bi2S3/TiO2复合光催化剂。复合光催化剂对水中Cr(Ⅵ)的可见光还原去除效率明显高于未复合TiO2,其中0.02 mol/L Bi(NO3)3反应液制备的复合样品具有最高光催化还原效率。实验表明,Bi2S3/TiO2复合材料的带隙随着Bi2S3复合量的增加而变窄,提高了可见光的利用效率。而DRS及SPV测试表明TiO2与Bi2S3复合可降低光生电子和空穴的复合速率,从而提高了Cr(Ⅵ)的光催化还原效率。
