凹凸棒土负载硫化纳米零价铁对水中Cu(II)的去除机理研究
2019-05-18李春侠范先媛孙泽伟张家源
刘 红,李春侠,范先媛,孙泽伟,张家源
(1. 武汉科技大学资源与环境工程学院,湖北 武汉,430081;2. 武汉科技大学冶金矿产资源高效利用与造块湖北省重点实验室,湖北 武汉,430081)
铜是一种常见的工业废水排放物,印染、化工、有色冶炼、电镀及金属加工等行业均会产生大量的含铜废水[1]。然而,环境中的重金属铜难以直接被生物降解,仅能发生迁移和形态转化,并且会参与到食物链的循环中,最终在生物体内富集,对动植物及人类健康造成了严重危害[2]。传统的含铜废水处理方法包括化学沉淀法、吸附法及电化学法等,但这些方法仍存在易引起二次污染、效率低及能耗高等不足[3]。
近年来,零价铁(ZVI)凭借其强还原性及良好的环境相容性,在重金属及氯代有机物处理等方面的研究上取得了一定的进展,其中纳米级零价铁(nZVI)的比表面积相较于毫米、微米级零价铁更大,因而具有更高的反应活性[4-6],但其在实际应用中,仍存在易团聚、表面易被氧化形成钝化层及电子选择性差等不足[7]。而将纳米零价铁负载于多孔固体材料(如碳纳米管、膨润土、活性炭等)上,利用载体的分散效应,即负载后nZVI分散于载体表面及孔隙内,这在很大程度上改善了其团聚问题[8-10]。另一方面,有研究者采用对纳米零价铁进行硫化改性的方式来解决其表面易钝化的问题,研究发现,硫的掺杂使得纳米零价铁表面形成了硫铁化物,这样避免了零价铁与氧气的直接接触,减缓了材料表面钝化,从而降低了其活性损失[11-12]。
本文将上述多孔材料负载和硫化改性相结合,以一种比表面积大且吸附能力强的天然纳米材料——凹凸棒土(长0.5~5 μm,直径20~70 nm)为载体[13-14],并利用硫代硫酸钠对纳米零价铁进行硫化改性,制得凹凸棒土负载硫化纳米零价铁复合材料(S-nZVI@ATP),对比研究了负载及硫化改性前后材料的微观形貌、比表面积与孔结构差异,考察了S-nZVI@ATP对水中Cu(II)的去除能力,并且探讨了负载型硫化纳米零价铁去除Cu(II)过程中的界面反应。
1 材料与方法
1.1 原料与试剂
本实验所用试剂为NaBH4、FeSO4·7H2O、Na2S2O3和Cu(NO3)2,均为分析纯。凹凸棒土 (Attapulgite,ATP)购自安徽省明光市明美矿物有限公司。
1.2 样品的制备
称取干燥后的凹凸棒土0.5583 g,放入装有20 mL FeSO4溶液并持续通氮气保护的三口烧瓶中,搅拌30 min使其充分混合;随后,逐滴加入80 mL的0.5 mol/L现配NaBH4溶液,滴加完毕后加入2.5 mL 1 mol/L的Na2S2O3溶液(硫与零价铁的摩尔比为0.25∶1)。将烧瓶置于超声清洗器超声处理30 min后,对溶液进行真空抽滤,依次用去离子水、无水乙醇各清洗3次,将得到的固体粉末置于冷冻干燥机中干燥8 h,得到凹凸棒土负载硫化纳米零价铁复合材料(零价铁与凹凸棒土的质量比为2∶1),记作S-nZVI@ATP样品,将其真空密封保存于冰箱冷冻层[8],以备使用。纳米零价铁样品的制备除不添加Na2S2O3溶液及凹凸棒土粉末外,与上述步骤相同,记作nZVI样品。
1.3 静态吸附试验及Cu(II)浓度检测
采用Cu(NO3)2配制具有一定初始浓度的铜溶液,调节溶液的pH值为5.6左右,随后以0.5 g/L的投加量向溶液中加入所制S-nZVI@ATP复合材料,设置反应温度为25 ℃、转速为200 r/min,在恒温振荡器中振荡至材料与溶液充分反应。每间隔一段时间,用带有0.45 μm滤膜的注射器取出适量溶液,利用德国Analytik Jena公司NovAA350型火焰原子吸收光谱仪测定溶液中Cu(II)浓度,并计算复合材料在t时刻的Cu(II)吸附量。
1.4 样品的表征
采用美国FEI公司Nava 400 Nano 型扫描电子显微镜(SEM)、日本JOEL公司JEM-2100 UHRS高分辨透射电镜(TEM)及其配备的能谱仪(EDS)对样品的形貌及成分进行观察分析。采用美国Micromeritics公司ASAP 2020比表面积分析仪测定样品的BET比表面积、孔径分布、孔体积等参数。采用日本Rigaku公司D/max-2500 X射线衍射仪(XRD)分析材料的物相及晶型结构。使用日本岛津公司Axis Nova X射线光电子能谱仪(XPS)测定样品的元素构成及各元素的化学结合能态。
2 结果与讨论
2.1 材料的表征
2.1.1 SEM分析
图1分别为凹凸棒土、纳米零价铁、S-nZVI@ATP样品及其与初始浓度为2mmol/L的Cu(II)溶液反应1 h之后产物的SEM照片。由图1(a)可见,凹凸棒土呈针棒状或纤维状棒晶,棒晶彼此之间紧密排列或相互交织、黏结在一起,形成柴垛状结构;图1(b)显示,纳米零价铁颗粒呈较规则的球形,球形颗粒由于自身的磁力吸引聚集为串珠状结构;而经过硫化和凹凸棒土负载后,如图1(c)所示,复合材料团聚现象减轻,硫化纳米零价铁分散在凹凸棒土纤维状棒晶上,基本观察不到聚集的串珠状结构,甚至还被分散成单个球形颗粒(见图中圆形区域内);从图1(d)可以观察到,S-nZVI@ATP样品去除Cu(II)后的反应产物中大部分球形颗粒消失,出现一些层片状的反应沉积物附着在凹凸棒土表面。
(a) 凹凸棒土
(b) nZVI
(c)S-nZVI@ATP
(d) 反应产物
图1 不同材料的SEM照片
Fig.1 SEM images of different materials
凹凸棒土之所以对纳米零价铁起到较好的分散作用,原因除了本身具有较大比表面积外,还可能是因为:①纤维状凹凸棒土的相互交织堆积,会使纳米零价铁在形成聚集体过程中被分散,由其产生的空间阻隔也会阻碍纳米铁颗粒相互聚集为长链;②纳米零价铁经硫化后磁力会减小,纳米铁颗粒之间的聚集因而也会减弱[15-16];③由于凹凸棒土有一定的离子交换能力,制备S-nZVI@ATP样品过程中部分Fe2+会与凹凸棒土中的Mg2+、Ca2+等发生阳离子交换,经NaBH4还原为零价铁后,就会成为单个纳米铁颗粒嵌入到凹凸棒土结构中[8]。
2.1.2 BET比表面积与孔结构
纳米零价铁、凹凸棒土及S-nZVI@ATP样品的BET比表面积、孔体积和孔径测定结果列于表1中。从表1中可以看出,与纳米零价铁相比,S-nZVI@ATP样品的比表面积提高了约1.35倍,表明纳米零价铁经过凹凸棒土负载和硫化改性后,团聚问题在很大程度上得到改善,该结果与由图1所示的微观形貌观察结果一致。此外,由表1还可见,S-nZVI@ATP样品的孔体积比纳米零价铁增加了一倍多,而较大的比表面积和孔体积有利于铜离子在复合材料表面点位的吸附和孔道内的扩散[17]。由此可见,所制复合材料对铜离子具有更快的吸附速率和更好的去除效果。
表1 材料的BET比表面积和孔结构参数
Table 1 BET specific surface areas and pore structure parameters of materials
2.1.3 XRD分析
图2所示为凹凸棒土及S-nZVI@ATP样品的XRD衍射图谱。将图2与标准图谱进行对比可以发现,在2θ为8.49°、22.9°、26.7°、30.97°和43.44°出现的衍射峰为凹凸棒土的特征峰;而在2θ为44.9°左右出现的衍射峰是零价铁的特征峰,表明复合材料中零价铁负载到了凹凸棒土表面;在2θ为26.5°及50.3°左右出现的较为尖锐的衍射峰为FeS的特征峰,表明样品中硫化试剂已将部分零价铁硫化改性成为FeS;此外,在2θ为40.1°左右出现了Fe2O3的特征峰,这可能是由于样品保存时部分零价铁被氧化所致。
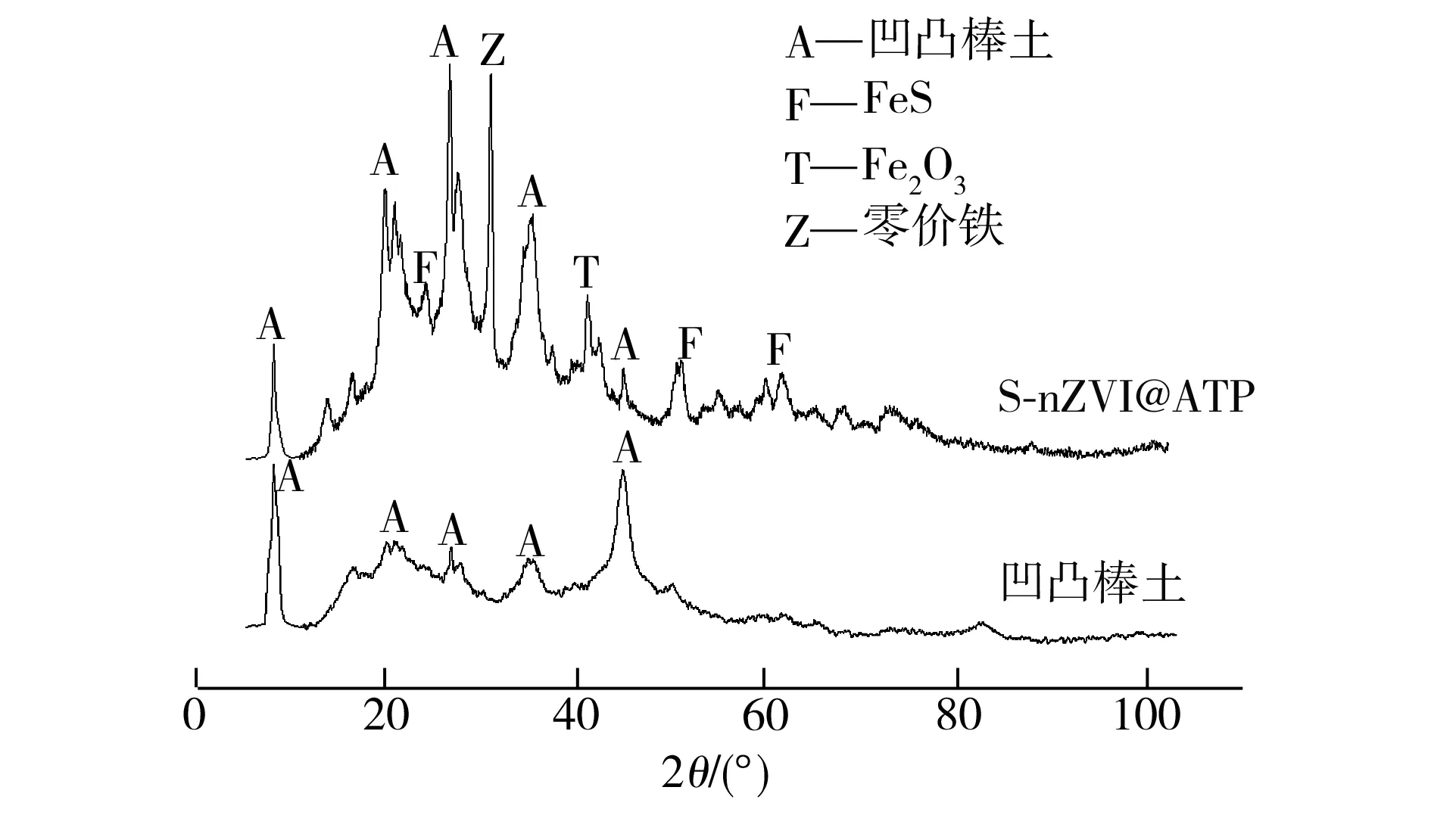
图2 凹凸棒土及S-nZVI@ATP样品的XRD图谱
Fig.2 XRD patterns of attapulgite and S-nZVI@ATP samples
2.1.4 TEM分析
图3为单个纳米零价铁颗粒和单个硫化纳米零价铁颗粒的TEM照片。从图3(a)可以看出,纳米零价铁颗粒为较规则的球形颗粒,外界面由于与氧气接触发生氧化而形成了一层较薄的氧化铁壳,纳米零价铁的这种核-壳结构与文献[6]报道的研究结果一致。经测量,该纳米零价铁颗粒的直径约57.6 nm,铁氧化物壳厚约4.2 nm,与文献[6]中报道的纳米零价铁40~80 nm粒径范围及3~5 nm的氧化铁壳厚度一致。从图3(b)可以看出,由于硫化后的纳米零价铁外界面沉积了一层FeS,故颗粒呈不太规则的球形,某些部位还出现棱角,并且FeS层的厚度不均,测得在17~21 nm之间;另外,测得硫化纳米零价铁颗粒的直径约为118.5 nm,即与未硫化的nZVI颗粒相比直径增大了约1倍。

(a)nZVI

(b) S-nZVI@ATP
2.2 复合材料去除水中Cu(II)的机理
图4所示为S-nZVI@ATP复合材料对不同初始浓度Cu(II)的去除效果。实验过程中,以1 L/min的速率向三口烧瓶中持续通入氮气,以保证溶液中溶解氧浓度始终保持在接近于0的水平,保护零价铁不被溶解氧氧化。由图4可以看到,此条件下,S-nZVI@ATP复合材料对Cu(II)的去除能力最大可达到9.20 mmol/g左右,而根据制备时S-nZVI@ATP材料中的零价铁含量,计算得到Fe0对Cu(II)的理论还原量为9.23 mmol/g,可见,S-nZVI@ATP样品对Cu(II)的去除主要凭借的是Fe0对Cu(II)的还原作用。
为了进一步说明S-nZVI@ATP复合材料对水中Cu(II)的去除机制,利用Langmuir-Hinshelwood动力学模型(简写为L-H模型)对该过程进行拟合[17],其方程可表示为:
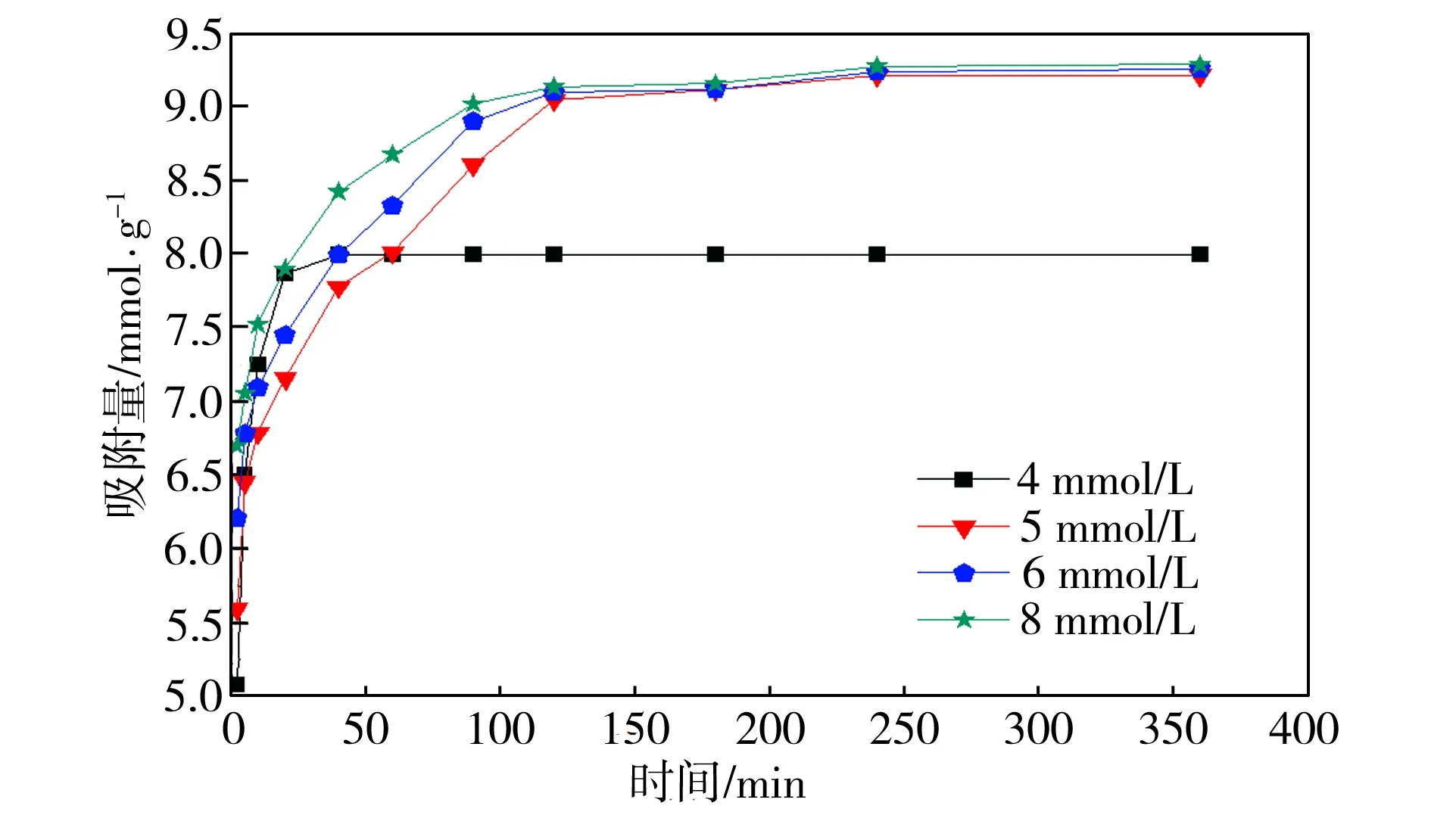
图4 不同Cu(II)初始浓度下复合材料的除Cu(II)效果
Fig.4 Removal effect of Cu(II) by composites with different initial Cu (II) concentrations
(1)
式中:r0表示反应物在20 min内的平均反应速率,(mg/L)·min-1;C0表示Cu(II)初始浓度,mg/L;k1表示反应速率常数,(mg/L)·min-1;k2表示Langmuir吸附平衡常数,L/mg。
采用图4中S-nZVI@ATP样品去除不同Cu(II)初始浓度的实验数据进行拟合,得到如图5所示的Cu(II)初始浓度的倒数1/C0与平均反应速率的倒数1/r0的拟合关系曲线。由图5可见,两者呈良好的线性关系,拟合相关系数R2=0.9774,符合L-H模型,表明复合材料去除水中Cu(II)是吸附和还原协同作用的结果;另外,根据图5计算得到,S-nZVI@ATP样品与Cu(II)反应速率常数k1=19.49 (mg/L)·min-1,吸附常数k2=0.0204 L/mg,k1远大于k2,即吸附速率要慢于还原反应速率,可见吸附是整个过程的速度控制步骤。

图5 S-nZVI@ATP复合材料去除Cu(II)的L-H模型拟合曲线
Fig.5 L-H model fitting curve for removing Cu(II) by S-nZVI@ATP composite
为探究S-nZVI@ATP复合材料对Cu(II)的吸附类型及最大吸附量,采用Langmuir吸附等温模型对不同Cu(II)初始浓度下S-nZVI@ATP复合材料对Cu(II)的平衡吸附容量数据进行拟合,得到吸附速率KL为0.0963 g/mg,相关系数R2为0.9906,表明所制S-nZVI@ATP复合材料对Cu(II)的去除符合Langmuir吸附模型。该过程为单分子层吸附,主要通过吸附材料表面与铜的化学作用力进行吸附,亦即为化学吸附[15]。另外,拟合还得到材料对水中Cu(II)的最大吸附量Qmax为9.25 mmol/g(587.8 mg/g),与通过实验和理论计算得到的最大Cu(II)去除量一致。
图6所示为S-nZVI@ATP复合材料与初始浓度为2 mmol/L的Cu(II)溶液反应1 h后产物的XPS图谱。根据XPS电子结合能对照表可知,图6(a)中与结合能932.3 eV处峰对应的是Cu2+,952.5 eV处的能谱峰由Cu0产生,表明反应过程中Fe0将部分Cu2+还原成Cu0,这是因为Fe2+/Fe0的氧化还原电位比Cu2+/Cu0低(E0(Cu2+/Cu0)=0.3402 V,E0(Fe2+/Fe0)=-0.409 V),故Fe0与Cu2+之间会按下式进行反应:

(2)
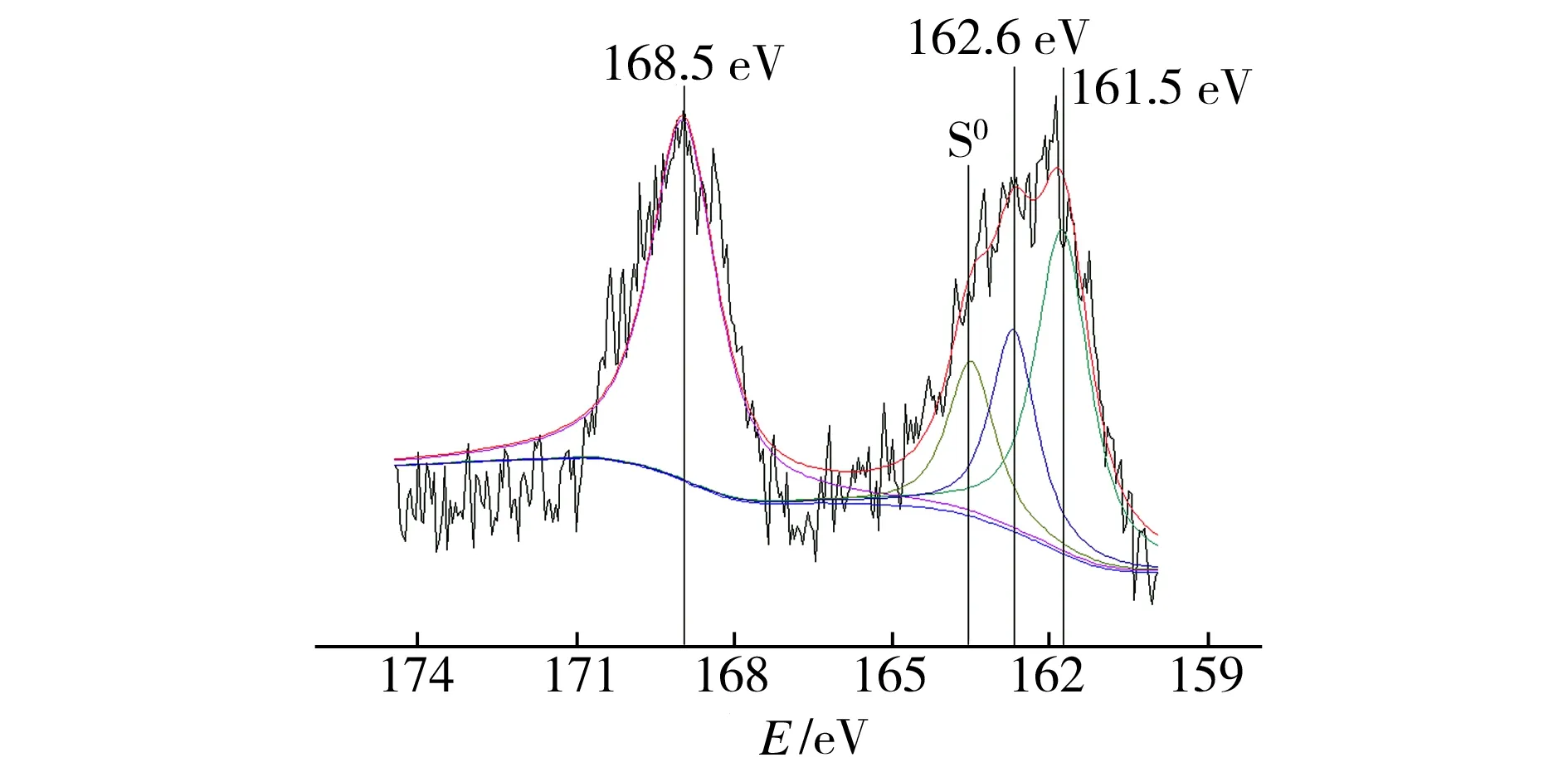
图6(b)中,出现在711.5 eV处的能谱峰由Fe2+和 Fe3+引起,表明Fe0在去除铜之后被氧化为Fe2+,随后又被氧化为Fe3+。图6(c)中,出现在163.9 eV的峰对应的是S0,而168.5、162.6、161.5 eV处出现的峰对应的均是S2-。
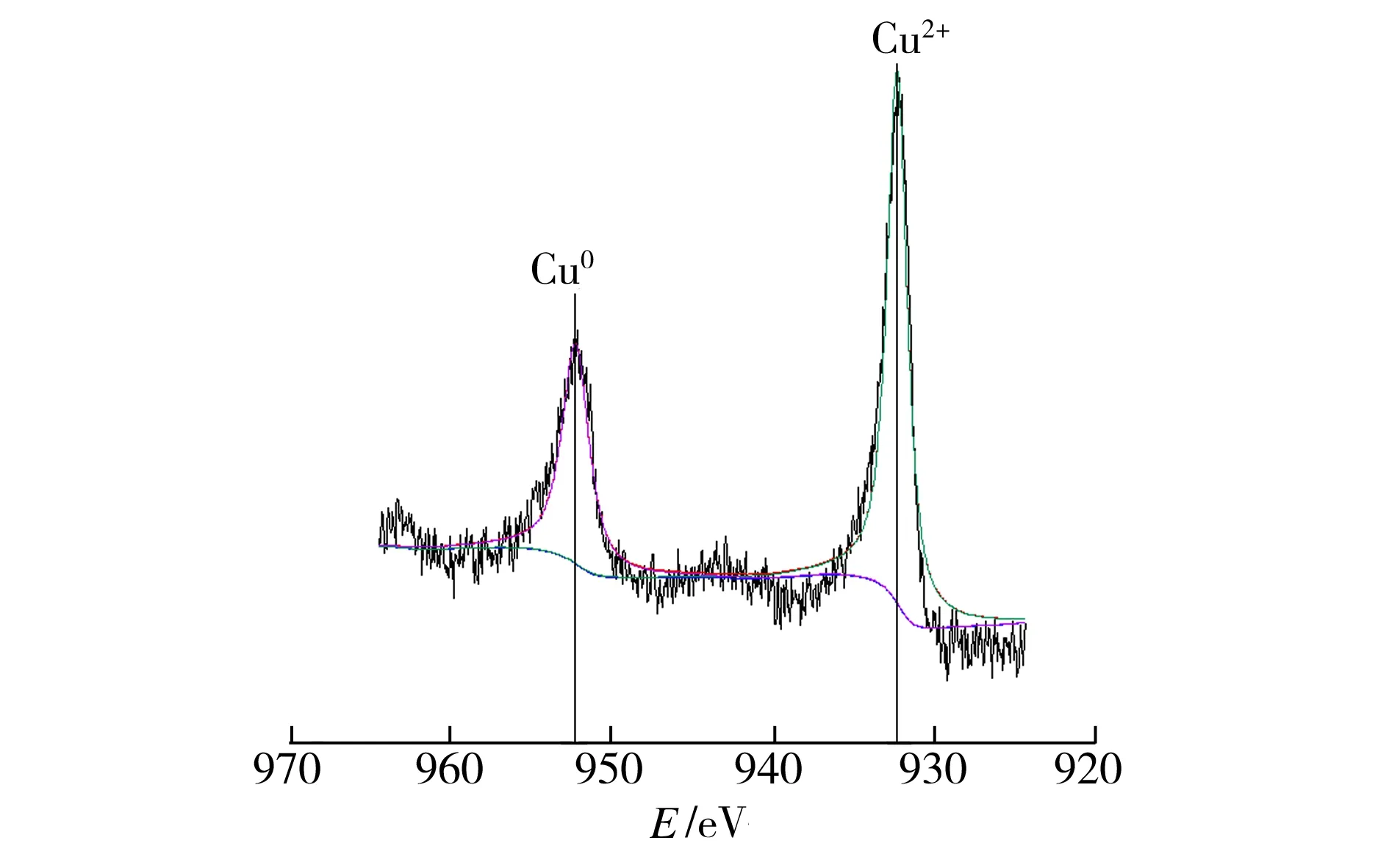
(a) Cu2p
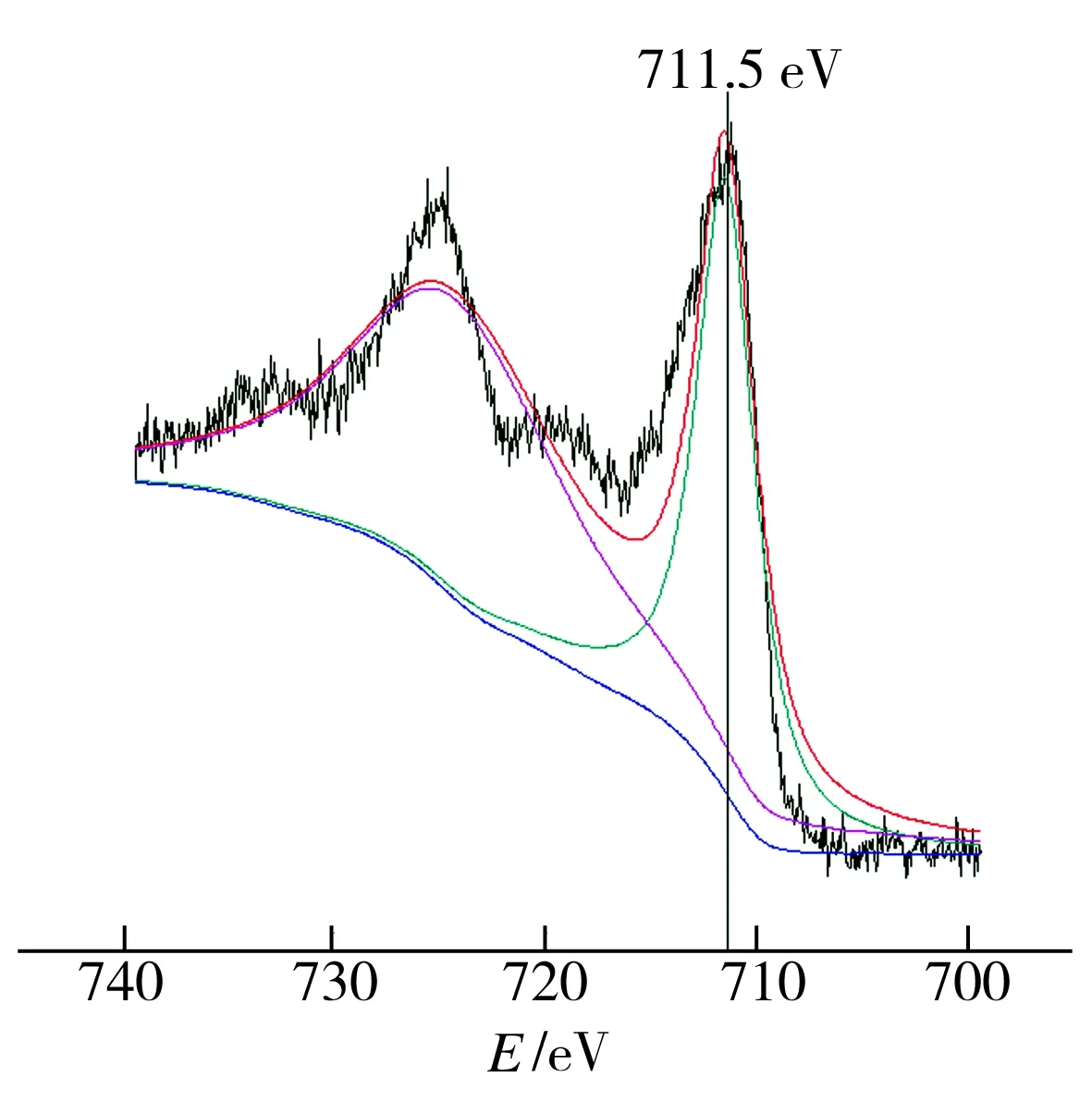
(b) Fe2p
(c) S2p
从图2所示S-nZVI@ATP复合材料的XRD图谱中并未发现有S0的衍射峰存在,可见S0是在反应过程中生成的,原因可能是具有一定氧化能力的Fe3+将S2-氧化而形成S0(E0(Fe3+/Fe2+)=0.77 V,E0(S/S2-)=-0.48 V),具体反应可表示为:

(3)
图7为同条件下S-nZVI@ATP复合材料去除Cu(II)后反应产物的XRD图谱。从图7可以看出,反应后FeS和Fe0的特征峰消失,主要出现了CuS及Cu0的特征峰,FeS之所以转变成为CuS主要是由于CuS的溶度积(Ksp=6.3×10-36)比FeS的溶度积(Ksp=3.3×10-18)小,具体反应可表示为:

(4)
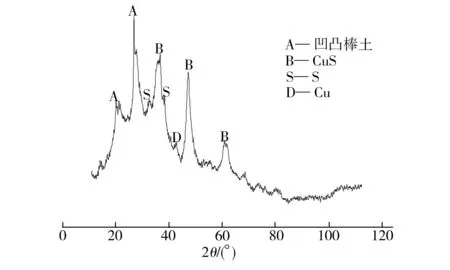
图7 反应产物的XRD图谱
结合反应产物的XRD和XPS图谱分析可知,S-nZVI@ATP复合材料去除水中Cu(II)的机理为:所制复合材料将溶液中Cu(II)吸附到材料表面后,一部分吸附至表面的Cu(II)被Fe0还原为Cu0去除,一部分Cu(II)转化为CuS被去除。
研究过程中发现,若不向Cu(II)溶液中通入氮气,S-nZVI@ATP复合材料吸附Cu(II)后会发生脱附现象,如图8所示。由图8可见,随着反应时间的增长,复合材料对水中Cu(II)吸附量出现先增大后减小的情况,即在0~20 min内吸附量逐渐增大,但在20 min以后吸附量明显降低,并且Cu(II)初始浓度愈大,脱附现象愈明显。究其原因,可能是每次开盖取样时会导致氧气进入溶液,而溶解氧会与复合材料反应,导致其活性降低。根据图9所示的铜溶液中溶解氧含量随时间的变化关系可知,在刚开始反应3 min内,溶液中溶解氧量接近于0(Fe0与溶解氧反应会消耗溶解氧),随后又由于氧气的进入,溶液中溶解氧含量逐渐升高,反应结束时可达5.8 mg/L。

图8 不通氮气时Cu(II)初始浓度对复合材料除Cu(II)效果的影响
Fig.8 Effect of initial Cu(II) concentration on the removal effect of Cu(II) by composite without N2blowing
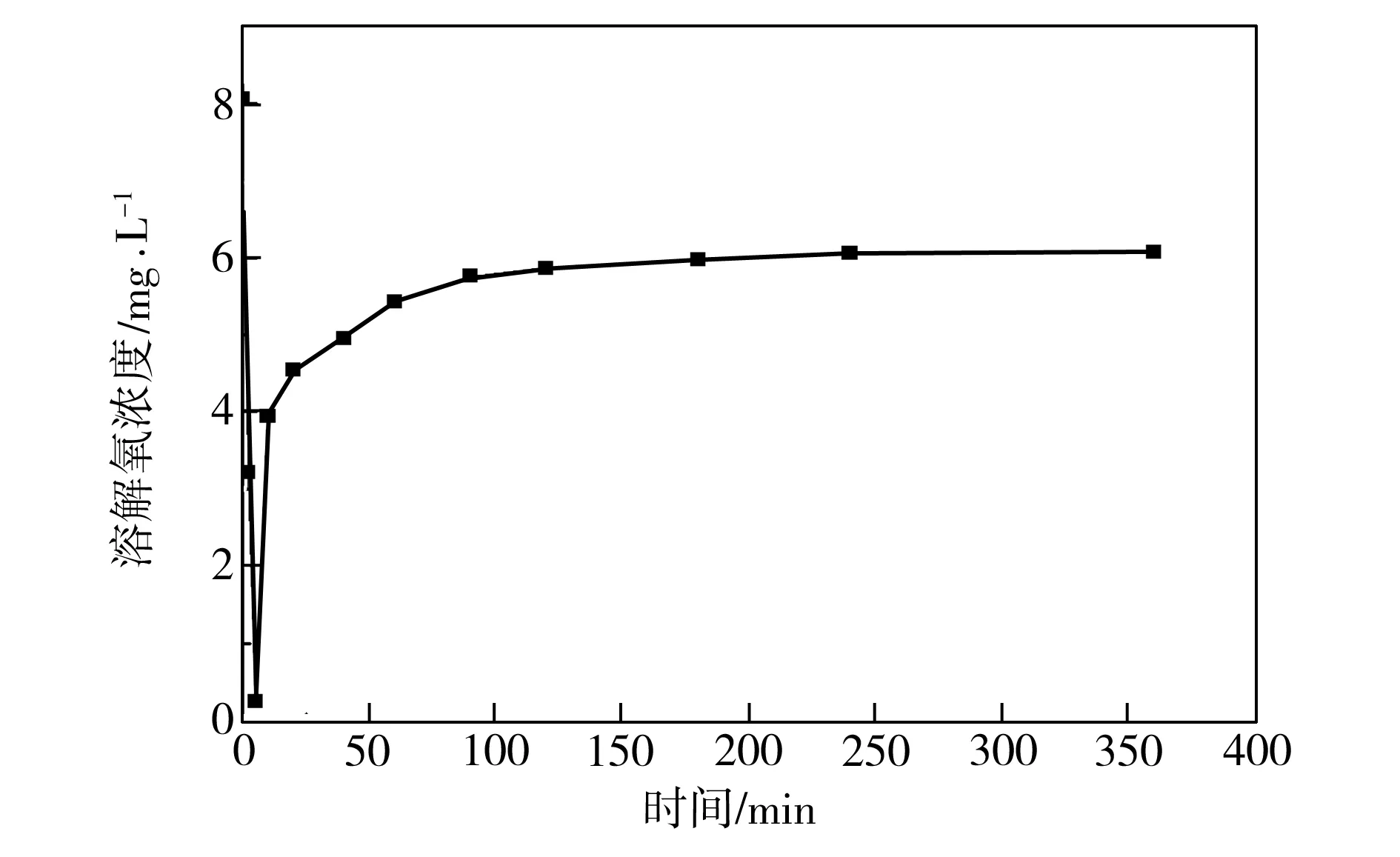
图9 铜溶液中溶解氧浓度随反应时间的变化
Fig.9 Variation of dissolved oxygen concentration in Cu(II) solution with reaction time
为探究S-nZVI@ATP复合材料去除水中Cu(II)时发生先吸附后脱附现象的原因,对复合材料与初始浓度为2 mmol/L的Cu(II)溶液反应不同时间后的产物进行EDS分析,结果如图10所示。由图10可以看出,与反应20 min后的产物相比,60 min的反应产物中Cu含量减小,这与图8观察到的铜脱附现象一致;而Fe和O的含量增大,表明生成的铁氧化物含量增加,亦即溶解氧使nZVI颗粒被氧化而失去还原能力,导致吸附未被还原的Cu(II)脱附,再次进入溶液。
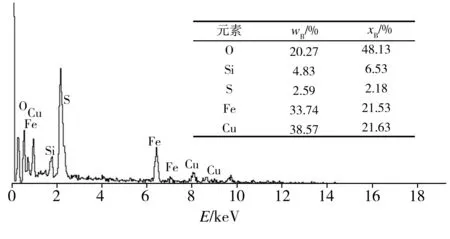
(a) 20 min的反应产物
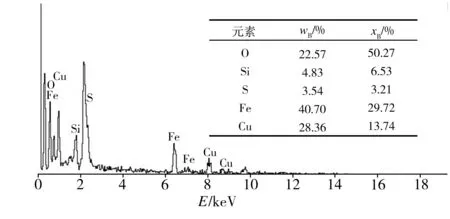
(b) 60 min的反应产物
Fig.10 EDS spectra of the reaction products after Cu(II) removal for different times
3 结论
(1)纳米零价铁经由凹凸棒土负载和硫化改性后,比表面积由19.60 m2/g增至46.04 m2/g,提高了约1.35倍,纳米零价铁的串珠状结构变短,并且会有单个硫化纳米零价铁球形颗粒出现;负载及硫化后的纳米零价铁颗粒的直径增大了一倍,即由57.61 nm增大到118.5 nm。
(2)凹凸棒土负载硫化纳米零价铁材料去除Cu(II)的机理主要是Fe0将Cu2+还原为Cu0以及FeS转化为溶度积更小的CuS,复合材料对Cu(II)的去除符合L-H吸附/还原模型以及Langmuir吸附等温模型,最大吸附-还原量高达9.25 mmol/g(587.8 mg/g),与由实验和理论计算得到的Cu(II)去除量相一致。
(3)当铜溶液中有氧气进入而使溶解氧不能保持一直接近于0时,复合材料去除水中Cu(II)时会发生先吸附后脱附的现象,原因是溶解氧使纳米零价铁被氧化而失去还原能力,导致吸附未被还原的Cu(II)脱附,再次进入溶液。
