淀粉样前体蛋白裂解片段sAPPβ、Aβ和AICD对SH-SY5Y细胞氧化损伤和线粒体膜电位的影响
2019-05-16陶鹏飞姚晨赫孙雅煊孟欣怡黄汉昌
陶鹏飞,姚晨赫,孙雅煊,孟欣怡,黄汉昌
(北京联合大学生物活性物质与功能食品北京市重点实验室,中国北京100191)
阿尔茨海默病(Alzheimer’s disease,AD)是一种以神经元丢失和脑萎缩为主要特征的中枢神经系统(central nervous system,CNS)退行性疾病,其临床表现为记忆丢失、语言水平下降和行动能力受损[1~3]。AD主要的神经病理学特征之一是脑细胞外出现被称为老年斑(senile plaque,SP)的淀粉样斑块,其主要成分为β-淀粉样蛋白(amyloid βprotein,Aβ)。Aβ由淀粉样前体蛋白(amyloid precursor protein,APP)经β-裂解途径产生。AD确切的发病机制尚不明确。目前,被广泛认同的“淀粉样级联假说”认为,大脑中Aβ异常聚集导致神经退行性病变,最后引发神经元的死亡。
APP的编码基因位于人类第21号染色体长臂(21q21.3),至少由18个外显子和17个内含子组成。该基因经转录翻译后因剪切方式的不同,可形成至少8种长度不等的APP异构体,其中以APP695、APP751和 APP770较为常见,APP695主要表达于神经细胞[4~5]。细胞膜上的APP目前被认为主要经两种途径裂解。一方面,在细胞膜上的APP主要被α-分泌酶剪切,剪切位点为APP695序列的第612、613个氨基酸残基(对应APP770序列的第687、688个氨基酸残基)之间,产生可溶性的N端碎片sAPPα并释放到细胞外,同时产生C端碎片CTFα(又称C83)绑定于细胞膜上,随后CTFα被γ-分泌酶剪切,生成Aβ17-40或Aβ17-42,以及胞内域片段AICD[6~7]。由于γ-分泌酶剪切位点位于Aβ氨基酸残基之间,因此没有Aβ的生成,这一剪切途径被称为非淀粉样途径[8~10]。另一方面,细胞膜上的部分APP通过依赖网格蛋白的内吞作用迅速内化,并被运输到核内体(endosome)或者反式高尔基体。在此,APP首先被β-分泌酶在APP695序列的第596、597个氨基酸残基(对应APP770序列的第671、672个氨基酸残基)之间剪切,产生N端片段sAPPβ和C端片段CTFβ(又称C99),随后CTFβ 被 γ-分泌酶剪切,生成 Aβ1-40或 Aβ1-42,以及胞内域片段AICD,此过程被称为淀粉样途径[5,11~13]。
有研究表明,Aβ异常聚集可导致细胞内神经原纤维缠结(neurofibrillary tangle,NFT)的形成、内质网氧化应激、线粒体功能障碍等,随后引发神经元丢失[10,14]。值得注意的是,内源性Aβ片段的生成也伴随着sAPPβ、AICD片段的产生。本研究利用慢病毒介导DNA转染的方法,分别构建了过表达sAPPβ、Aβ和AICD片段的 SH-SY5Y细胞系,并考察了其对细胞氧化损伤和线粒体膜电位去极化的影响。
1 材料与方法
1.1 材料与试剂
过表达sAPPβ、Aβ和AICD片段的SH-SY5Y神经瘤细胞由本实验室自行构建。将表达sAPPβ、Aβ和AICD蛋白片段(分别为APP蛋白的18~596、597~638和639~695氨基酸残基)的基因编码序列构建到质粒表达载体pLV[Exp]-EGFP:T2A:Puro-EF1A中,包装成慢病毒颗粒。
High Capacity cDNA Reverse Transcription Kit试剂盒、THUNDERBIRD SYBR qPCR Mix试剂盒购于美国Thermo Fisher Scientific公司;TRIzol®Reagent试剂盒购于美国Ambion公司;抗sAPPβ抗体(A8967)购于美国Sigma-Aldrich公司;抗AICD抗体(A8717)购于美国Sigma-Aldrich公司;抗Aβ抗体(Ab2539)购于英国Abcam公司;抗β-actin抗体(A1978)购于美国Sigma-Aldrich公司;细胞增殖-毒性检测试剂盒(Cell Counting Kit-8,CCK-8)购于日本Dojindo公司;乳酸脱氢酶 (lactate dehy drogenase,LDH)测定试剂盒、JC-1线粒体膜电位检测试剂盒购于碧云天生物技术有限公司;活性氧检测试剂盒(Reactive Oxygen Species Assay Kit)购于美国Genview公司;辣根酶标记的山羊抗兔IgG(IH-0011)购于北京鼎国昌盛生物技术有限公司;辣根酶标记的山羊抗鼠IgG(IH-0011)购于北京鼎国昌盛生物技术有限公司;新霉素(G418)购于美国Genview公司。
1.2 方法
1.2.1 细胞培养和转染
将人神经母细胞瘤SH-SY5Y细胞均匀接种于培养皿中,加入5 mL含血清和双抗的培养基[basal medium/DMEM/F 12(1︰1)培养基+10%胎牛血清+1%链霉素-青霉素溶液]。细胞培养于37℃、5%CO2培养箱中,3~4 d传代1次。将SH-SY5Y细胞按1×105个/孔均匀接种于6孔板中,24 h后将培养液换成不含双抗的培养液,继续培养4 h。取其中一孔计数,按照感染复数(multiplicity of infection,MOI)=5,分别将携带目的基因sAPPβ、Aβ和AICD质粒的慢病毒颗粒以及不含目的基因的空质粒慢病毒颗粒加入细胞培养液。将细胞分为5组:1)空白对照组,即正常SH-SY5Y细胞;2)sAPPβ细胞组,即过表达sAPPβ片段的SH-SY5Y细胞;3)Aβ细胞组,即过表达Aβ片段的SH-SY5Y细胞;4)AICD细胞组,即过表达AICD片段的SH-SY5Y细胞;5)阴性对照组,即表达空质粒的SH-SY5Y细胞。
1.2.2 新霉素筛选转染组细胞和细胞荧光蛋白的表达
质粒载体包含荧光蛋白表达基因EGFP和新霉素(G418)抗性基因。细胞转染24 h后,加入含5%G418的筛选培养基,成功筛选的细胞经扩大培养得到稳定转染的细胞。将稳定转染的细胞置于荧光显微镜下,曝光时间1 ms拍摄明场照,曝光时间200 ms拍摄荧光照。
1.2.3 RT-PCR分析目的基因的mRNA表达
将稳定转染的5组SH-SY5Y细胞分别以2×105个/孔接种于Φ3 cm培养皿中,24 h后采用TRI-zol®Reagent试剂盒提取细胞总RNA。利用酶标仪在260/280 nm下测定总RNA吸光度(260/280 nm吸光度比值在1.6~1.8)。将总RNA通过High Capacity cDNA Reverse Transcription Kit试剂盒反转录成cDNA,采用实时荧光定量聚合酶链式反应(real-time fluorescence quantitative-polymerase chain reaction,RT-PCR)扩增cDNA,主要参数如下:5℃变性15 min;3步循环,即95℃ 15 s、54℃30 s、72℃45 s,循环数为40。目的基因引物如表1所示。
1.2.4 Western-blot分析目的蛋白片段的表达情况
将稳定转染的5组SH-SY5Y细胞分别以5×105个/孔接种于Φ3 cm培养皿中,24 h后提取细胞总蛋白质,Western-blot检测各组细胞目的蛋白片段的表达情况。操作方法:细胞用PBS洗涤两遍,每个培养皿加入120 μL含有磷酸酶抑制剂和蛋白酶抑制剂的RIPA裂解液,4℃下收集细胞,13 000 g离心15 min。BCA法测定总蛋白质浓度。15%SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electropheresis,PAGE)分离不同相对分子质量的蛋白质并转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上;5%脱脂奶粉封闭1 h,4℃下一抗孵育过夜;经TBST缓冲液洗涤后常温条件下二抗孵育2 h;增强型化学发光液(enhanced chemiluminescence,ECL)测定蛋白质条带光密度值,并用软件Quantity One分析条带灰度值。
1.2.5 CCK-8法测定细胞存活力
采用CCK-8法测定细胞存活力,CCK-8中的主要成分WST®-8能被细胞内的脱氢酶还原为水溶性的橙黄色甲臜,生成甲臜的量与细胞数成正比,可间接测定活细胞数量。将5组SH-SY5Y细胞以1×104个/孔分别接种于96孔板中,培养24 h,每孔加入10 μL CCK-8溶液,置于37℃含5%CO2的培养箱中培养4 h。于波长450 nm(参比波长630 nm)下酶标仪测定OD值,OD值/每孔细胞数得到细胞相对存活力,单位为OD/104个细胞。
1.2.6 乳酸脱氢酶(LDH)活力测定
将5组SH-SY5Y细胞分别以1×104个/孔接种于96孔板中(细胞悬液为每孔100 μL),培养24 h,按照LDH测定试剂盒操作说明测定培养基中的LDH活力。正常情况下LDH存在于细胞质中,当细胞膜受到损伤时,LDH会释放到培养基中,通过检测培养基中LDH的酶活性可以反映细胞膜的损伤程度。LDH酶活性测定原理:LDH可催化NAD+生成NADH,NADH和碘硝基氯化四氮唑蓝(2-p-iodophenyl-3-nitrophyltetrazolium chloride,INT)经硫辛酰胺脱氢酶催化反应生成NAD+和强生色物甲臢,后者于490 nm波长处产生吸收峰。实验中用酶标仪测定OD值,OD值/每孔细胞数得到细胞LDH相对活力,单位为OD/104个细胞。
1.2.7 细胞内活性氧(reactive oxygen species,ROS)水平测定
将5组SH-SY5Y细胞分别以1×104个/孔接种于96孔板中,培养24 h,加入无荧光的二氯二氢荧光素二乙酸酯(dichloro-dihydro-fluorescein diacetate,DCFH-DA)探针(终浓度为 10 μmol/L)。DCFH-DA可自由穿过细胞膜,在细胞内被酯酶水解为DCFH,不能穿过细胞膜的DCFH在细胞内被活性氧氧化为有荧光的DCF。DCFH-DA探针孵育细胞20 min后用无血清培养液洗涤细胞3次,采用荧光酶标仪测定OD值(激发波长502 nm,发射波长530 nm),OD值/每孔细胞数得到细胞内活性氧相对水平,单位为OD/104个细胞。
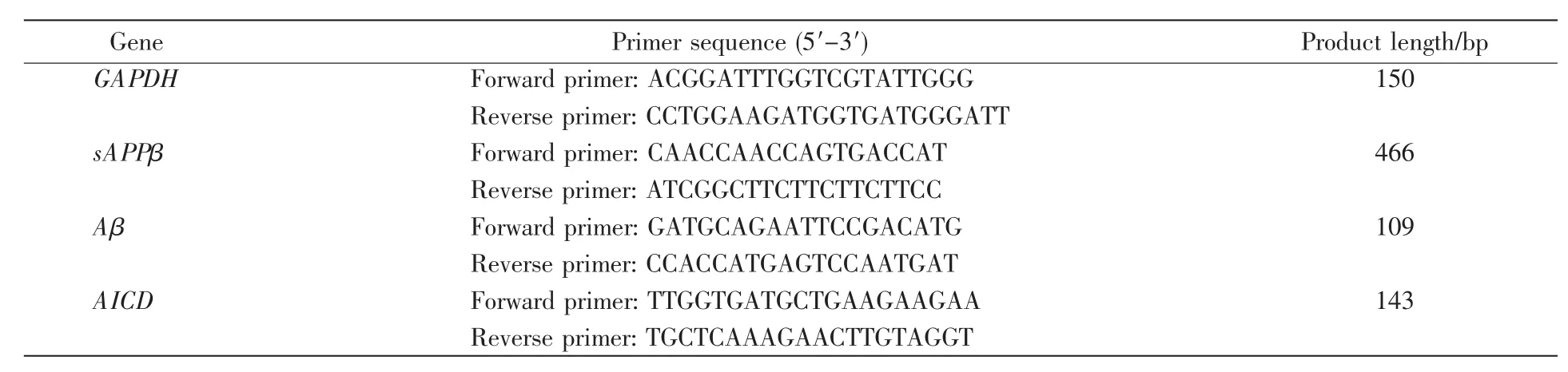
表1 RT-PCR所用引物序列Table 1 Primers for RT-PCR
1.2.8 线粒体膜电位测定
将5组SH-SY5Y细胞分别以1×104个/孔接种于96孔板中。培养24 h后吸除培养液,每孔加入100 μL无血清培养液和100 μL JC-1染色工作液,充分混匀,于细胞培养箱中37℃下孵育20 min。吸除上清,用JC-1染色缓冲液洗涤2次,每孔加入100 μL无血清培养液,采用荧光酶标仪测定荧光强度。线粒体膜电位较高时,JC-1聚集在线粒体基质中形成聚合物,产生红色荧光;线粒体膜电位较低时,JC-1不能聚集在线粒体基质中,此时JC-1为单体,产生绿色荧光。JC-1单体最大激发/发射波长为514 nm/529 nm,聚合体最大激发/发射波长为585 nm/590 nm。采用荧光酶标仪分别测定聚合物和单体的OD值,(ODred/ODgreen)/细胞个数表示线粒体膜电位去极化的程度。
1.3 数据分析
实验中各项指标测定均至少重复3次,采用IBM SPSS Statistics软件进行实验数据的统计分析。实验数据以平均值±标准差(±s)表示,组间数据比较采用独立样本t检验,P<0.05视为差异有显著性。Sigma Plot计算机软件作图。
2 结果与分析
2.1 细胞形态及荧光蛋白表达
从细胞EGFP荧光蛋白的表达可以看出,空白对照组SH-SY5Y细胞无明显荧光(极微弱的荧光可视为细胞自发荧光),而转染组细胞均可见荧光(图1 a~e),初步表明质粒基因组已成功整合到宿主细胞,并表达了荧光蛋白。与空白对照组SH-SY5Y 细胞(图 1A)相比,Aβ 组(图 1C)和 AICD组(图1D)的细胞突触变短,胞体收缩,初步表明转染Aβ或AICD基因后,SH-SY5Y细胞形态受到一定的影响。
2.2 RT-PCR检测目的基因mRNA表达
目的基因导入宿主细胞后是否表达,首先要确定目的基因是否能转录为mRNA。在RT-PCR的结果处理中,将循环阈值设为0.1,得到各组细胞Ct值,根据相对定量法:目的基因相对表达量=2-△△Ct,得到各转染组细胞目的基因相对表达量。结果如图2所示,与空白对照组和阴性对照组细胞相比,sAPPβ、Aβ和AICD组细胞中目的基因相对表达量均显著升高(P<0.05),表明转染sAPPβ、Aβ和AICD基因的细胞成功过表达了sAPPβ、Aβ和AICD基因,这在mRNA水平上确定了目的基因已成功导入宿主细胞,并能够转录相应的mRNA。

图1 细胞形态及荧光图(A)空白对照组细胞明场图;(a)空白对照组细胞荧光图;(B)sAPPβ细胞组明场图;(b)sAPPβ细胞组荧光图;(C)Aβ细胞组明场图;(c)Aβ细胞组荧光图;(D)AICD细胞组明场图;(d)AICD细胞组荧光图;(E)阴性对照组细胞明场图;(e)阴性对照组细胞荧光图。Fig.1 Morphological and fluorescence images of cells in each group(A)White light of control group;(a)Fluorescence of control group;(B)White light of sAPPβ group;(b)Fluorescence of sAPPβ group;(C)White light of Aβ group;(c)Fluorescence of Aβ group;(D)White light of AICD group;(d)Fluorescence of AICD group;(E)White light of negative control group;(e)Fluorescence of negative control group.
2.3 Western-blot分析目的蛋白片段的表达情况
进一步在翻译水平研究目的基因的表达情况。结果如图3所示,与空白对照组和阴性对照组细胞相比,分别转染sAPPβ、Aβ和AICD基因的细胞中sAPPβ、Aβ和AICD蛋白片段的表达水平均显著升高(P<0.05),表明转染sAPPβ基因的细胞过表达了sAPPβ蛋白片段,转染Aβ基因的细胞过表达了Aβ蛋白片段,转染AICD基因的细胞过表达了AICD蛋白片段。
2.4 过表达 sAPPβ、Aβ和 AICD基因对 SHSY5Y细胞存活力的影响
为了研究APP的β裂解片段sAPPβ、Aβ和AICD对细胞生长的影响,本研究进一步考察了转染目的基因后细胞的存活力。结果如图4所示,与空白对照组细胞相比,阴性对照组细胞的存活力无显著差异,表明载体基因组转染到宿主细胞基因组后,宿主细胞的相对存活力不受影响;与空白对照组和阴性对照组相比,转染sAPPβ、Aβ和AICD基因后细胞的相对存活力均显著下降(P<0.05)。以上结果表明过表达 sAPPβ、Aβ或AICD基因后,SH-SY5Y细胞的存活力在一定程度上会降低。
2.5 过表达 sAPPβ、Aβ和 AICD基因对 SHSY5Y细胞膜损伤的影响
图2 目的基因的mRNA相对表达水平(n=3)*:与空白对照组相比,差异显著(P<0.05);#:与阴性对照组相比,差异显著(P<0.05)。Fig.2 The relative expression levels of transfected target genes(n=3)*:Compared with control group,the difference is significant(P<0.05);#:Compared with negative control group,the difference is significant(P<0.05).
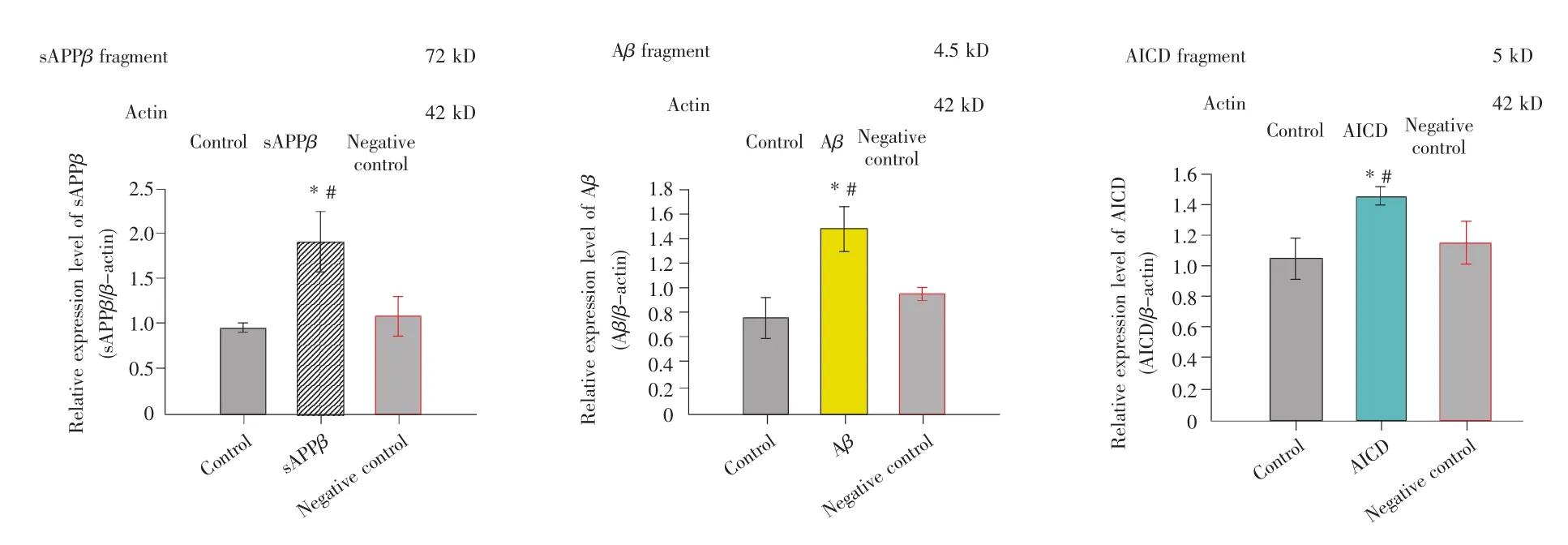
图3 sAPPβ、Aβ和AICD蛋白片段的相对表达量(n=3)*:与空白对照组相比,差异显著(P<0.05);#:与阴性对照组相比,差异显著(P<0.05)。Fig.3 The relative expression levels of sAPPβ,Aβ and AICD fragments(n=3)*:Compared with control group,the difference is significant(P<0.05);#:Compared with negative control group,the difference is significant(P<0.05).

图4 细胞相对存活力(n=7)*:与空白对照组相比,差异显著(P<0.05);#:与阴性对照组相比,差异显著(P<0.05)。Fig.4 The relative cell viability(n=7)*:Compared with control group,the difference is significant(P<0.05);#:Compared with negative control group,the difference is significant(P<0.05).

图5 细胞培养液中的LDH相对活性(n=7)*:与空白对照组相比,差异显著(P<0.05);#:与阴性对照组相比,差异显著(P<0.05)。Fig.5 The relative level of LDH in culture medium(n=7)*:Compared with control group,the difference is significant(P<0.05);#:Compared with negative control group,the difference is significant(P<0.05).
细胞膜的完整程度与细胞凋亡和细胞损伤密切相关,本研究通过检测细胞培养液中LDH的活性,定量分析sAPPβ、Aβ和AICD片段对细胞的毒性作用。结果如图5所示,与空白对照组相比,阴性对照组培养液中LDH活力上升(P<0.05),表明载体质粒转染宿主细胞基因组后,宿主细胞的细胞膜受到一定程度的损伤。此外,与空白对照组和阴性对照组相比,转染sAPPβ基因的细胞培养液中LDH活力均没有显著差异,而转染Aβ和AICD基因的细胞培养液中LDH活力均显著提高(P<0.05)。以上结果表明,sAPPβ片段不会对细胞膜产生明显损伤,而Aβ和AICD片段则会造成细胞膜的显著损伤。
2.6 过表达 sAPPβ、Aβ和 AICD基因对 SHSY5Y细胞内ROS的影响
活性氧包括超氧自由基、过氧化氢及其下游产物过氧化物和羟化物,参与包括细胞增殖、发育、衰老和凋亡在内的许多生理和病理过程。本研究中各组细胞的胞内ROS水平测定结果如图6所示,与空白对照组相比,阴性对照组细胞内ROS的活性无显著差异,表明载体基因组整合到宿主细胞基因组后,胞内ROS的水平不受影响。但是,与空白对照组和阴性对照组细胞相比,Aβ和AICD基因转染组细胞内ROS的水平均显著上升(P<0.05),这说明过表达Aβ和AICD片段会导致细胞内ROS活性上升,引发细胞氧化应激反应。

图6 细胞中ROS相对活性(n=6)*:与空白对照组相比,差异显著(P<0.05);#:与阴性对照组相比,差异显著(P<0.05)。Fig.6 The relative activity of intracellular ROS(n=6)*:Compared with control group,the difference is significant(P<0.05);#:Compared with negative control group,the difference is significant(P<0.05).
2.7 过表达 sAPPβ、Aβ和 AICD基因对 SHSY5Y细胞线粒体膜电位的影响
线粒体膜电位下降是细胞凋亡早期的一个标志性事件。本研究中各组细胞的线粒体膜电位测定结果如图7所示,与空白对照组SH-SY5Y细胞相比,阴性对照组细胞的胞内线粒体膜电位相对水平无显著差异,表明载体质粒转染宿主细胞后,胞内线粒体膜电位水平不受影响。同时,与空白对照组和阴性对照组细胞相比,转染Aβ和AICD基因的细胞中线粒体膜电位相对水平均显著降低 (P<0.05),这表明过表达Aβ和AICD片段能够引发细胞线粒体膜电位的去极化作用。
3 讨论
本实验通过慢病毒介导基因转染的方法,成功构建了分别过表达sAPPβ、Aβ和AICD片段的SH-SY5Y细胞系。首先,G418筛选和EGFP荧光蛋白的检测均证明载体基因组已成功整合到宿主细胞基因组,并且整合后基因组中的新霉素抗性基因和荧光蛋白基因EGFP均已成功表达;其次,我们从mRNA水平和蛋白质水平证明各转染组细胞中目的基因成功地进行了转录和翻译。

图7 细胞线粒体膜电位相对水平(n=4)*:与空白对照组相比,差异显著(P<0.05);#:与阴性对照组相比,差异显著(P<0.05)。Fig.7 The relative level of mitochondrial membrane potential(n=4)*:Compared with control group,the difference is significant(P<0.05);#:Compared with negative control group,the difference is significant(P<0.05).
研究显示,sAPPβ片段不仅能够降低原代神经元细胞的黏附作用,促进细胞突触的增长[15],而且还能诱导人胚胎干细胞快速分化[16]。因此推测sAPPβ片段无细胞毒性。本实验结果显示过表达sAPPβ片段对SH-SY5Y细胞系的细胞膜、胞内ROS和线粒体膜电位均无显著影响,这也表明sAPPβ片段无细胞毒性。
已有研究报道,外源性Aβ1-42通过引发内质网应激诱导内皮细胞损伤和凋亡,并上调caspase-12和caspase-3等凋亡因子的水平[17]。线粒体膜电位下降与细胞凋亡的发生密切相关,线粒体损伤导致细胞色素c、caspase-3和bax等促凋亡因子的释放,进而激活caspase级联效应,最终引发细胞凋亡[18~19]。本实验通过慢病毒转染构建过表达Aβ片段的SH-SY5Y细胞模型,在此模型的基础上证明内源性Aβ片段可导致SH-SY5Y细胞膜损伤、线粒体去极化、胞内ROS升高和细胞活力降低。
脑啡肽酶(neprilysin,nep)可降解内源性Aβ,降低脑内Aβ水平,而AICD片段可与nep的启动子区域结合,最终降低nep的表达与活性[20~21]。前脑和海马神经元过表达AICD片段的转基因小鼠显示出多种AD病理特征,包括tau蛋白过度磷酸化、海马三突触回路功能异常、记忆功能损伤[22~23]。本实验结果表明,过表达AICD片段可在一定程度上引起SH-SY5Y细胞活力下降、细胞膜受损、胞内ROS水平升高和线粒体膜电位发生去极化。
