杨梅素片与二氢杨梅素片的制备及质量研究
2019-05-15刘冬生高蓉陈芳昭
刘冬生,高蓉,陈芳昭
(1.杭州中美华东制药有限公司,浙江 杭州 310011;2.南方医科大学,广东 广州 510515)
杨梅素(3,5,7-三羟基-2-(3,4,5-三羟基苯基)-4H-1-苯并呋喃-4-酮,Myricetin,MY)与二氢杨梅素[(2R,3R)-3,5,7-三羟基-2-(3,4,5-三羟基苯基)苯并二氢吡喃-4-酮,Dihydromyricetin,DMY]均属于黄酮类天然小分子化合物,结构式见图1。现代药理学研究表明两者均具有较高的药用价值具有广泛的药理活性,如抗肿瘤、抗氧化、抗炎、护肝等,具有潜在的药用价值[1-2]。并且,我们前期研究发现杨梅素和二氢杨梅素具有较好的抗流感病毒活性,在发挥抗病毒活性的同时,通过抗炎免疫作用减少机体的炎症反应。其作用机制明确,毒性较低,具有较大的开发和应用潜力。
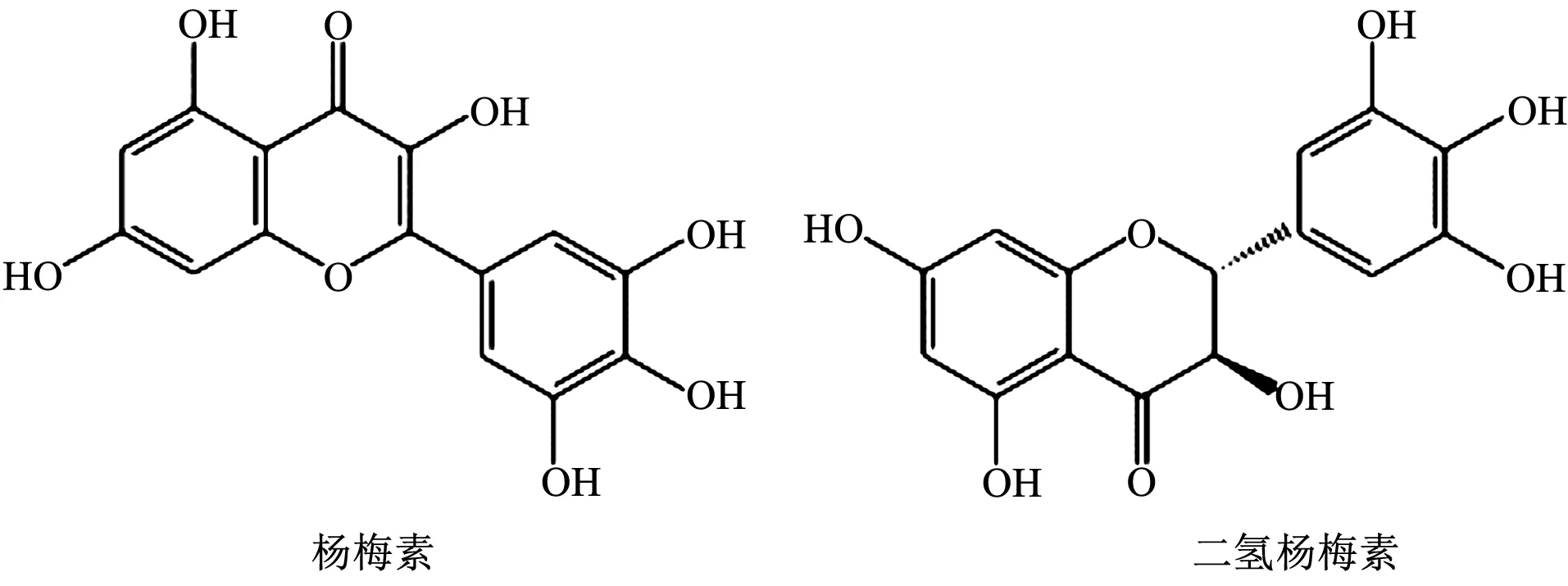
图1 杨梅素、二氢杨梅素结构式
杨梅素、二氢杨梅素可从多种植物中进行提取,来源广泛,且两者的提取和分离工艺日臻成熟。其中,杨梅素主要来源于杨梅果实中提取的黄酮类化合物,而二氢杨梅素在藤茶中的含量相对于其他科属的植物较高,可达到30%以上。因此,杨梅素与二氢杨梅素在药物的研究与应用中具有资源优势。欧洲一些国家已将杨梅素作为保健食品进行上市,美国食品药品监督管理局(FDA)也批准杨梅素应用于医药、保健食品和化妆品。欧美国家将杨梅素用作适合特殊人群消炎的添加剂,但国内还未有相关产品上市[3]。其广泛的药理活性、丰富的来源及对人体的安全性让它们拥有发展成为药品或保健食品的潜力。
杨梅素、二氢杨梅素的难溶性和易氧化性给它们的应用带来了很大的局限性,成了在未来的相关制剂开发中,亟须解决的瓶颈问题。目前,国内外研究者将许多新型制剂技术应用于杨梅素或二氢杨梅素,制备出来一系列新剂型,例如分散片[4]、脂质体[5]、纳米凝胶[6]、包合物[7]、微乳[8]等,以提高二者的生物利用度,有效发挥其药理作用。新剂型的应用为杨梅素、二氢杨梅素的临床应用提供了理论基础,是未来制剂发展的新动向,但是,这些还仅仅停留在实验室阶段,没有进行到工业化生产阶段。并且,我国新型制剂的使用率不足5%,远低于全球的平均水平,这使新剂型的应用在短期时间内,还无法得到广泛应用[9]。因此,经典剂型的应用仍然是我国新药发展的重要课题。经典剂型如片剂、胶囊剂是我国当今的主要应用剂型,对于杨梅素、二氢杨梅素来说,开发出能有效应用的经典剂型,是其从实验室迈向工业化生产的第一步。
片剂是指药物与辅料均匀混合后压制而成的片状制剂,是现代药物制剂中应用最为广泛的重要剂型之一,具有口服吸收方便、剂量准确、含量均匀、便于储存运输、受外界空气、光线、水分等因素的影响较少并可通过包衣保护等优点,容易应用于工业化大生产,并可因临床应用的需要制成分散片、缓释片、控释片等不同功能剂型。在此研究中,片剂作为首选研究剂型,有利于主药分别为杨梅素、二氢杨梅素的剂型应用及扩大化生产。
根据制备工艺的不同,片剂可分为直接压片法和制粒压片法,而制粒压片法又分为湿法制粒压片和干法制粒压片,其中湿法制粒是我国药企应用最为广泛的方法。直接压片法省去了制粒、干燥等步骤,简化工序,适用于对湿热不稳定的药物。与直接压片法相比,制粒压片法可改善物料的流动性、可压性,减少物料各成分的分层,使片剂含量均匀,并可避免细粉飞扬造成损失和交叉污染等问题。对于流动性较差的物料,还是需要制粒压片法来制备片剂。由于杨梅素、二氢杨梅素原料药本身流动性较差,不利于直接压片,并且杨梅素可在100 ℃以下[10]、二氢杨梅素可在220 ℃以下保持稳定[11],远高于湿法制粒中干燥步骤的温度(60 ℃),适用湿法制粒。故在本研究中,选用湿法制粒压片法改善其流动性,便于压片成型及控制含量。
在本研究中,我们旨在探索杨梅素片与二氢杨梅素片的处方工艺,并制备符合崩解时限要求的相关片剂,为两者的生产应用及后期生物利用度考察奠定基础。
1 材料与方法
1.1 材料
1.1.1 仪器 80目筛网(上海宝蓝实验仪器制造有限公司);20目筛网(上海宝蓝实验仪器制造有限公司);PL203电子天平(梅特勒-托多利仪器(上海)有限公司);YD-4片剂硬度测定仪(创天有限公司);FT-2000A脆碎度测定仪(天津市天大天发科技有限公司);DHG-9053A电热鼓风干燥箱(上海一恒科学仪器有限公司);MB35水分测定仪(美国奥豪斯公司Ohaus);ZPS8-旋转式压片机(中外合资上海天祥·健台制药机械有限公司);ZB-1E智能崩解仪(天津市天大天发科技有限公司);G6实验型多功能湿法混合制粒机(深圳市信宜特科技);JZ-7型粉体振实密度仪(成都精新粉体测试设备有限公司);粉末流动性测定仪(成都精新粉体测试设备有限公司);P100粉碎整粒机(深圳市信宜特科技);DPL-0.2多功能制粒包衣机(重庆精工制药机械有限责任公司);UV-2450型紫外-可见分光光度计(日本岛津公司)。
1.1.2 试药 杨梅素(武汉远城科技有限公司,批号:2018.07.25);二氢杨梅素(武汉远城科技有限公司,批号2018.07.16);微晶纤维素(德国JRS药用辅料公司);乳糖(德国美剂乐集团);羟丙纤维素(HPC,Aqualon Company);低取代羟丙纤维素(L-HPC,日本曹达株式会社);羧甲基淀粉钠(CMS-Na,湖州展望药业有限公司);交联羧甲基纤维素钠(CCMC-Na,FMC BioPolymer);硬脂酸镁(湖州展望药业有限公司);薄膜包衣预混剂(胃溶型,上海可乐康包衣技术有限公司);甲醇(色谱纯,Anaqua Chemicals Supply);水为纯化水。
1.2 方法
1.2.1 片剂制备工艺 采用湿法制粒法分别制备杨梅素片、二氢杨梅素片。工艺流程图见图2。在前期探索时用人工挤压法进行制粒,在处方确定之后采用湿法混合制粒机进行制粒,工艺分别如下:
人工法:主药与辅料分别过80目筛后混匀,加入适量纯化水制软材,过20目筛制粒,于电热鼓风干燥箱干燥至水分低于3%后过20目筛整粒,加入外加部分的崩解剂与润滑剂硬脂酸镁充分混匀,压片,并在压片过程中控制片重与片剂硬度(约10 kg)。
机器法:将用于制粒的原辅料倒入多功能湿法混合制粒机,先混合均匀,再加入适量纯化水,采用制粒模式进行切割制粒。制粒完成后用流化床对颗粒物进行干燥,至水分低于3%后,用整粒机进行整粒,再加入外加部分崩解剂与润滑剂硬脂酸镁,充分混匀后进行压片,并在压片过程中控制片重与片剂硬度(约10 kg)。
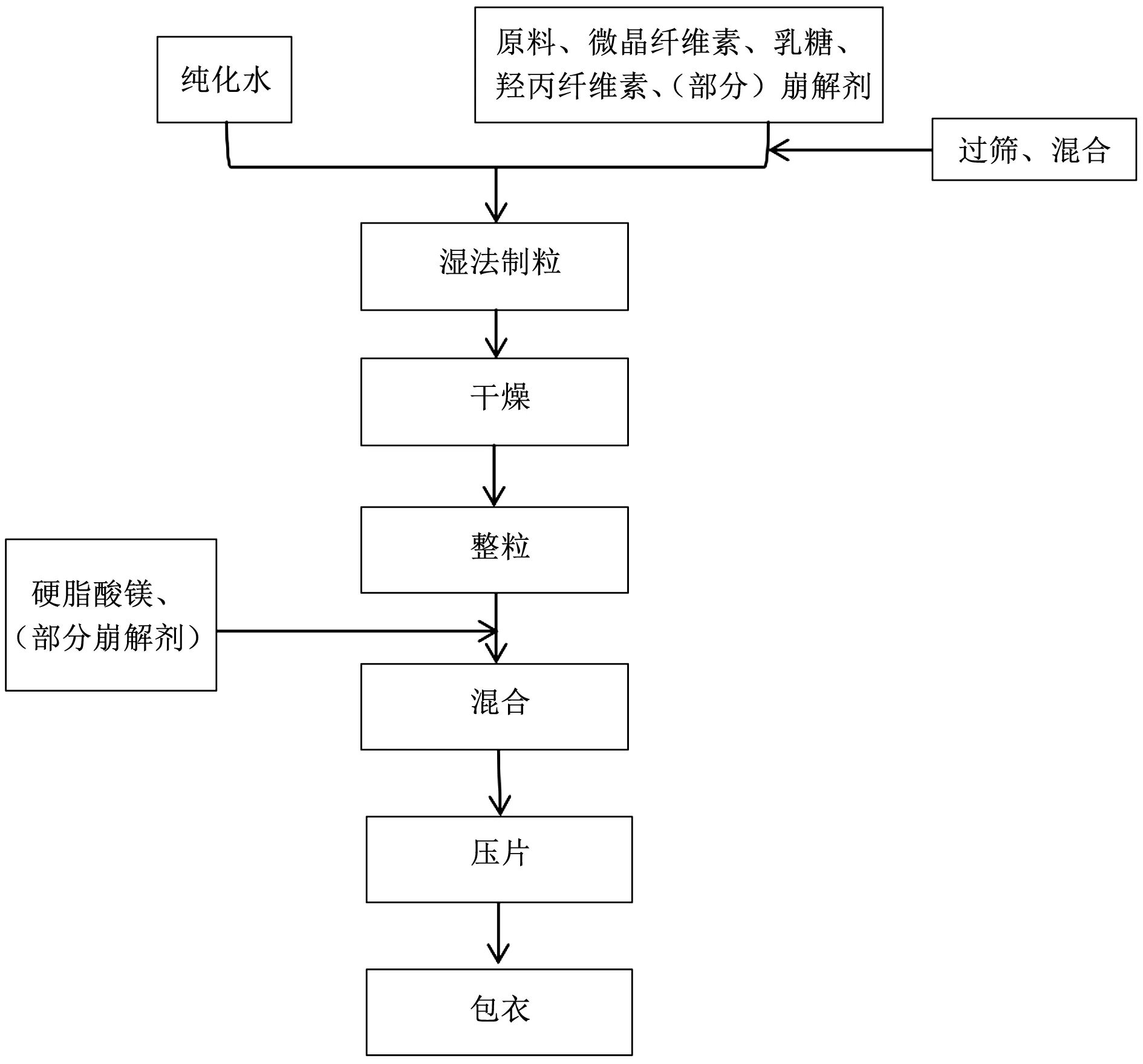
图2 工艺流程图
1.2.2 堆密度检测 在杨梅素、二氢杨梅素颗粒制备完成后,与外加部分崩解剂与润滑剂硬脂酸镁充分混匀,形成压片前粉末,对其进行振实密度检测。使用JZ-7型粉体振实密度仪,将适量药品粉末称重后,记录质量m,轻轻倒入密度仪量筒,记录其振前体积V1。启动密度仪振动1 000次后,记录振后体积V2,计算粉体振实最紧堆密度f、最松堆密度0与压缩度C=(f-0)/f×100%,并判断其流动性。
1.2.3 粉体流动性检测 休止角是粒子在粉体堆体积层的自由斜面上滑动时所受重力和粒子间摩擦力达到平衡而处于静止状态下测得,是检验粉体流动性的好坏的最简便的方法。休止角越小,摩擦力越小,流动性越好,一般认为θ≤40°时可以满足生产流动性的需要。将粉末注入流动性测定仪漏斗中,直至粉末完全流出,并且粉末顶端与漏斗底部接触,记录粉末椎体高度h及半径r,tanθ=h/r。
1.2.4 崩解时限检查 将纯净水注入智能崩解仪并预热至37 ℃,取6片片剂分别置于吊篮中,启动崩解仪,设定崩解时间为15 min,待崩解仪达到工作时间后,取出崩解框,观察片剂崩解情况。普通片剂的崩解标准为:15 min内全部崩解或成碎粒,并全部通过筛网。
1.2.5 片剂脆碎度检测 将所得片剂用吹风机吹去表面浮粉后,精密称取约6.5 g片剂,置脆碎度测定仪圆筒中,转动100次,转速(25±1)次/min。取出,同法除去粉末,精密称重,减失重量不得过1%,且不得检出断裂、龟裂及粉碎的片。
1.2.6 紫外-可见分光光度法测定含量(对照品比较法)
1.2.6.1 对照品溶液制备 取杨梅素和二氢杨梅素原料粉末,分别加甲醇制成对照品储备液。精密量取各储备液适量,置25 mL容量瓶中,加甲醇定容至刻度,摇匀,即得浓度为6.40 μg·mL-1的杨梅素对照品溶液,和浓度为6.40 μg·mL-1的二氢杨梅素对照品溶液。
1.2.6.2 供试品溶液制备 取20片药物研细,精密称取适量(约相当于1片重量),作为供试品(约含100 mg药物),置于50 mL容量瓶中,加入甲醇并定容至刻度,于37 ℃超声破碎溶解15 min,置于室温放凉后,摇匀。取2 mL至25 mL容量瓶,加甲醇定容至刻度,混匀。再取1 mL溶液至25 mL容量瓶,加甲醇定容至刻度,用0.22 μm微孔滤膜滤去不溶性辅料后,即得供试品溶液。
1.2.6.3 测定方法 对照品比较法。分别配制供试品溶液和对照品溶液,对照品溶液中所含被测成分的量应为供试品溶液中被测成分规定量的100%±10% ,所用溶剂也应完全一致,在规定的波长处测定供试品溶液和对照品溶液的吸光度后,按下式计算供试品中被测溶液的浓度:
Cx=(Ax/Ar)×Cr
其中,Cx:供试品溶液的浓度;Ax:供试品溶液的吸光度;Cr:对照品溶液的浓度;Ar:对照品溶液的吸光度。
2 结果
2.1 杨梅素片、二氢杨梅素片的处方探索
2.1.1 原始处方(人工法) 处方(崩解剂内加;片重:250 mg)见表1。成片质量考察见表2。

表1 原始处方

表2 原始处方成片质量考察
结果分析:① 250 mg片重使成片太厚,建议片重调整至200 mg。② 杨梅素片在15 min内全部没有崩解,而二氢杨梅素片崩解符合《中国药典》要求,两者处方相同,崩解时限差异考虑是主药性质导致。
2.1.2 改进处方(人工法) 在前面所述实验中,杨梅素片完全不崩解,与二氢杨梅素片崩解合格相比较,应是主药成分导致片剂不崩解,故考虑以下两种方式改善杨梅素片崩解度,并调整片重为200 mg:①不用黏合剂,利用主药本身黏性发挥黏合作用;②不用黏合剂且降低主药杨梅素含量。结果如下:① 不用黏合剂组处方:见表3。② 不用黏合剂且降低杨梅素主药含量组处方:见表4。

表3 改进处方(不用黏合剂)

表4 改进处方(不用黏合剂且降低主药含量)
结果:因硬脂酸镁减慢崩解作用,故崩解剂L-HPC采用外加法加入。两个处方所得片剂,在15 min内均不崩解,故考虑L-HPC不适合作为杨梅素片的崩解剂,应该更换。
2.1.3 更换崩解剂(人工法) 由于L-HPC无法使杨梅素片在规定时间内崩解完全,故考虑更换崩解剂。在常用的崩解剂中,羧甲基淀粉钠(CMS-Na)是一种白色无定型粉末,吸水膨胀作用非常显著,吸水后可膨胀至原体积的300倍;交联羧甲基纤维素钠(CCMC-Na)不溶于水,通过毛细管作用与吸水膨胀作用产生崩解效应,与水接触后体积迅速膨胀至原体积的4~8倍[12]。考虑采用CMS-Na或CCMC-Na作为崩解剂(崩解剂内外加法(3∶1)分别考察杨梅素片崩解效果。处方(200 mg/片):见表5。

表5 用CMS-Na或CCMC-Na代替L-HPC作为崩解剂的处方
对制备所得杨梅素片,进行崩解作用探索,结果如下:①崩解剂为CMS-Na:在10 min内,杨梅素片全部崩解;②崩解剂为CCMC-Na:10 min时,6片中剩下1片剩少量黏住挡板,15 min时仍如此,但质地松软。
综上,选择采用CMS-Na作为崩解剂制备杨梅素片,并考察用此处方制备的二氢杨梅素片的崩解效果。
2.1.4 杨梅素片与二氢杨梅素片处方确定与崩解时限检查(机器法) 由于“2.1.3”项下处方可使杨梅素片崩解时限达到药典规定要求,故采用该处方,用机器法制备杨梅素片和二氢杨梅素片,考察崩解剂CMS-Na的不同加入方法对片剂崩解的影响,结果见表6。

表6 崩解剂CMS-Na加入方法对片剂崩解的影响
崩解时限比较:在外加法与内外加法中,片剂的崩解度均较好,符合《中国药典》规定要求。
成片外观比较:外加法光洁程度与内加法、内外加法相比,有些许花片,原因应为外加法时,制粒后加入粉末比例较多,混合不够均匀,导致表面斑驳或者表面不光洁。
综上,内外加法既保证片剂崩解度,又能让成片光洁,故在后续实验采用内外加法,崩解剂以3∶1分别在制粒前∶后加入的方法制备杨梅素片与二氢杨梅素片,并对所得片剂进行包衣,以保护片剂免受空气氧化(包衣液:欧巴代02B38190-CN 黄色;包衣增重:3% )。两者的普通片及包衣片外观(见图3)。

普通片包衣片杨梅素片二氢杨梅素片图3 杨梅素片、二氢杨梅素片外观
2.2 粉体堆密度检测 ①杨梅素颗粒:m=23.90 g,V1=50 mL,V2=42 mL;最紧堆密度ρf=m/V2=23.90/42=0.57,最松堆密度ρ0= m/V1=23.90/50=0.478;压缩度:C=(ρf-ρ0)/ ρf×100%=16%;②二氢杨梅素颗粒:m=22.65 g, V1=50 mL,V2=38 mL
最紧堆密度ρf= m/V2=22.65/38=0.596,最松堆密度ρ0= m/V1=22.65/50=0.453;压缩度:C=(ρf-ρ0)/ ρf×100%=23.99%
一般认为,压缩度在20%以下流动性较好,40%~50%时流动性较差,所以,两种颗粒流动性均较好。
2.3 粉体流动性检测 通过测定粉末椎体的高度h与半径r,计算其休止角:
杨梅素:r=3,h=2,tan=h/r=0.67,=33.82°
二氢杨梅素:r=3,h=2.1,tan=h/r=0.7,=34.99°
<40°时流动性符合生产要求,故杨梅素颗粒与二氢杨梅素颗粒粉末均具有良好的流动性,符合进一步的制剂研究要求。
2.4 压片并包衣后崩解时限检查 结果见表7。

表7 杨梅素片、二氢杨梅素片包衣前后崩解时限检查
在对杨梅素片、二氢杨梅素片进行包衣后,崩解时限仍在15 min内,说明两者的片剂均具有良好的崩解度,符合进一步研究的要求。
2.5 脆碎度检测 杨梅素片:检测前重量6.431 6 g,检测后重量6.428 2 g,减重0.05%。二氢杨梅素片:检测前重量6.506 1 g, 检测后重量6.461 6 g,减重0.67%,均符合减重不超过1%要求。
2.6 对照品比较法测定含量
2.6.1 检测波长的选择 用紫外-可见分光光度计对杨梅素、二氢杨梅素对照品溶液进行扫描(200~800 nm),得紫外-可见吸收光谱图如下。杨梅素最大吸收波长209.20 nm,二氢杨梅素最大吸收波长为208 nm。两者最大波长相近,选取209.20 nm作为检测波长分别对两者的供试品进行检测。杨梅素、二氢杨梅素紫外光谱分别见图4~5。
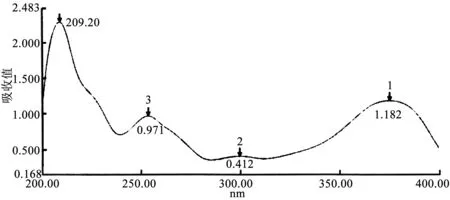
图4 杨梅素紫外光谱图

图5 二氢杨梅素紫外光谱图
2.6.2 精密度试验 取杨梅素供试品溶液和二氢杨梅素供试品溶液各1份,分别于209.2 nm波长处测定吸光度,连续6次。计算RSD分别为杨梅素0.58%,二氢杨梅素0.67%。表明仪器精密度良好。
2.6.3 重复性试验 取杨梅素供试品溶液和二氢杨梅素供试品溶液各6份,分别于209.2 nm波长处测定吸光度,计算RSD分别为杨梅素0.71%,二氢杨梅素0.51%。表明本方法重复性良好。
2.6.4 稳定性试验 取杨梅素供试品溶液和二氢杨梅素供试品溶液各1份,分别于0、4、8、12、16、24 h,在209.2 nm波长处测定吸光度,计算RSD分别为杨梅素0.93%,二氢杨梅素0.87%。表明供试品溶液在24 h内稳定。
2.6.5 加样回收率试验 精密称取已知含量的杨梅素片粉末(含杨梅素50%)和二氢杨梅素片粉末(含二氢杨梅素50%)各6份,各100 mg。分别精密加入杨梅素对照品储备液(含杨梅素50 mg)和二氢杨梅素对照品储备液(含二氢杨梅素50 mg)。按本试验供试品溶液制备及测定方法进行测定。结果平均回收率为杨梅素98.6%,二氢杨梅素101.1%。表明本方法准确度良好。
2.6.6 样品含量的测定 ①杨梅素(按200 mg/片):结果见表8。计算每片含量得:C1=93.75 mg,C2=93.17 mg,C3=95.40 mg,平均含量 C=94.09 mg,RSD=1%。
②二氢杨梅素(按200 mg/片):结果见表9。计算每片含量得:C1=114.35 mg,C2=109.63 mg,C3=104.08 mg,平均含量 C=109.35 mg,RSD=5%。
杨梅素片、二氢杨梅素片含量均在设定含量100 mg的100%±10%以内,相对标准偏差RSD均符合要求。

表8 对照品及供试品中杨梅素的吸光度
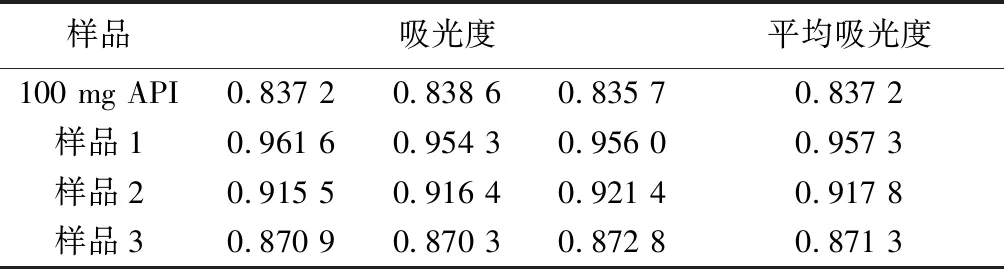
表9 对照品及供试品中二氢杨梅素的吸光度
3 讨论
在处方中辅料选择上,选用微晶纤维素与乳糖共同作为填充剂,其中微晶纤维素具有良好的可压性,压出的片剂紧密却具有良好的崩解性,在处方含量大于20%时崩解性较好,而乳糖水溶性好,使压出的片子表面光滑、美观,有利于提高药物的溶出度。二者相结合,可使所得片剂光洁美观,具有良好的崩解性能和溶出度。黏合剂选择羟丙纤维素(HPC)。在最初的处方中,选用低取代羟丙纤维素(L-HPC)作为崩解剂,但所得片剂崩解性能较差,杨梅素片无法在规定时间内崩解,换用吸水膨胀作用显著的羧甲基淀粉钠(CMS-Na)与兼备毛细管作用与吸水膨胀作用的交联羧甲基纤维素钠(CCMC-Na),均取得较好的崩解效果,最后,选择崩解性能最好的CMS-Na作为最终处方的崩解剂。在制得药物颗粒之后,添加1%的硬脂酸镁作为润滑剂,可使颗粒的可压性与流动性更好,所得片剂光洁美观。
上述对杨梅素片和二氢杨梅素片进行了处方探究,摸索出能够满足崩解时限要求,并且崩解度良好的片剂处方。在该处方制备所得的粉体颗粒和片剂中,分别进行了粉体流动性相关检查和片剂基本质量要求的检测,结果发现,该处方所得颗粒的粉体流动性较好,具备压成片剂的性能。在压成片剂之后,片剂的脆碎度、硬度均符合要求。且其单剂标示量大于25 mg,不用进行含量均匀度检查。使用紫外-可见分光光度法测定其含量,发现两者含量均在标示量的100%±10%以内,符合要求。
但在此研究中,仍存在不足之处:①含量测定方法较粗略,没有采用精密度更高的HPLC进行含量测定;②仅进行了崩解时限检查,没有对所得片剂进行溶出度检测,不能准确预测其生物利用度;③含量测定结果虽在允许范围内,但偏差仍较大,可能原因为实验过程大多采用人工控制条件和影响因素,导致与预测含量有所差异。在往后的研究中,需要进一步规范实验流程,采用机器生产进行更严密的条件控制,解决两者溶解度不佳、容易氧化等缺点带来的问题,并且进行溶出度检查,针对溶出度结果等实验数据继续优化处方工艺,以达到良好的生物利用度及满足制剂生产的要求。
总的来说,此研究为杨梅素、二氢杨梅素制备成片剂提供了思路,为两者制备成真正可以应用于临床研究的制剂进行了前期探索。
