超微血管成像技术对乳腺纤维腺瘤及乳腺叶状肿瘤的鉴别诊断价值
2019-05-15李娅荣通讯作者
李娅荣,彭 梅(通讯作者)
(安徽医科大学第二附属医院超声科 安徽 合肥 230601)
乳腺纤维瘤则是较为常见的良性乳腺肿瘤,在女性中具有10%的发病率[1],而乳腺叶状肿瘤是一种临床上较少见的纤维上皮性肿瘤,占乳腺肿瘤的0.3%~0.9%[2]。两者临床表现、影像学特征、组织结构与分子表达很相似,易误诊,可同时存在于患者体内,并可相互转化[3,4]。乳腺纤维腺瘤一般为单发或多发,可对肿物做单纯切除手术或保守性随访治疗。乳腺叶状肿瘤则多发病于乳腺单侧,有分化、复发及转移的可能性,因此要扩大性切除[5,6]。因此,术前对两者进行临床鉴别显得非常重要,相对于MRI与病理活检,超声影像是较为简便、无辐射、无创的首选诊断方法。肿瘤的血流影响特征表现常作为其诊断的重要依据,特别是恶性肿瘤的血流情况及血管构建有别于良性肿瘤。在微血管及微血流的观察效果方面,彩色多普勒血流超声显像(color doppler flow imaging,CDFI)要弱于超声造影与增强MRI[7,8]。于是,如何快速、简便、无创、可靠、细致地观察微血管,成为临床工作者鉴别乳腺纤维腺瘤与乳腺叶状肿瘤所面临的重要问题之一。
超微血管成像(superb microvascular imaging,SMI),就是一种较为前沿的可以检测微血管构建及微血流的超声影像技术,采用高帧频、高分辨率的自适应多普勒算法,可较为清楚地观察微血管构建及血流灌注信号[9]。SMI能够在病灶及其周围的血流复杂的情况下采用频谱信号的差异化滤波技术,比CDFI更容易显示出微血管的低速血流图像。已有研究表明,SMI比CDFI更容易检测出微血管的构建及其微血流,对良恶性肿瘤的分级及评估具有重要的意义。
本研究将分别采用SMI与CDFI两种技术对乳腺纤维瘤与乳腺叶状肿瘤进行检测,结合Adler血流分级及BIRADS分级评估,探讨SMI在区分乳腺纤维腺瘤与乳腺叶状肿瘤方面的诊断价值。
1 资料与方法
1.1 一般资料
选取于2015年2月—2018年10月在我院就诊且经病理证实的96位乳腺纤维腺瘤患者与96位乳腺叶状肿瘤患者的病灶部位的超声影像诊断资料作为研究对象,进行回顾性分析。乳腺纤维腺瘤患者年龄为18~55岁,平均年龄为(28.76±8.62),乳腺叶状肿瘤患者年龄为26~63岁,平均年龄为(46.13±8.45)岁。
1.2 仪器与方法
采用东芝Aplio500彩色多普勒超声,探头频率为4~11MHz。让患者处于仰卧位,充分暴露其腋窝与乳房部位,对乳腺部位进行常规检查,运用不同切面完成操作:(1)肿物声像特征:采用超声观察肿物大小、形态、边界、成角、内部回声、后方回声、毛刺与纵横比。(2)采用CDFI与SMI两种方法分别观察肿物内部动静脉血管内径、走形、位置、中心血流、周边血流、穿支血流等参数,并完成血流信号的分级。对血管最丰富的断面的脉冲信号进行取样,并调整血流与声束的入射夹角,以小于60°为标准,获取血流频谱。
1.3 血流评估及肿瘤评级方法
对病灶血管内的血流进行Adler定量分级:0级,病灶内部与周边无血流信号;1级,含有1或2条少量点状或细棒状血流;2级,存在中等流量血流,存在3或4个点状血流或短棒状血流信号(有1条长度近似或大于肿瘤半径的显要血管);3级,病灶内部血流丰富,具有5个以上的点状血流或含有2条以上的重要血管。按照周边血流、中心血流与穿支血流对病灶的血流情况进行位置划分[10]。再按照BI-RADS分类对肿瘤的等级进行划分[11]。
1.4 统计学处理
分别对CDFI与SMI模式下的乳腺纤维腺瘤和乳腺叶状肿瘤的彩色血流信号进行Adler分级评价,按照乳腺纤维腺瘤和乳腺叶状肿瘤分组进行卡方检验。然后再按照CDFI与SMI模式分组进行加权Kappa一致性检验。经SMI对乳腺纤维腺瘤与乳腺叶状肿瘤的周边血流、中心血流、穿支血流情况进行卡方检验。结合BI-RADS分级标准对乳腺叶状肿瘤在CDFI与SMI模式下的分级结果进行综合评价,以病理检验结果为标准,对比两种检查方法的诊断能效。
采用SPASS25.0软件进行统计学处理与分析,以P<0.05作为显著性差异的标准,并以Kappa≥0.75表示两者一致性较好;0.75>Kappa≥0.4表示两者一致性一般;Kappa<0.4表示两者一致性较差,以此作为一致性评判标准。
2 结果
2.1 病理结果
通过病理发现乳腺叶状肿瘤组中良性肿瘤的比例为54.17%(52/96),交界性肿瘤的比例为23.96%(23/96),恶性肿瘤的为21.87%(21/96)。
2.2 乳腺纤维腺瘤与乳腺叶状肿瘤的Adler血流分级比较
对乳腺纤维腺瘤与乳腺叶状肿瘤进行Adler血流分级综合评价,CDFI模式下的卡方检验结果为χ2=8.369,P=0.039,P<0.05,SMI模式下的卡方检验结果为χ2=8.694,P=0.033,P<0.05,两组都具有统计学意义上的显著差异,统计数据见表1。

表1 在CDFI、SMI模式下乳腺纤维腺瘤与乳腺叶状肿瘤的彩色血流信号的Adler血流分级比较
2.3 CDFI与SMI检查方法的Adler血流分级比较
在乳腺纤维腺瘤组的Adler血流分级综合评价中,SMI的分级结果大于CDFI,其加权k=0.636,95%CI为0.523~0.749,两种方法对血流丰度的检查一致性一般,存在明显差异性,SMI比CDFI更加容易检测出更多的微血流,具体见图1。对于乳腺叶状肿瘤组的Adler血流分级综合评价中,SMI的分级结果大于CDFI,其加权k=0.584,95%CI为0.485~0.683,SMI与CDFI诊断结果一致性一般,存在明显差异性,具体见图2。可见,SMI对两种肿瘤的Adler血流分级综合评价均大于CDFI,在被CDFI划分低级别的肿瘤中,能够被SMI检测到较高级别的血流信号。统计数据见表2。
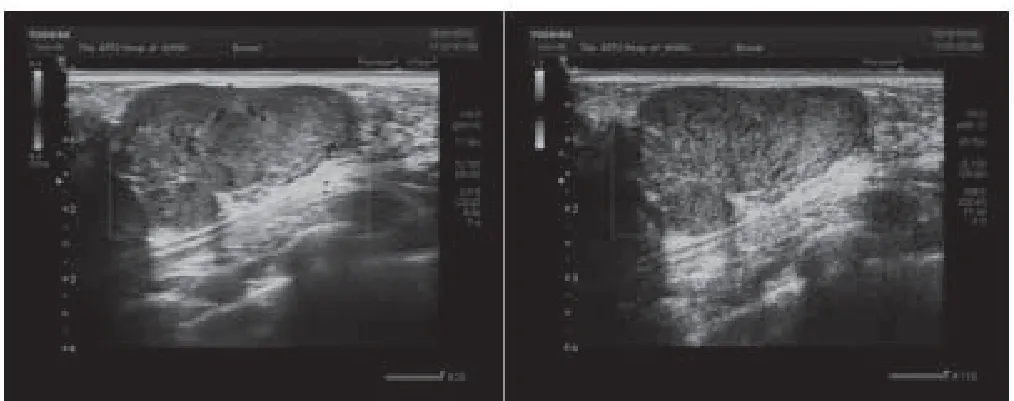
图1 23岁女性患者,乳腺纤维腺瘤,左图为CDFI显示肿瘤的血流情况,Adler分级为Ⅰ级;右图为SMI显示肿瘤的血流情况,Adler分级Ⅱ级。

图2 50岁女性患者,乳腺叶状肿瘤,左图为CDFI显示肿瘤的血流情况,Adler分级为Ⅱ级;右图为SMI显示肿瘤的血流情况,Adler分级为Ⅲ级。

表2 两种模式的彩色血流信号的Adler血流分级比较
2.4 乳腺纤维肿瘤与乳腺叶状肿瘤的周边血流、中心血流、穿支血流情况比较
乳腺纤维腺瘤与乳腺叶状肿瘤的周边血流的卡方检验结果为χ2=2.624,P=0.141,P>0.05,无统计学意义上的差异。中心血流或穿支血流的卡方检验结果为P<0.05,均具有统计学意义上的差异,统计数据见表3。

表3 SMI模式下乳腺纤维腺瘤与乳腺叶状肿瘤的周边血流、中心血流与穿支血流显示情况
2.5 乳腺叶状肿瘤的CDFI与SMI检查方法的BI-RADS分级比较
对于乳腺叶状肿瘤的BI-RADS分级综合评价,CDFI与SMI的结果的一致性一般,其加权k=0.635;95%CI为0.540~0.731,统计数据见表4。

表4 乳腺叶状肿瘤的CDFI与SMI模式的BI-RADS分级比较
3 讨论
乳腺纤维腺瘤是一种常见的良性肿瘤,一般由纤维腺组织与腺上皮组成[12],通常与患者体内激素水平、卵巢功能旺盛有关、精神压力过大等因素有关[13]。本研究可以发现,乳腺纤维腺瘤组织呈现圆形或椭圆形,大多数薄膜完整且光滑,内部呈现低回声,通常伴有钙化光团,并且大多数能够检测出周边血流信号,随着肿物体积的增大,血管内皮细胞相连紧密,血液回流自然,存在淋巴网,通过SMI比CDFI可以更加清楚地观测到内部更多的血流信号,也能够发现CDFI发现不了的少数穿支血流。
乳腺叶状肿瘤属于乳腺纤维上皮源性肿瘤,由纤维上皮细胞与间质细胞组成,呈双向分化倾向,多数为良性,少数为恶性、交界性,其中良性乳腺叶状肿瘤占总乳腺叶状肿瘤的60%~75%,部分复发的概率为20%[14],恶性乳腺叶状肿瘤占总乳腺叶状肿瘤的25%[15],部分复发的概率为23%~30%,转移概率约9%[16]。大多乳腺叶状肿瘤表现为乳房胀痛、肿物增大等病状,对患者的生活质量与健康安全构成了严重威胁。本研究可以发现,良性乳腺叶状肿瘤形态呈分叶状,内部裂隙状无回声,间质丰富且间质细胞无异型性,血流较丰富。随着肿瘤恶性程度的增加,分泌血管生长因子促使新生血管的生成,乳腺肿瘤逐渐具有一般恶性肿瘤浸润性生长的特征,且血管粗细不均。常以观测新生血管的特征及血流丰富程度作为鉴别乳腺肿瘤是良性还是恶性的一项超声影像标准。
由于乳腺叶状肿瘤也属于乳腺纤维上皮性肿瘤,与乳腺纤维腺瘤在临床检查表现上较为相似,很容易造成误诊。新生血管在乳腺肿瘤的生长与转移过程中起着重要的滋养作用,其血流特点是判别两者的重要依据。乳腺纤维腺瘤与乳腺叶状肿瘤之间的CDFI的Adler血液分级存在差异,存在丰富血流信号的肿瘤恶性的程度更大。然而,对于流速V<1cm/s的低速血流CDFI无法显示,而SMI可以观测到流速低至0.8cm/s的血流,其血流分级要高于CDFI[17],本研究也证实了这一点。
SMI是一种超声影像新技术,其原理是通过抑制杂波干扰,降低噪音,运用高频对微血管及低速血流进行高灵敏度、四维、高分辨率实时动态成像[18]。其主要原理是叠加血流信号图像,去伪存真,保留低速微血流,比CDFI更容易显示微血管形态、粗细程度及低速血流[9]。
通过本研究可以表明:(1)SMI或CDFI在乳腺纤维瘤与乳腺叶状肿瘤的血流信号观测结果上存在较为明显的差异性,在一定程度上对乳腺纤维瘤与乳腺叶状肿瘤做出区分。(2)SMI与CDFI在乳腺纤维腺瘤或乳腺叶状肿瘤的Adler血流分级能力上存在一定差异,SMI的Adler血流分级结果均大于CDFI。CDFI缺乏对微小血管的检出能力,而SMI可以清楚地显示出一些被CDFI未检测到的高级别血流信号,因此SMI可以更好地检测出微血管与微血流。(3)SMI对乳腺纤维瘤与乳腺叶状肿瘤的周边血流、中心血流、穿支血流具有较好的检出率,能够在一定程度上区分两种肿瘤的中心血流或穿支血流,而对于其周边血流的区别不明显。(4)结合BI-RADS分级,SMI对乳腺叶状肿瘤的诊断级别划分明显高于CDFI。在肿瘤的BI-RADS分级中,常以4a作为良性随访与疑似恶性(需做进一步诊疗)的分界点,SMI对乳腺叶状肿瘤的级别划分在≥4a范围内的比例(61/96,63.54%)大于病理交界性与恶性的总比例(44/96,45.83%),而CDFI为对乳腺叶状肿瘤的级别划分在≥4a范围内的比例(43/96,44.79%)略小于病理病理交界性与恶性的总比例(44/96,45.83%)。显然,SMI的BI-RADS分级比CDFI提高了需要做进一步诊疗的概率,降低了交界性或恶性肿瘤漏筛的概率,而因漏筛造成的假阴是诊断尽量避免的。
本研究尚存某些不足,需要做进一步探讨:(1)本研究样本有限,可扩大样本以进一步量化研究乳腺纤维瘤与乳腺叶状肿瘤在SMI应用领域的相关性,并结合BIRADS确定两者之间的诊断临界值。(2)需要对恶性乳腺叶状肿瘤的血管内皮生长因子与SMI之间的关联性作进一步的定量研究。(3)减少临床检验医师的主观偏差,以降低BI-RADS综合评价的主观定性诊断偏差。(4)按照良性、交界性、恶性分类对乳腺叶状肿瘤的SMI检查做进一步的定量分析。
综上所述,SMI比CDFI更加容易观测到乳腺纤维瘤及乳腺叶状肿瘤的微血管及微血流,不仅可以较好地区分两种肿瘤,而且提高了交界性与恶性乳腺叶状肿瘤诊断率,对于乳腺纤维腺瘤及乳腺叶状肿瘤的早期发现与诊治具有重要的临床意义。
