新型川芎嗪-香豆酸衍生物对拟脑缺血模型的形态保护作用
2019-05-15张欣钰郭文博吴高荣薛南南李国梁王鹏龙雷海民
张欣钰,郭文博,王 辉,吴高荣,薛南南,陈 萌,房 康,李国梁,王鹏龙,雷海民
(北京中医药大学中药学院,北京 100102)
脑缺血是由于大脑供血供氧不足所致的脑部缺血性坏死类疾病[1-3]。川芎-丹参作为临床治疗缺血性脑损伤的常用配伍单元,疗效确切[4-6]。本课题组前期基于“中药配伍-化药拼合”原理[7],以川芎-丹参药对功效成分为拼合前体,设计、合成了系列结构新颖的川芎嗪-酚酸类衍生物,均显示一定的神经保护活性,其中先导化合物T-CA (3,5,6-trimethylpyrazin-2-yl)methyl(E)-3-(4-((3,5,6-trimethylpyrazin-2-l)methoxy)phenyl)acrylate)对CoCl2诱导损伤的PC12细胞模型具有良好的保护作用(EC50=3.68 μmol·L-1,显著优于川芎嗪EC50=64.46 μmol·L-1),并可有效抑制细胞凋亡[8-15]。本研究通过Giemsa染色、DAPI荧光染色、AO及AO/EB染色等方法[16]进一步观察并确认T-CA对PC12细胞损伤模型的神经细胞形态改善作用。
1 仪器与材料
1.1仪器 SPECTRO star nano酶标仪(德国BMG公司);EC LIPSE Ti荧光倒置显微镜(日本Nikon公司);二氧化碳培养箱(美国Thermo Fisher公司)。
1.2试药 化合物T-CA(本课题组前期合成),溶解于二甲基亚砜(DMSO);RPMI-1640培养基、质量浓度为2.5 g·L-1的胰蛋白酶-EDTA溶液、青链霉素双抗溶液、磷酸盐缓冲液(PBS)(北京拜尔迪生物科技有限公司);胎牛血清、马血清、神经生长因子(NGF)(美国Thermo Fisher公司);无水氯化钴、二甲基亚砜、Giemsa染料、DAPI染料、AO试剂盒、AO/EB试剂盒、HE染料(北京百诺威生物科技有限公司)。
1.3动物 健康SD雄性大鼠(体质量为280~300 g)(北京维通利华实验动物技术有限公司)。
1.4细胞株 PC12细胞,购于北京协和细胞资源中心,使用含有体积分数为5%的胎牛血清及体积分数为10%马血清的RPMI-1640培养基置于37 ℃、体积分数为5%的二氧化碳培养箱中培养。
2 实验方法
2.1细胞培养及处理 将细胞分为4组:分化组、未分化组、损伤组和给药组。取PC12细胞用RPMI-1640培养基(体积分数为1%双抗+体积分数为5%胎牛血清+体积分数为10%马血清),培养于37 ℃、体积分数为5%的CO2的培养箱中。当细胞生长至对数期(状态良好)时,应用无血清的RPMI-1640培养基饥饿12 h,收集细胞。分化组、损伤组及给药组用RPMI-1640培养基(体积分数为1%双抗+体积分数为10%胎牛血清)制得混悬细胞液,置于多聚赖氨酸包被的12孔板内(每孔1 200 μL),加入NGF诱导分化。未分化组使用含马血清的培养基,且不加入NGF以抑制其分化。4组均培养48 h后,给药组加入T-CA (60 μmol·L-1)预保护,其余3组加入等体积的培养液培养36 h,损伤组及给药组加入CoCl2(300 μmol·L-1)损伤PC12细胞。造模12 h后,进行染色实验。
2.2Giemsa染色观察细胞形态变化 吸去12孔板中的上层细胞液,用PBS缓冲液清洗2~3次,加入冷乙醇固定细胞10 min。待细胞固定完全后,吸去多余固定液,使用PBS缓冲液清洗2~3次并加入适量Giemsa染液,染色5~10 min。吸去Giemsa染液,用PBS缓冲液清洗2~3次,置于100倍荧光倒置显微镜下观察。
2.3DAPI染色观察细胞形态变化 吸去上层细胞液,用PBS缓冲液清洗,加入低温质量浓度为40 g·L-1的多聚甲醛溶液固定细胞10 min。待细胞固定完全后,吸去多余固定液,使用PBS缓冲液清洗2~3次并加入适量DAPI染液,避光染色5~10 min。吸去DAPI染液,用PBS缓冲液清洗2~3次,置于100倍荧光倒置显微镜下观察,激发光为蓝光。
2.4AO染色观察细胞形态变化 吸去上层细胞液,用PBS缓冲液冲洗,加入PBS缓冲液1 mL后立刻加入质量浓度为100 μg·mL-1的AO染液,避光染色1 min。置于100倍荧光倒置显微镜下观察,激发光为绿光。
2.5AO/EB染色观察细胞形态变化 吸去上层细胞液,用PBS缓冲液清洗,加入PBS缓冲液1 mL,依次加入质量浓度为100 μg·mL-1的AO染液及EB染液。避光染色1 min,置于100倍荧光倒置显微镜下观察,激发光为蓝光。
2.6制备MCAO模型 参考文献方法[17-18]:用体积分数为10%的水合氯醛腹腔注射麻醉健康SD大鼠,用体积分数为75%的酒精消毒后于颈部正中切口分离颈部动脉,结扎颈总动脉及颈外动脉。于颈内处用动脉夹夹闭,颈外动脉近心端及远心端结扎。作一切口于颈总动脉分叉处并松开动脉夹,于切口处插入光滑尼龙线。插入深度为18±0.5 mm时停止,留1 cm固定。假手术组仅暴露及分离,不进行结扎。参考Zea Longa评分法,于术后3 d进行评分:0分为无明显神经症状表现;1分为左侧前爪不能完全伸展;2分为大鼠出现向左侧旋转症状;3分为大鼠行走时出现向左侧倾倒现象;4分为癫痫及昏迷不能自行行走。评分1~3分的大鼠入选实验。
2.7分组与给药 实验包括假手术组、模型组及给药组。将评分为1~3分的大鼠随机分组至模型组及给药组,分组结果为假手术组3只,模型组5只,给药组4只。给药组灌胃给药T-CA (10 mL·kg-1) 10 d,其余2组给予等量羧甲基纤维素钠溶液。
2.8取材 用体积分数为10%的水合氯醛麻醉后心脏取血,生理盐水灌注,肝脏逐渐呈白色后改用质量浓度为40 g·L-1的多聚甲醛溶液灌注。大鼠僵硬后取大鼠脑组织并存于质量浓度为40 g·L-1的多聚甲醛溶液中。脑组织海马区切片后进行HE染色。
3 结果
3.1Giemsa染色观察T-CA对细胞形态的影响 镜下观察可见,未分化组PC12细胞状态正常,细胞核形态完整、着色均匀、细胞有聚团现象,见图1。NGF诱导分化组细胞边缘出现神经细胞突触,突触连接处有类似神经节的节点。损伤组细胞神经突触出现变短或消失的情况,细胞核染色不均匀且细胞数量显著减少。给药组进行预保护后,细胞核染色较均匀,神经突触部分保留较好且细胞数量无明显减少,见图1。
3.2DAPI染色观察T-CA对细胞形态的影响 镜下观察可见,未分化组与分化组细胞核呈均匀蓝色状态。损伤组细胞数量显著减少,核着色高度凝聚。给药组进行预保护后,细胞核染色较为均匀且细胞数量无明显减少,见图1。
3.3AO染色观察T-CA对细胞形态的影响 镜下观察可见,丫啶橙染色绿色光激发后未分化组与分化组细胞核显均匀黄绿色荧光。损伤组因细胞凋亡,黄绿色荧光聚集于核膜的内侧,细胞膜泡状膨出。给药组进行预保护后,细胞膜泡状膨出情况明显改善,见图1。
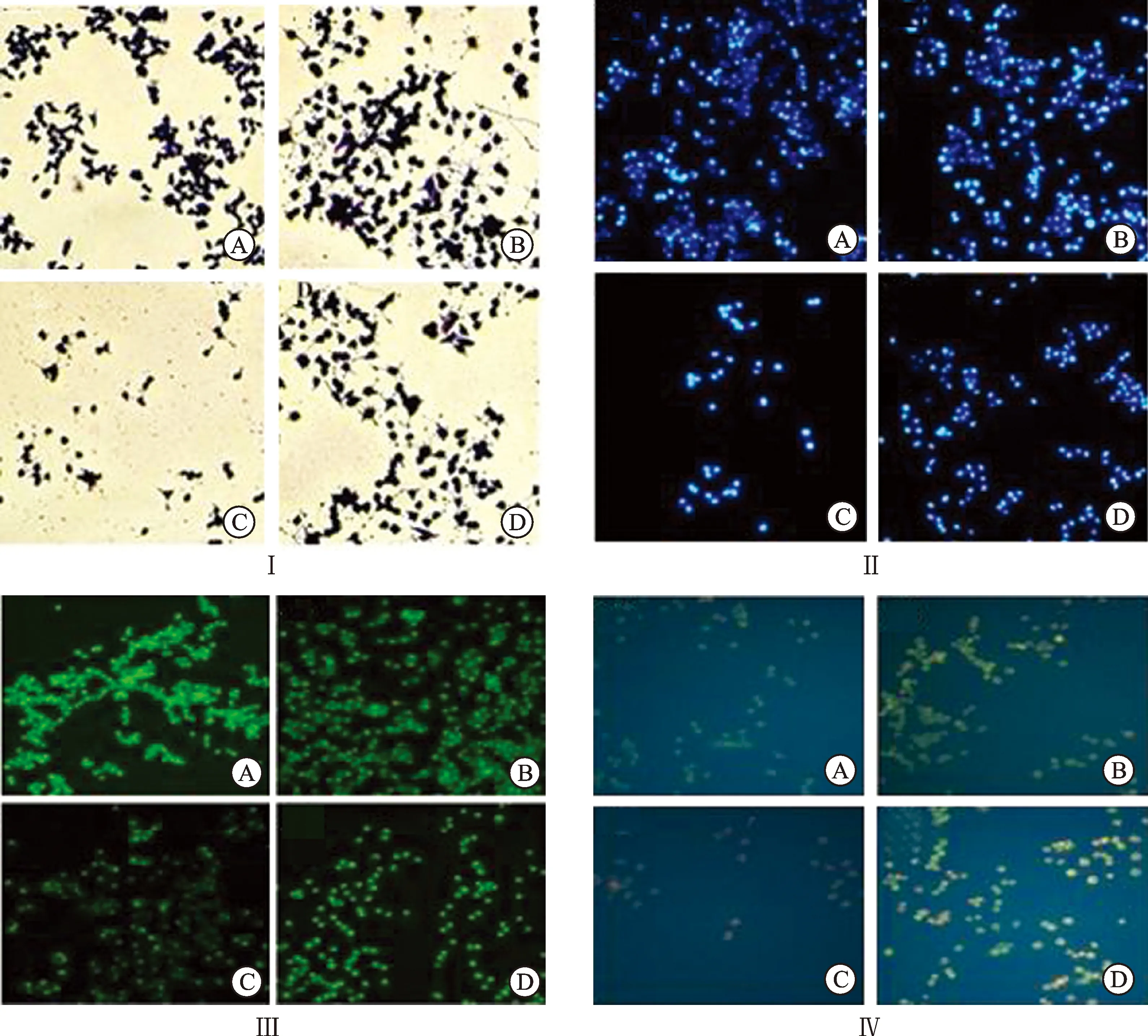
图1 T-CA对CoCl2损伤PC12细胞形态的影响
Ⅰ.Giemsa染色;Ⅱ.DAPI染色;Ⅲ.AO染色;Ⅳ.AO/EB染色;A.未分化PC12细胞;B.分化PC12细胞;C.CoCl2损伤PC12细胞;D.T-CA保护CoCl2损伤PC12细胞。
Fig.1 Effect of T-CA on PC12 cells insulted by CoCl2on morphology determined by Giemsa, DAPI, AO and AO/EB staining
Ⅰ.Giemsa staining;Ⅱ.DAPI staining;Ⅲ.AO staining;Ⅳ.AO/EB staining;A.undifferentiated PC12 cells;B.differentiated PC12 cells;C.CoCl2-insulted PC12 cells;D.CoCl2-insulted PC12 cells with T-CA.
3.4AO/EB染色观察T-CA对细胞形态的影响 镜下观察可见,丫啶橙(AO)染料可进入未分化组及分化组正常细胞膜中呈黄绿色荧光。溴乙锭(EB)染料则进入受损细胞膜显橘红色荧光。损伤组细胞凋亡,细胞数量显著减少,呈橘红色染色状态。给药组进行预保护后,因改善细胞凋亡情况,多见黄绿色染色,见图1。
3.5T-CA给药对MCAO大鼠存活情况的影响 通过比较3组大鼠的存活情况,发现T-CA给药组及假手术组大鼠无死亡情况,模型组2只大鼠死亡。可初步证明化合物T-CA可有效延长MCAO模型大鼠的生存时间,见表1。
3.6T-CA给药对MCAO大鼠脑皮层神经细胞的影响 镜下观察MCAO大鼠脑组织海马区HE染色切片,分析T-CA对模型大鼠皮层神经细胞的影响。假手术组(Sham)大脑皮层未见明显的病理变化,其神经细胞形态完整,细胞核仁清晰,细胞质呈均匀染色;模型组(Model)海马区神经细胞大量坏死,细胞核轮廓模糊,胞浆溶解,部分微血管有栓塞情况;给药组(T-CA)与模型组对比,组织坏死面积相对减少且程度较轻,细胞空泡范围减少,形态较为完整,见图2。
表1 给药10 d后MCAO大鼠的存活情况
Tab.1 The survival rate of MCAO rats after T-CA administration for 10 d

组别总数/只存活数/只存活率/%假手术组44100模型组5360给药组44100
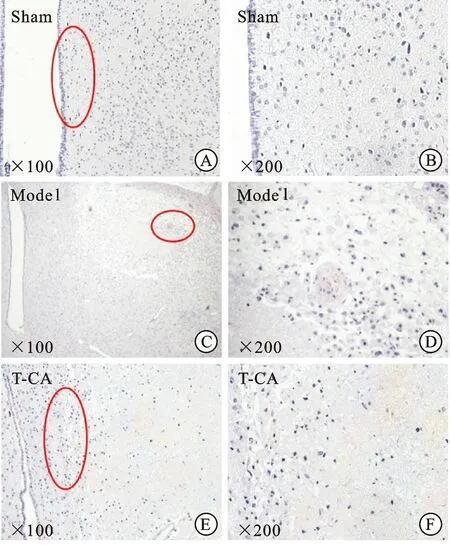
图2 MCAO大鼠脑组织海马区HE染色
A.假手术组(×100);B.假手术组(×200);C.模型组(×100);D.模型组(×200);E.给药组(×100);F.给药组(×200)。
Fig.2 HE staining in the hippocampus of MCAO mice brain sections
A.sham group(×100);B.sham group(×200);C.model group(×100);D.model group(×200);E.T-CA group(×100);F.T-CA group(×200).
4 讨论
缺血性脑卒中是一类常见的心脑血管类疾病,中医认为其属于中风范畴,其发病机制是血脉瘀阻脑络所致,临床一般采用活血化瘀理气药治疗[19-20]。川芎具有良好的活血行气和祛风止痛的功能,常与丹参配伍使用治疗此类疾病,其主要化学成分川芎嗪也被证明能够有效减少脑缺血再灌注所造成的脑部神经损伤[21-22]。基于中药配伍与化学药物拼合原理,选取川芎嗪与香豆酸进行结构拼合得到新型川芎嗪-香豆酸衍生物T-CA,并探讨其对脑缺血损伤模型的保护作用。
PC12细胞模型是一种常用的神经细胞株,经NGF诱导后分化呈神经元样,有显著的细胞突触,可广泛用于神经系统疾病的研究。本实验使用CoCl2造模PC12细胞使形成拟脑缺血损伤的细胞模型,并评价化合物T-CA对其形态的保护作用。MCAO大鼠模型是常用的大脑中动脉缺血评价模型。本实验采取Zea Longa法制备MCAO模型并评价化合物T-CA对大鼠存活率的改善情况。
实验通过Giemsa、DAPI、AO和AO/EB 4种细胞染色方法,验证了T-CA对CoCl2造模损伤的PC12细胞具有显著的保护作用,能够有效缓解损伤细胞的形态变化。同时,根据AO/EB染色结果可推断新型川芎嗪-香豆酸衍生物T-CA可能是通过抑制PC12细胞凋亡而发挥作用,这也为后续的研究机制提供了方向。在MCAO模型实验中,T-CA给药组大鼠的存活率显著高于模型组,并通过大鼠脑组织海马区HE染色检测缺血缺氧脑组织的神经细胞形态特征。与模型组相比,给药组神经细胞坏死区域显著减少,正常形态神经元较多,胞浆溶解较少,能有效缓解脑缺血造成的神经细胞凋亡。但大鼠样本量较少,在后续的研究中需扩大样本量进行深入研究。
实验结果表明,新型川芎嗪-香豆酸衍生物T-CA能显著改善CoCl2损伤PC12细胞所导致的形态改变,保持神经细胞的形态完整性。同时,可提高MCAO模型大鼠的存活率并有效缓解大鼠脑组织海马区神经细胞的凋亡及坏死,保护了损伤神经细胞的功能,为此类化合物的后续研究提供了参考依据。
