黄精配方颗粒的质量标准研究
2019-05-15刘恩俊肖会敏康晓刚曹爱兰王四旺谢艳华
刘恩俊,肖会敏,康晓刚,曹爱兰,张 俏,王四旺,谢艳华*
(1.空军军医大学中药和天然药物教研室,西安 710032;2.空军军医大学西京医院神经内科,西安 710032;3.陕西中药研究所,咸阳 712000)
黄精属多年生草本植物的干燥根茎,具有补脾润肺、益气养阴之功效[1]。黄精的主要成分有黄精多糖、甾体皂苷、多种氨基酸、酚类和5-羟甲基糠醛(5-HMF)等[2-3]。现代药理学研究表明,黄精有抗动脉粥样硬化、抗肿瘤、调节血糖血脂和免疫调节等药理作用[4-7];其主要成分黄精多糖、总酚和5-羟甲基糠醛具有调节血糖血脂、抗肿瘤和增强免疫力等功效[8-13]。黄精配方颗粒是以黄精饮片为原料,经水煎煮提取、浓缩、干燥和制粒制成的颗粒,供临床配方用,具有携带方便、保存方便和质量稳定等优点[14-16]。目前尚无黄精配方颗粒质量标准的研究报道,为了保证该配方颗粒制剂的疗效,现对其进行质量控制研究。
1 仪器与试药
1.1仪器 高效液相色谱仪(Prominen UFLC,LC/Labsoluion色谱工作站),购自日本岛津公司;UA2600型可见光-紫外分光光度计,购自中国天美科学仪器有限公司;AcculabVIC-412型十万分之一电子分析天平,购自德国赛多利斯集团;5417R型高速冷冻离心机,购自德国艾本德生命科技集团公司;SK2510LHC型双频加热型超声波清洗器,购自上海科导超声仪器有限公司。
1.2试药 乙腈和甲醇均为色谱纯,购自美国Honeywell公司;水为超纯水,Millipore纯水仪(美国Millipore公司)制备;黄精对照药材(批号12141-200401),无水葡萄糖对照品(批号110833-200904),5-羟甲基糠醛(批号111626-201610,质量分数为99.2%),没食子酸(批号111831-201605,质量分数为90.8%),均购自中国食品药品检定研究院;黄精配方颗粒及其对应浸膏粉[批号分别为:20160801(S1),20160802(S2),20160803(S3),20160804(S4),20160805(S5),20160806(S6),20160807(S7),20160808(S8),20160809(S9),20160810(S10),20160811(S11)和20160812(S12),均由陕西医药控股集团有限责任公司提供];硅胶G板,购自青岛海洋化工厂;蒽酮(批号20171201)和乙醇(批号20180330)均为分析纯,购自天津市富宇试剂有限公司;浓硫酸(批号20171130),分析纯,购自天津市科密欧化学试剂有限公司。
2 方法与结果
2.1黄精配方颗粒的TLC鉴别 取样品2 g,加入体积分数为70%的乙醇50 mL,加热回流1 h,抽滤,滤液蒸干,残渣中加入10 mL水,溶解,加正丁醇振摇提取2次,每次20 mL,合并正丁醇,蒸干溶剂,加入1 mL甲醇使残渣溶解,作为供试品溶液[17];另精密称取黄精对照药材1 g,按照上述方法制备黄精对照药材溶液。按照文献方法进行实验[18],精密吸取供试品溶液和对照药材溶液各10 μL,在同一硅胶G薄层板上依次点样,以石油醚(60~90 ℃)-乙酸乙酯-甲酸(5∶2∶0.1)为展开剂,展开,取出,喷以质量浓度为50 g·L-1的香草醛硫酸溶液,置于105 ℃的烘箱中加热,直至斑点显色清晰,将薄层板置于日光下检视,结果在供试品色谱中,在与对照药材色谱的相应位置上显相同颜色的斑点。结果见图1。

图1 TLC图
1~3.对照药材;4~15.样品(批号:20160801,20160802,20160803,20160804,20160805,20160806,20160807,20160808,20160809,20160810,20160811,20160812)。
Fig.1 TLC chromatogram
1-3.reference substance;4-15.sample(batch number:20160801,20160802,20160803,20160804,20160805,20160806,20160807,20160808,20160809,20160810,20160811,20160812).
2.2黄精多糖的含量测定
2.2.1对照品溶液的制备 精密称取在105 ℃干燥至恒质量的无水葡萄糖对照品33.28 mg,置于100 mL量瓶中,加水定容并摇匀,即得质量浓度为0.332 8 g·L-1的对照品溶液[17]。
2.2.2供试品溶液的制备 精密称取在60 ℃干燥至恒质量的黄精配方颗粒浸膏粉(批号20160808) 0.25 g,置于50 mL离心管中,加入10 mL水,超声15 min使溶解,加入40 mL无水乙醇,快加慢搅,在4 ℃冰箱中静置12 h,以6 000 r·min-1在4 ℃低温下离心15 min,弃上清液,氮气吹干沉淀,加水溶解,移至250 mL量瓶中,加水定容至刻度,摇匀,即得。
2.2.3空白对照溶液的制备 取水2 mL,置于10 mL具塞干燥试管中,在冰水浴中缓慢滴加质量浓度为2 g·L-1的蒽酮-硫酸溶液,边加边混匀至刻度线,待溶液放冷后,立即置于沸水浴中保温10 min,取出,在冰水浴中冷却10 min,取出,待溶液冷却至室温,即得。
2.2.4葡萄糖的标准曲线 精密吸取2.2.1项下制备的对照品溶液0.1,0.2,0.3,0.4,0.5和0.6 mL,分别置于10 mL试管中,加水定容至2 mL刻度,振荡摇匀,置于冰水浴中,缓慢滴加质量浓度为2 g·L-1的蒽酮-硫酸溶液至10 mL刻度,边加边混匀,待溶液放冷后,立即置于沸水浴中保温10 min,取出,在冰水浴中冷却10 min,取出,待溶液冷却至室温,按照文献方法实验[18],以2.2.3项下制备的溶液为空白对照,以吸光度值为纵坐标(y)、无水葡萄糖质量浓度为横坐标(x),在582 nm波长处测定吸光度值A并绘制标准曲线,得标准曲线y1=4.034x1+0.028,r1=0.999 3(n=6)。结果表明,无水葡萄糖质量浓度在0.033 28~0.199 68 g·L-1范围内线性关系良好。
2.2.5精密度实验 精密吸取2.2.1项下制备的对照品溶液0.2 mL,置于10 mL具塞干燥试管中,按照2.2.4项下方法测定吸光度值A,重复5次。结果RSD值为0.43%,表明仪器精密度良好。
2.2.6稳定性实验 精密吸取黄精配方颗粒浸膏粉(批号20160808)0.25 g,置于10 mL试管中,依照2.2.4项下方法,在室温下于第0,0.5,1.0,2.0,4.0,8.0和12.0 h测定其吸光度值A,结果RSD值为0.71%,表明实验稳定性良好。
2.2.7重复性实验 精密吸取黄精配方颗粒浸膏粉(批号20160808)0.25 g,6份,按照2.2.4项下方法测定吸光度值A。结果RSD值为2.65%,表明实验重复性良好。
2.2.8加样回收率实验 精密称取黄精配方颗粒浸膏粉0.25 g(批号20160808)9份,各组分别精密加入已知含量的葡萄糖对照品溶液,按照表1数据添加,按照2.2.2项下方法制备供试品溶液,按照2.2.4项下方法测定其吸光度值A,结果见表1。
表1 黄精多糖回收率实验结果
Tab.1 The results of recovery rate test ofPolygonatumpolysaccharide
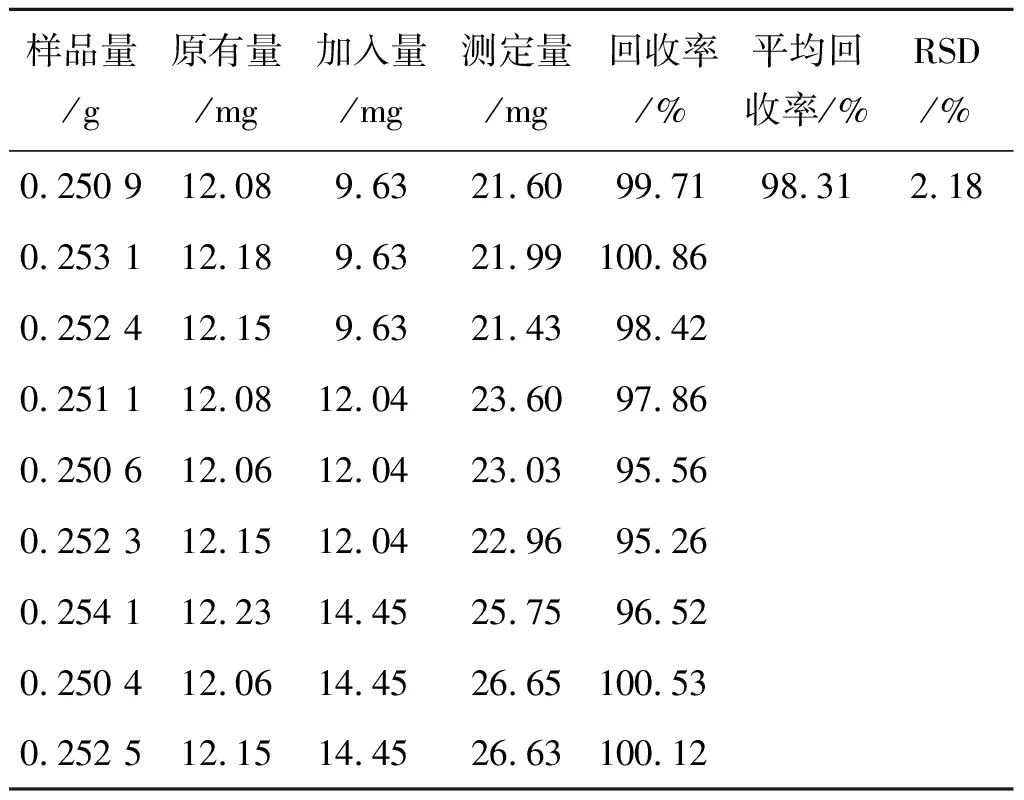
样品量/g原有量/mg加入量/mg测定量/mg回收率/%平均回收率/%RSD/%0.250 912.089.6321.6099.7198.312.180.253 112.189.6321.99100.860.252 412.159.6321.4398.420.251 112.0812.0423.6097.860.250 612.0612.0423.0395.560.252 312.1512.0422.9695.260.254 112.2314.4525.7596.520.250 412.0614.4526.65100.530.252 512.1514.4526.63100.12
2.2.9样品的含量测定 取12批不同产地的供试品溶液各1 mL,分别置于10 mL试管中,按照2.2.4项下方法测定吸光度值A,计算黄精配方颗粒中黄精多糖的含量,结果见表1。
2.3总酚的含量测定
2.3.1没食子酸对照品溶液的制备 精确称取已烘干至恒质量的没食子酸对照品13.24 mg,置于50 mL量瓶中,用甲醇溶解并稀释至刻度,摇匀,即得质量浓度为0.262 8 g·L-1的没食子酸对照品溶液[19]。
2.3.2供试品溶液的制备 取黄精配方颗粒3袋(批号20180801),研细,混匀,精确称取2 g,置于试管中,加入20 mL水,在250 W、40 kHz条件下超声30 min,过滤残渣,收集滤液,提取3 次,用旋蒸仪蒸干,加水定容至1 mL,过滤,即得。
2.3.3没食子酸的标准曲线 分别精密吸取2.3.1项下制备的对照品溶液0,20,40,60,80,100,120,140,160和200 μL,分别置于5 mL 棕色量瓶中,加入3.2 mL水、200 μL福林酚显色剂,充分振荡混匀,静置6~8 min,再加入质量浓度为150 g·L-1的碳酸钠溶液500 μL。充分混匀,避光放置,室温下反应2 h。在765 nm波长处检测其吸光度值A。以对照品质量浓度为横坐标(y)、吸光度值为纵坐标(x),绘制标准曲线。实验结果表明,没食子酸的标准曲线为y2=12.94x2+0.144,r2=0.999 8(n=6)。结果表明,没食子酸质量浓度在0.005 2~0.052 0 g·L-1范围内线性关系良好。
2.3.4精密度实验 精密吸取2.3.1项下制备的对照品溶液40 μL,置于5 mL 棕色量瓶中,按照2.3.3项下方法测定吸光度值,重复5次。结果RSD值为0.97%,表明仪器精密度良好。
2.3.5稳定性实验 精密吸取2.3.2项下制备的供试品溶液(批号20160801)40 μL,置于棕色量瓶中,按照2.3.3项下方法测定吸光度值,在室温下2 h内每隔一定时间测定其吸光度值,结果RSD值为0.88%,表明实验稳定性良好。
2.3.6重复性实验 精密吸取2.3.2项下制备的供试品溶液(批号20160801)40 μL,6份,按照2.3.3项下方法测定吸光度值A。结果RSD值为1.25%,表明实验重复性良好。
2.3.7加样回收率实验 精密吸取2.3.2项下制备的供试品溶液0.1 mL(批号20160801),9份,各组分别精密加入已知质量浓度的没食子酸对照品溶液0.1 mL,按照2.3.3项下方法显色后,以不含没食子酸的溶液作为空白对照,于765 nm波长处测定吸光度值A,计算回收率,结果见表2。
表2 总酚回收率实验结果
Tab.2 The results of recovery rate test of total phenolic acid
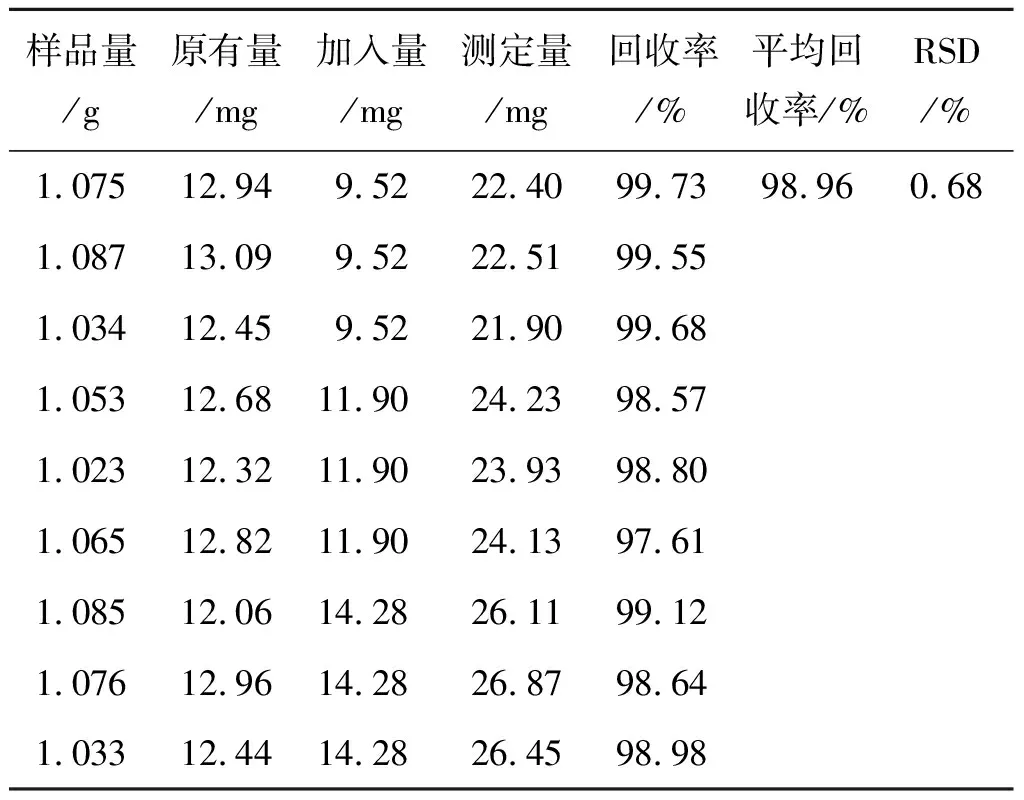
样品量/g原有量/mg加入量/mg测定量/mg回收率/%平均回收率/%RSD/%1.07512.949.5222.4099.7398.960.681.08713.099.5222.5199.551.03412.459.5221.9099.681.05312.6811.9024.2398.571.02312.3211.9023.9398.801.06512.8211.9024.1397.611.08512.0614.2826.1199.121.07612.9614.2826.8798.641.03312.4414.2826.4598.98
2.3.8样品中总酚含量的测定 精确吸取2.3.2项下制备的供试品溶液40 μL,按照2.3.3项下方法测定并计算黄精配方颗粒中的总酚含量,结果见表4。
2.45-羟甲基糠醛的含量测定
2.4.1色谱条件 色谱柱为Intersil C18(250 mm×4.6 mm,5 μm);流动相:乙腈-0.85 mL·L-1磷酸水溶液(5∶95);流速:0.8 mL·min-1;柱温:35 ℃;检测波长:274 nm;进样量:10 μL。色谱图见图2。
2.4.2对照品溶液的制备 精密称取5-羟甲基糠醛10.08 mg,置于5 mL量瓶中,加甲醇定容至刻度,摇匀,即得质量浓度为2.00 g·L-1的对照品溶液。
2.4.3供试品溶液的制备 取本品3袋(批号20160808),研细,混匀,精密称取10 g,置于具塞锥形瓶中,加水50 mL,称定质量,在250 kW、40 kHz条件下超声处理30 min,放冷至室温,补足减失的质量,摇匀,滤过,取续滤液,即得。
2.4.4线性关系 分别精密量取2.4.2项下制备的对照品溶液0.02,0.10,0.20,0.50,1.00和2.00 mL,分别置于2 mL量瓶中,加水稀释至刻度,用0.45 μm微孔滤膜过滤,测定含量。以对照品质量浓度为横坐标(x)、峰面积值为纵坐标(y),得线性方程y3=15 468 610x3-663 735,r3=0.999 1 (n=6)。结果表明,5-羟甲基糖醛质量浓度在0.020~2.000 g·L-1范围内线性关系良好。
2.4.5精密度实验 精密吸取2.4.3项下制备的供试品溶液适量(批号20160808),重复进样5次,测得5-羟甲基糠醛峰面积的RSD值为1.00%,表明该方法精密度良好。
2.4.6重复性实验 精密称取样品(批号20160808)6份,分别按照2.4.3项下方法制备的供试品溶液,按照2.4.1项下色谱条件进样测定。结果,5-羟甲基糠醛的平均含量为0.824 mg·g-1,RSD值为1.02%,表明该方法重复性良好。
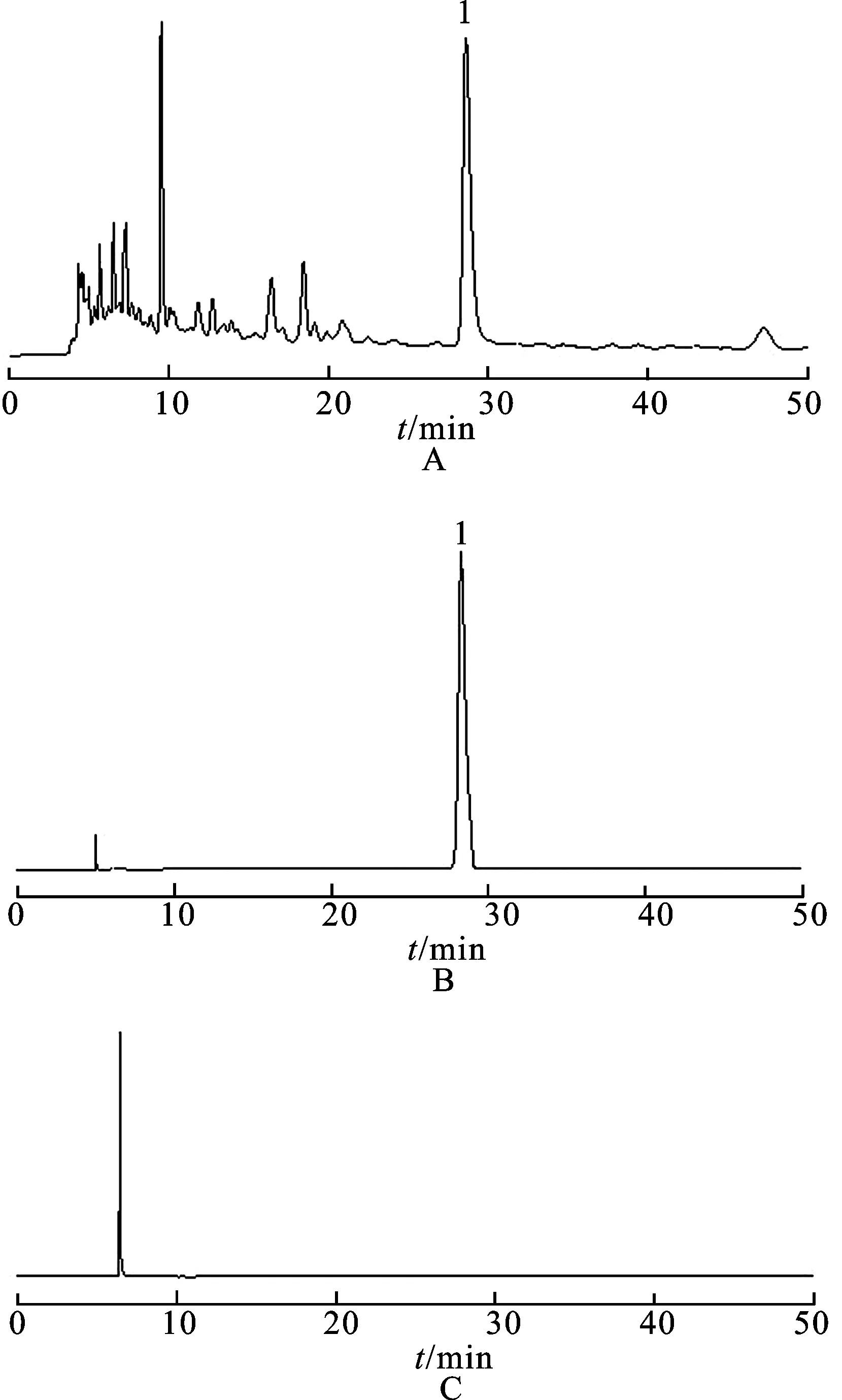
图2 HPLC图
A.供试品溶液;B.对照品溶液;C.空白对照溶液;1.5-羟甲基糠醛。
Fig.2 HPLC chromatograms
A.sample solution;B.reference substance;C.blank solution;1.5-HMF.
2.4.7稳定性实验 精密吸取2.4.3项下制备的供试品溶液适量(批号20160808),分别在0,2,4,8,12和24 h进样。结果显示,5-羟甲基糠醛峰面积的RSD值为0.82%,表明该溶液在24 h内稳定。
2.4.8加样回收率实验 精密量取黄精配方颗粒(批号20160808,其中5-羟甲基糠醛的含量为0.824 0 mg·g-1)1.0 g,按照表3分别添加对照品溶液(精密称取5-羟甲基糠醛适量,制成质量浓度为8.10 g·L-1的水溶液0.80,1.00和1.20 mL,再加水定容至刻度,按照2.4.3项下方法制备9份供试品溶液,按照2.4.1项下色谱条件进样测定。结果见表3,表明该方法加样回收率良好。
2.4.9含量测定 精密称取12批样品,分别按照2.4.3项下方法制备供试品溶液,按照2.4.1项下色谱条件测定5-羟甲基糠醛的含量。各批配方颗粒样品中5-羟甲基糠醛的含量见表4。
表3 5-羟甲基糠醛的回收率测定结果
Tab.3 The results of recovery rate of 5-HMF
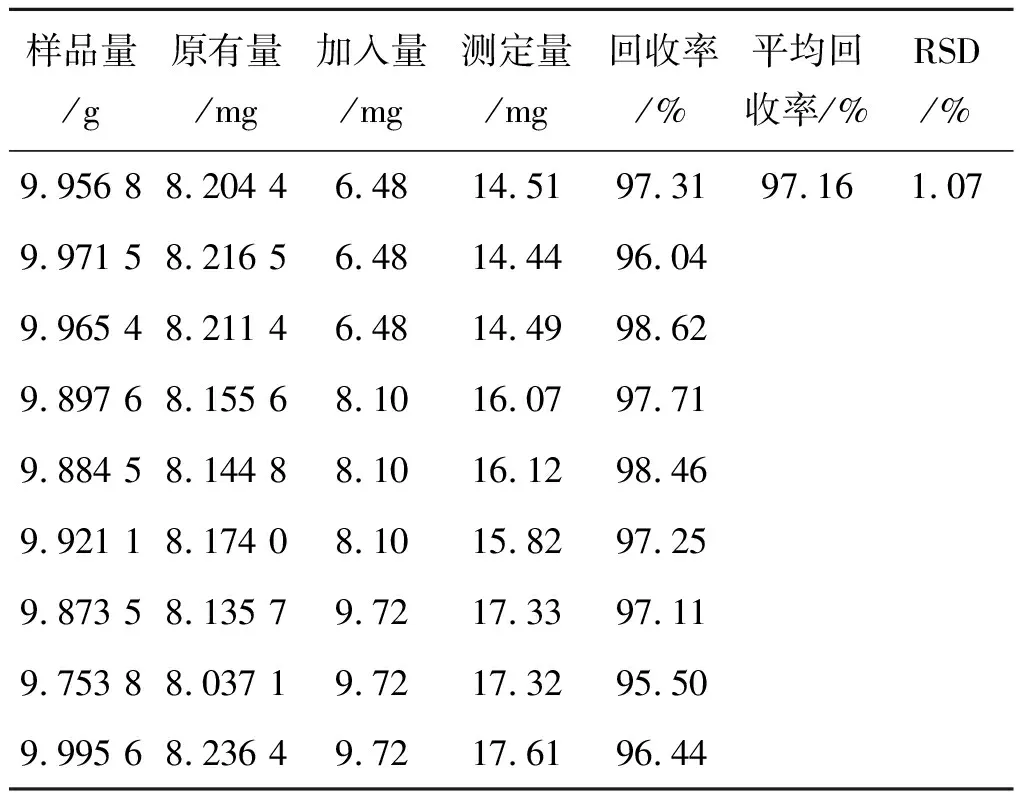
样品量/g原有量/mg加入量/mg测定量/mg回收率/%平均回收率/%RSD/%9.956 88.204 46.4814.5197.3197.161.079.971 58.216 56.4814.4496.049.965 48.211 46.4814.4998.629.897 68.155 68.1016.0797.719.884 58.144 88.1016.1298.469.921 18.174 08.1015.8297.259.873 58.135 79.7217.3397.119.753 88.037 19.7217.3295.509.995 68.236 49.7217.6196.44
表4 12批黄精配方颗粒中黄精多糖、总酚和5-羟甲基糠醛含量的测定结果
Tab.4 Determination ofPolygonatumpolysaccharide,total phenolic acids and 5-HMF in 12 batches ofRhizomaPolygonatumDispensing Granules

批号(产地)黄精多糖/mg·g-1总酚/mg·g-15-羟甲基糠醛/mg·g-120160801(陕西宜君-1)25.3412.040.701 120160802(陕西宜君-2)23.6411.900.790 620160803(陕西宜君-3)44.9411.970.858 220160804(陕西宜君-4)41.4711.310.635 120160805(陕西宜君-5)29.9815.280.891 620160806(陕西宜君-6)35.5215.820.622 920160807(陕西合阳)30.4913.280.573 620160808(陕西柞水)48.1416.340.824 020160809(陕西眉县)42.5918.950.648 020160810(陕西留坝)34.6516.530.790 620160811(陕西勉县)22.5115.300.800 520160812(陕西安康)37.4813.530.733 7平均含量/mg·g-134.7314.350.739 2RSD/%24.5616.5213.85
3 讨论
3.1TLC鉴别 本实验对12批不同产地的黄精配方颗粒进行TLC鉴别,在展开剂的选择上参考文献[17]选择石油醚(60~90 ℃)-乙酸乙酯-甲酸为展开剂,展开剂的比例考察了石油醚(60~90 ℃)-乙酸乙酯-甲酸(5∶2∶0.1)、石油醚(60~90 ℃)-乙酸乙酯-甲酸(5∶3∶0.1)和石油醚(60~90 ℃)-乙酸乙酯-甲酸(5∶4∶0.1)不同比例的展开剂,最终发现在石油醚(60~90 ℃)-乙酸乙酯-甲酸(5∶2∶0.1),展开后喷以质量浓度为50 g·L-1的条件下香草醛硫酸溶液分离效果最好。结果显示,TLC鉴别图谱分离度好、专属性强、重复性好且操作方法简单,可列入药品质量标准。
3.2总酚含量的质量标准 总酚的线性范围为0.005 2~0.052 0 g·L-1,对应的吸光度值为0.208 4~0.815 2,符合紫外分光光度计的0.1~1.0的范围,所测的总酚吸光度值均在线性范围内。12批不同产地的黄精配方颗粒中总酚的含量存在显著差异,其中含量最高的为陕西眉县,为18.95 mg·g-1;含量最低的为陕西宜君-4,为11.31 mg·g-1,但差异较小,因此可将总酚含量不得低于11.00 mg·g-1列入质量标准。
3.3黄精多糖含量的质量标准 本研究选择无水葡萄糖作为对照品,因为蒽酮-硫酸法的原理为多糖与浓硫酸反应脱水生成糖醛,糖醛与蒽酮反应生成蓝绿色沉淀,该沉淀在582 nm波长处有最大吸光度值,而葡萄糖也可发生上述反应。目前多糖的含量测定多以无水葡萄糖计,故选用无水葡萄糖作为对照品。葡萄糖标准曲线的线性范围为0.033 28~0.199 68 g·L-1,对应的吸光度值为0.162 2~0.833 5,符合紫外分光光度计的0.1~1.0的范围,所测的多糖吸光度值均在线性范围内。
研究发现,由于配方颗粒中加入糊精等辅料,在使用蒽酮-硫酸法测定多糖时糊精会对检测结果造成干扰,使得测定量结果偏大,因此为了排除糊精对测定量结果的干扰,本次实验使用黄精配方颗粒浸膏粉来制备供试品溶液。质量浓度为2 g·L-1的蒽酮-硫酸溶液,临用现配且需要避光保存。另外,反应时间、水浴温度需按照实验标准执行[17]。文献[20-22]报道,黄精浸膏的多糖提取采用醇沉法进行提取,所用乙醇为无水乙醇,沉淀1次,该法稳定且重复性好,加样回收率高,RSD值均小于3%,可用来测定黄精多糖的含量。结果显示,12批不同产地的黄精配方颗粒中黄精多糖最高和最低含量分别为48.14 和22.51 mg·g-1,RSD值为24.56%,说明不同产地黄精多糖含量具有明显差异,但黄精多糖为该配方颗粒的主要成分,含量较高,因此将黄精多糖含量不得低于24.00 mg·g-1列入质量标准。
3.45-羟甲基糠醛含量的质量标准 本品为水提物,成分复杂,主要成分为氨基酸、多糖和黄酮类等成分。HPLC法检测该产品中的多糖和氨基酸需要进行衍生化,操作复杂,干扰因素较多。因此,选择5-羟甲基糠醛作为本品检测的单体成分[23],经过对色谱条件进行优化,即色谱条件为:色谱柱为Intersil C18(250 mm×4.6 mm,5 μm);流动相为乙腈-0.85 mL·L-1磷酸水溶液(5∶95);流速为0.8 mL·min-1;柱温为35 ℃;检测波长为274 nm;进样量为10 μL。经过对12批不同产地配方颗粒的分析,结果显示,5-羟甲基糖醛最高和最低含量分别为0.891 6和0.573 6 mg·g-1,RSD值为13.85%,说明不同产地黄精配方颗粒中5-羟甲基糠醛的含量具有明显差异,但5-羟甲基糠醛为该配方颗粒的主要成分,含量较高,因此,将5-羟甲基糠醛含量不得低于0.500 0 mg·g-1列入质量标准。
综上所述,建立的标准稳定性与重复性良好,其测定方法简单易行,可以很好地控制黄精配方颗粒的质量。
