百合地黄汤不同萃取部位的镇静催眠活性研究
2019-05-15郑竹宏赵仁云丁玉婷孙玉杰李剑豪杨雨薇孙毅坤
郑竹宏,赵仁云,丁玉婷,张 娜,孙玉杰,李剑豪,杨雨薇,孙毅坤
(北京中医药大学中药学院,北京 102488)
由于黑腹果蝇在遗传、节律等方面与哺乳动物具有很多相同的特征[11-13],在睡眠的神经生物学机制和相关基因研究方面受到人们的高度关注[14];因此,本实验以果蝇为模式生物,借助新型果蝇活动监测装置,以果蝇的睡眠时间为指标,筛选得到百合地黄汤提取物镇静催眠的有效部位,并基于单胺类神经递质的水平对各有效部位的镇静催眠作用进行研究,为明确百合地黄汤镇静催眠作用的物质基础提供实验依据。
1 仪器与材料
1.1仪器 新型果蝇活动监测装置,实验室自制;DZ-IAII型真空干燥箱(天津市泰斯特仪器有限公司);RXZ-280B型智能人工气候箱(宁波江南仪器厂);万分之一天平[赛多利斯科学仪器(北京)有限公司];GTR10-2型高速冷冻离心机(北京时代北利离心机有限公司);Alliance 2695型高效液相色谱仪,ECD 2465型电化学检测器[沃特世科技(上海)有限公司]。
1.2试药 百合(产地江苏,批号160926003)、生地黄(产地河南,批号160503005),均购于北京康源祥瑞医药科技有限公司,并由北京市药品检验所常增荣主任药师鉴定;戊巴比妥钠(批号WS20060401),购于国药集团化学试剂有限公司;多巴胺(DA,批号100070-201507),购于中国食品药品检定研究院;5-羟色胺(5-HT,批号BO1022DA14),高香草酸(HVA,批号S07J6G1),5-羟吲哚乙酸(5-HIAA,批号K10A8B33603),均购于上海源叶生物科技有限公司;玉米粉、黄豆粉(食品级)、琼脂粉、酵母粉、麦芽糖和丙酸,均购于北京拜尔迪生物技术有限公司。
2 方法
2.1百合地黄汤不同部位萃取物的制备 按照百合∶生地黄=2∶1的比例称取适量,用12倍量体积分数为50%的乙醇溶液浸泡60 min,回流提取90 min,提取2次,合并提取液并减压浓缩至无醇味。用热水分散后依次用石油醚、二氯甲烷、乙酸乙酯以及水饱和正丁醇萃取分离,将各萃取部位浓缩,50 ℃真空干燥,得百合地黄汤石油醚部位、二氯甲烷部位、乙酸乙酯部位和水饱和正丁醇部位的萃取物粉末,密封,置于4 ℃冰箱中保存,备用。
2.2基础培养基的制备 分别取玉米粉、黄豆粉、琼脂粉和麦芽糖27,18,2和50 g,加入800 mL蒸馏水中,煮沸,待温度降至室温后,加入丙酸5 mL和酵母粉13 g,混匀,倒入灭菌后的果蝇培养管中,每管培养基厚度为 2 cm,冷却,待培养基凝固,备用。
2.3含药培养基的制备 在2.2项下基础培养基的原料中加入一定量的百合地黄汤提取物、石油醚萃取物、二氯甲烷萃取物、乙酸乙酯萃取物和水饱和正丁醇萃取物,按照2.2项下培养基的配制方法,分别配制成质量分数为0.50%,2.50%和5.00%的含药培养基,并配制5.00%的阳性药培养基,将含药培养基倒入一次性无菌培养皿中,厚度为2 mm,冷却凝固,备用。将监测管一端插入培养基后拔出,并蘸取融化好的蜡液进行蜡封,待蜡液冷却凝固后,另一端用棉球封住。
2.4果蝇睡眠-觉醒活动监测 以野生型 Canton S 品系野生型黑腹果蝇作为观察对象,收集12 h内羽化未交配的雌性处女果蝇,用乙醚麻醉,将果蝇置于含基础培养基的培养管中饲养,分为空白组、模型组和给药组,每组32只。于第4天早7点给药,将空白组和模型组果蝇移入含基础培养基的监测管中[15-17],夜间采用光照刺激复制失眠模型。监测前适应环境 24 h,从第7天上午7点至次日上午7点,采用新型果蝇活动监测装置,以果蝇睡眠时间为评价指标,对每只果蝇的睡眠活动进行24 h连续监测。数据采集软件自动记录果蝇即时活动距离,以1 min为单位记录每帧的活动情况。
2.5HPLC-ECD法测定果蝇脑部单胺类神经递质
2.5.1样本采集 收集12 h内羽化未交配的果蝇,用乙醚麻醉,将果蝇置于含基础培养基的培养管中饲养,分为空白组、模型组和给药组,每组80只。于第4天早7点给药,将空白组和模型组果蝇移入含基础培养基的培养管中,夜间采用光照刺激复制失眠模型,于第8天早7点收集果蝇脑部。
2.5.2蛋白沉淀剂的制备 分别取乙二胺四乙酸二钠和亚硫酸钠0.011 3和0.006 2 g,高氯酸858 μL,置于100 mL量瓶中,用水稀释至刻度,摇匀,即得蛋白沉淀剂。4 ℃避光保存,备用。
高碳天然气捕集技术:以松南高碳天然气分离捕集装置为代表,采用MDEA胺法脱碳工艺,将松南高碳气田(二氧化碳含量23%)中的二氧化碳捕集分离,生产清洁天然气,年处理能力达50万吨。
2.5.3供试品溶液的制备 取80只果蝇脑部,置于1.5 mL离心管中,加入100 μL 2.5.2项下制备的蛋白沉淀剂,超声破碎30次,静置30 min,4 ℃时以12 000 r·min-1离心10 min,取上清液,即得。
2.5.4混合对照品溶液的配制 精密称取DA、5-HIAA、HVA 和5-HT对照品各5 mg,分别置于5 mL量瓶中,用2.5.2项下制备的蛋白沉淀剂稀释至刻度,摇匀,制得质量浓度为1 mg·mL-1的混合对照品储备液。临用前用蛋白沉淀剂稀释,配制成含DA、5-HIAA、HVA和5-HT质量浓度分别为0.20,0.24,0.16和0.16的高质量浓度混合对照品溶液;质量浓度分别为0.25,0.30,0.20和0.20的中质量浓度混合对照品溶液;质量浓度分别为0.30,0.36,0.24和0.24的低质量浓度混合对照品溶液。
2.5.5色谱条件 色谱柱为Atlantis C18色谱柱(150 mm×2.1 mm,3 μm),流动相为甲醇和缓冲盐溶液,其中缓冲盐包括50 mmol·L-1柠檬酸-乙酸钠,pH值为3.5,内含1 mmol·L-1B8离子对试剂、1.8 mmol·L-1二正丁胺和0.3 mmol·L-1乙二胺四乙酸二钠。甲醇与缓冲盐的比例为4∶96;检测电压为0.75 V;柱温为35 ℃;流速为0.2 mL·min-1。
2.6统计学方法 采用SPSS 17.0统计软件进行分析处理,实验结果采用x±s表示,采用单因素方差分析,P<0.05为差异具有统计学意义。
3 结果与分析
3.1不同萃取部位对果蝇睡眠时间的影响 与空白组比较,模型组果蝇的总睡眠时间和夜间睡眠时间显著缩短(P<0.01),表明失眠模型复制成功。与模型组比较,阳性药组果蝇的总睡眠时间、白天睡眠时间以及夜间睡眠时间显著增加(P<0.01),百合地黄汤全方组与石油醚部位低剂量组果蝇的总睡眠时间与白天睡眠时间明显增加(P<0.05),二氯甲烷部位中剂量组和水饱和正丁醇部位低剂量组果蝇的总睡眠时间、白天睡眠时间和夜间睡眠时间均明显增加(P<0.05),乙酸乙酯部位中剂量组果蝇总睡眠时间和夜间睡眠时间增加(P<0.05)。结果见表1。
表1 百合地黄汤不同部位萃取物对果蝇睡眠时间的影响
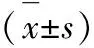
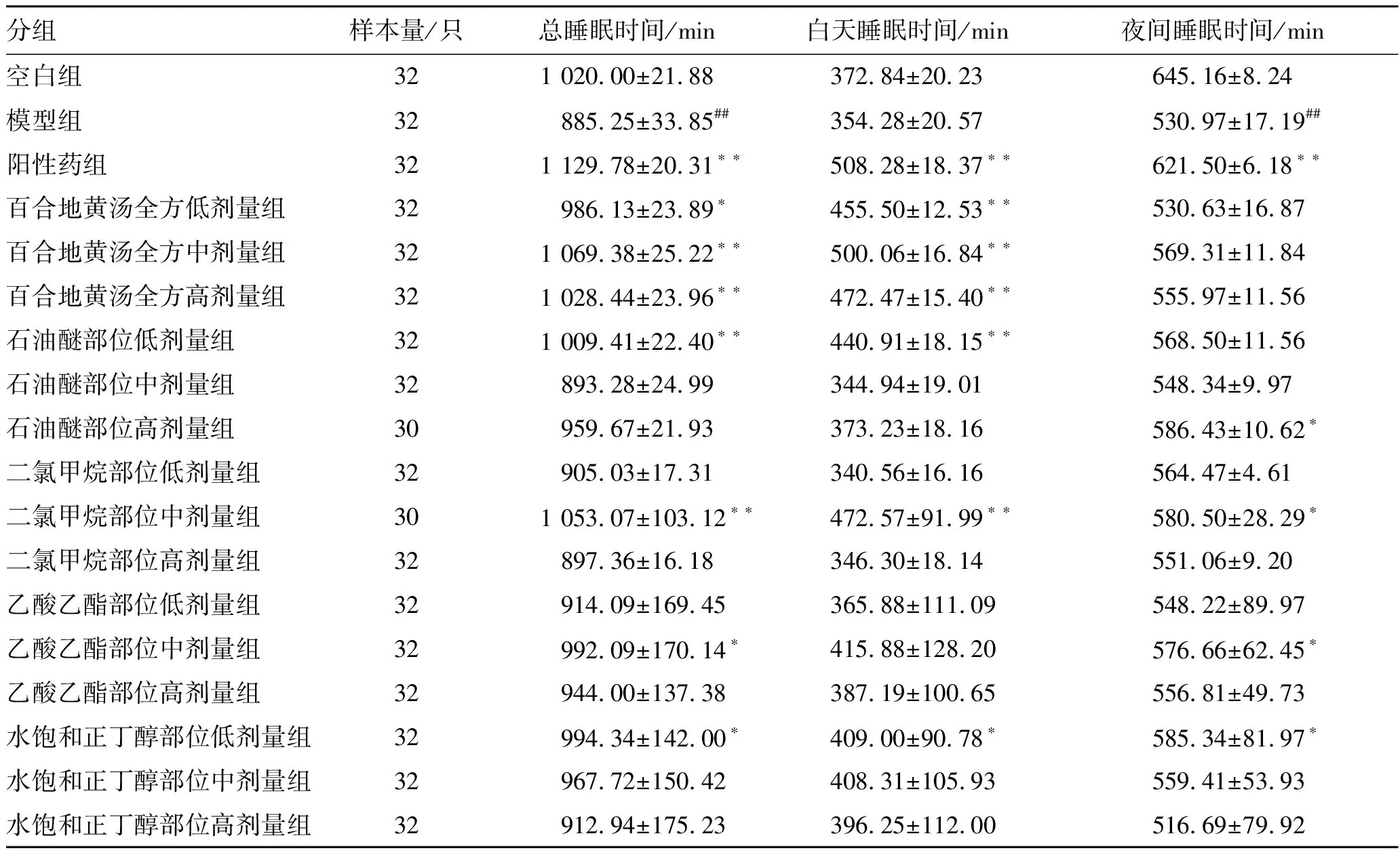
分组样本量/只总睡眠时间/min白天睡眠时间/min夜间睡眠时间/min空白组321 020.00±21.88372.84±20.23645.16±8.24模型组32885.25±33.85##354.28±20.57530.97±17.19##阳性药组321 129.78±20.31∗∗508.28±18.37∗∗621.50±6.18∗∗百合地黄汤全方低剂量组32986.13±23.89∗455.50±12.53∗∗530.63±16.87百合地黄汤全方中剂量组321 069.38±25.22∗∗500.06±16.84∗∗569.31±11.84百合地黄汤全方高剂量组321 028.44±23.96∗∗472.47±15.40∗∗555.97±11.56石油醚部位低剂量组321 009.41±22.40∗∗440.91±18.15∗∗568.50±11.56石油醚部位中剂量组32893.28±24.99344.94±19.01548.34±9.97石油醚部位高剂量组30959.67±21.93373.23±18.16586.43±10.62∗二氯甲烷部位低剂量组32905.03±17.31340.56±16.16564.47±4.61二氯甲烷部位中剂量组301 053.07±103.12∗∗472.57±91.99∗∗580.50±28.29∗二氯甲烷部位高剂量组32897.36±16.18346.30±18.14551.06±9.20乙酸乙酯部位低剂量组32914.09±169.45365.88±111.09548.22±89.97乙酸乙酯部位中剂量组32992.09±170.14∗415.88±128.20576.66±62.45∗乙酸乙酯部位高剂量组32944.00±137.38387.19±100.65556.81±49.73水饱和正丁醇部位低剂量组32994.34±142.00∗409.00±90.78∗585.34±81.97∗水饱和正丁醇部位中剂量组32967.72±150.42408.31±105.93559.41±53.93水饱和正丁醇部位高剂量组32912.94±175.23396.25±112.00516.69±79.92
注:与空白组比较##P<0.01;与模型组比较*P<0.05,**P<0.01。
3.2方法学考察结果
3.2.1专属性实验 取含0.3 mmol·L-1乙二胺四乙酸二钠和0.5 mmol·L-1亚硫酸钠的0.1 mol·L-1高氯酸溶液,进样5 μL,作为阴性对照。取2.5.4项下制备的质量浓度为1 μg·mL-1的混合对照品溶液,进样5 μL。按照2.5.3项下方法制备供试品溶液,进样5 μL。结果见图1。
3.2.2检测限和定量限实验 取质量浓度分别为1 μg·mL-1的DA和5-HT 对照品溶液,用2.5.2项下制备的蛋白沉淀剂稀释,检测限S/N≥3,定量限S/N≥10。DA的检测限和定量限分别为0.035和0.065 ng;5-HIAA的检测限和定量限分别为0.04和0.08 ng;HVA的检测限和定量限分别为0.05和0.15 ng;5-HT的检测限和定量限分别为0.08和0.13 ng。
3.2.3线性关系考察 取2.5.4项下制备的不同质量浓度的混合对照品溶液,分别进样5 μL。以质量浓度为横坐标(x)、对照品的峰面积为纵坐标(y),进行回归分析。结果见表2。

图1 HPLC图
A.阴性对照;B.混合对照品;C.供试品溶液;1.DA;2.5-HIAA;3.HVA;4.5-HT。
Fig.1 HPLC chromatograms
A.negative control;B.mixed reference substances;C.sample;1.DA; 2.5-HIAA;3.HVA;4.5-HT.
表2 线性关系考察结果
Tab.2 Results of linear relationships

成分线性范围/ng线性方程R2DA0.75~3.75y1=1 420 721.23x1-282 690.230.999 75-HIAA0.50~3.00y2=1 636 907.42x2-17 572.880.999 5HVA0.48~6.40y3=1 080 360.82x3-337 756.780.999 65-HT0.20~1.60y4=1 732 475.97x4-142 110.750.999 7
3.2.4稳定性实验 将样品溶液在4 ℃条件下放置0,2,4,8,12和24 h测定,计算RSD值,结果样品溶液的RSD值在1.12%~2.50%之间,表明稳定性良好。
3.2.5精密度实验 精密称取2.5.4项下制备的高、中、低质量浓度混合对照品溶液,重复进样6次,测定并计算RSD值,高、中、低质量浓度混合对照品溶液的日内精密度在0.98%~1.45%之间,日间精密度在1.98%~9.86%之间,表明精密度均良好。
3.2.6加样回收率实验 取样品9份,分别加入2.5.4项下制备的高、中、低3种质量浓度的混合对照品溶液,再按照2.5.3项下方法操作,平行测定,计算平均回收率,结果见表3。高、中、低质量浓度混合对照品的平均回收率在96.18%~107.20%之间,回收率良好。
表3 加样回收率实验结果
Tab.3 Results of sample recovery test (n=6)
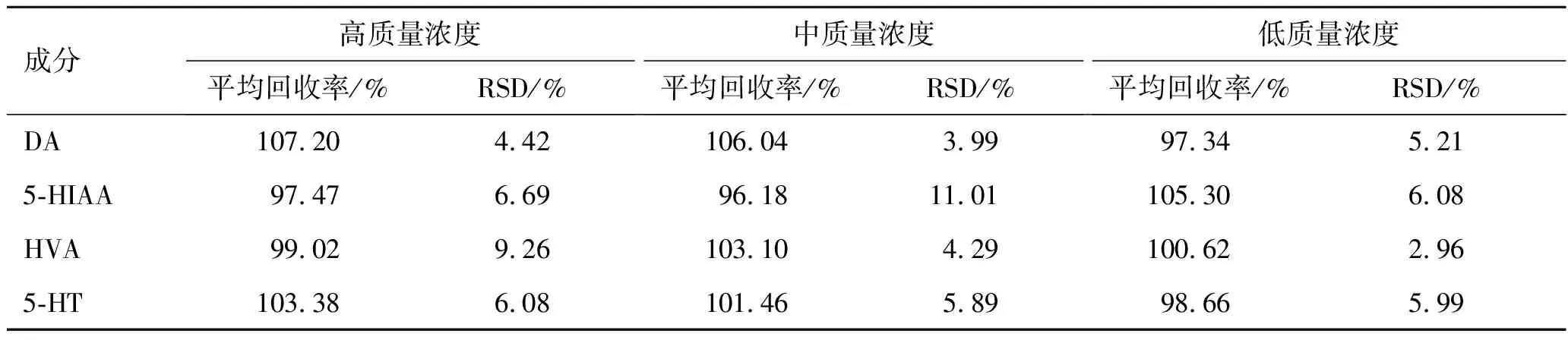
成分高质量浓度平均回收率/%RSD/%中质量浓度平均回收率/%RSD/%低质量浓度平均回收率/%RSD/%DA107.204.42106.043.9997.345.215-HIAA97.476.6996.1811.01105.306.08HVA99.029.26103.104.29100.622.965-HT103.386.08101.465.8998.665.99
3.3有效部位萃取物对果蝇脑部单胺类神经递质的影响 与空白组比较,模型组果蝇脑部的DA含量明显升高(P<0.05),5-HT及代谢物5-HIAA的含量明显降低(P<0.05),表明成功复制失眠模型。与模型组比较,阳性药组果蝇脑部的DA明显降低(P<0.05),5-HT含量升高(P<0.05),5-HIAA和HVA含量无明显变化;不同萃取部位对果蝇脑部DA及代谢物HVA的含量具有降低作用,对5-HT及代谢物5-HIAA的含量具有升高作用。结果见表4。
表4 单胺类神经递质含量测定结果
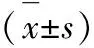
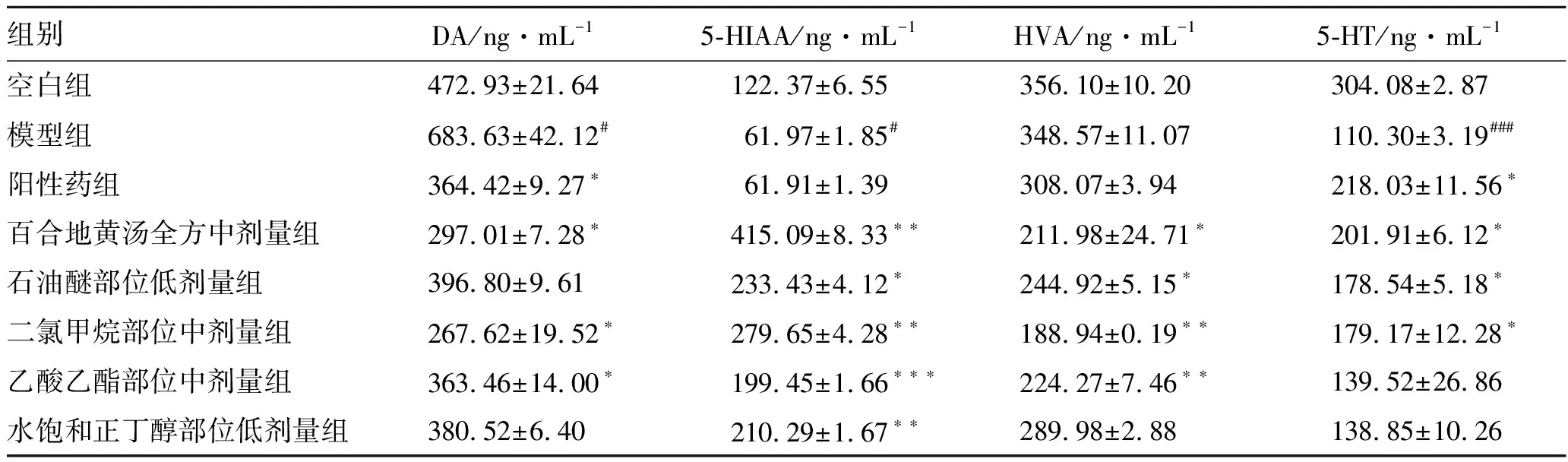
组别DA/ng·mL-15-HIAA/ng·mL-1HVA/ng·mL-15-HT/ng·mL-1空白组472.93±21.64122.37±6.55356.10±10.20304.08±2.87模型组683.63±42.12#61.97±1.85#348.57±11.07110.30±3.19###阳性药组364.42±9.27∗61.91±1.39308.07±3.94218.03±11.56∗百合地黄汤全方中剂量组297.01±7.28∗415.09±8.33∗∗211.98±24.71∗201.91±6.12∗石油醚部位低剂量组396.80±9.61233.43±4.12∗244.92±5.15∗178.54±5.18∗二氯甲烷部位中剂量组267.62±19.52∗279.65±4.28∗∗188.94±0.19∗∗179.17±12.28∗乙酸乙酯部位中剂量组363.46±14.00∗199.45±1.66∗∗∗224.27±7.46∗∗139.52±26.86水饱和正丁醇部位低剂量组380.52±6.40210.29±1.67∗∗289.98±2.88138.85±10.26
注:与空白组比较#P<0.05,###P<0.001;与模型组比较*P<0.05,**P<0.01,***P<0.001。
4 讨论
果蝇睡眠与哺乳动物的睡眠具有很多相同的基本特征[13],且具有繁殖周期短、易于饲养等作为模式生物的独特优势[18]。本实验采用果蝇监测装置,研究百合地黄汤全方及不同萃取部位对果蝇睡眠的改善作用。结果表明,百合地黄汤全方低、中、高剂量组、石油醚部位低剂量组、二氯甲烷部位中剂量组、乙酸乙酯部位中剂量组和水饱和正丁醇部位低剂量组果蝇的总睡眠时间明显延长;其中,百合地黄汤全方中剂量组和石油醚部位低剂量组果蝇的白天睡眠时间延长,夜间睡眠时间未见明显变化,二氯甲烷部位中剂量组、乙酸乙酯部位中剂量组和水饱和正丁醇部位低剂量组果蝇的夜间睡眠时间明显延长(P<0.05),据此推测百合地黄汤各有效部位治疗失眠的作用机制可能并不完全相同。
研究表明[19],DA、HVA、5-HT和5-HIAA等单胺类神经递质对于睡眠的调节具有关键的作用。其中,5-HT是促进睡眠的神经递质[20-22],主要分布于大脑皮层和神经突触[23],5-HIAA是5-HT的代谢终产物,故脑内5-HIAA的含量可间接地反映5-HT的含量变化[24]。DA是一种兴奋性递质,其浓度升高可导致失眠[25-26],HVA是DA的代谢终产物,HVA含量与DA含量呈正相关,脑内HVA含量可间接反映DA的含量变化[27-28]。本实验对各有效部位镇静催眠作用进行研究,结果表明,与模型组比较,阳性药组果蝇脑部的DA含量明显降低(P<0.05),5-HT含量明显升高(P<0.05),5-HIAA和HVA含量无明显变化;百合地黄汤全方中剂量组和二氯甲烷部位中剂量组果蝇脑部的DA和HVA含量明显降低(P<0.05),5-HT和5-HIAA的含量明显升高(P<0.05);石油醚部位低剂量组果蝇脑部的DA含量有降低趋势,但无明显差异,5-HT和5-HIAA的含量明显升高(P<0.05);乙酸乙酯部位中剂量组果蝇脑部的DA和HVA含量明显降低(P<0.05),5-HT的含量有升高趋势,但无明显差异;水饱和正丁醇部位组果蝇脑部的DA有降低趋势,5-HT的含量有升高趋势,但无明显差异。
本实验已筛选出百合地黄汤镇静催眠的有效部位,各有效部位发挥其治疗失眠的作用可能与调节果蝇脑部单胺类神经递质的含量相关,但其治疗失眠的作用机制尚不明确,本课题组将针对该问题进一步研究。
