荧光法快速测定水中粪大肠菌群
2019-05-15由希华李恒庆宗雪梅
由希华,徐 标,李恒庆,宗雪梅
山东省环境监测中心站,山东 济南 250101
粪大肠菌群,是指一群能在(44.5±0.5)℃ 温度下生长,发酵乳糖、产酸产气、需氧和兼性厌氧的革兰氏阴性无芽孢杆菌,国外又称耐热大肠菌群。主要来源于人畜粪便,可导致肠道传染病传播[1]。水源水一旦被粪便污染,就存在肠道病原菌污染引起肠道传染病甚至流行病的可能。因此,粪大肠菌群的检测可准确及时地监控水源水受粪便污染的状况,为相关部门有效预报和控制流行疾病的发生与传播提供重要依据。
目前,国内外粪大肠菌群的检测方法可分为多管发酵法、快速纸片法、滤膜法、酶底物法、荧光原位杂交(FISH) 技术、PCR 技术等[1-3]。国内粪大肠菌群监测方法主要有滤膜法、多管发酵法,并且这2种方法均属于国标方法[4],被国内环境监测部门广泛采用。这2种方法分析成本低,结果较准确,但是操作繁琐,需专业人员严格控制无菌条件,操作时间长(至少需要48 h),并需要验证试验,不能快速对水的卫生状况作出评价[3],不适合应急现场监测。因此,采用更为快速、简便、精确的监测方法显得尤为重要。荧光法可以弥补传统方法的不足,无需专业技术人员和严格无菌条件,无需验证试验。荧光法操作简单,一般人员经过简单培训即可在现场完成操作,并且测定范围广,无需稀释,测定范围可达108MPN/100 mL,消除了人为带入的误差。全自动微生物监测仪可独立自动完成培养、测试、结果判读、发送报告等工作,故不受场地限制,可直接应用于现场监测。监测时间为动态时间,与待测样本中目标细菌的浓度有关,浓度越高,检测时间越短,最快可2 h内给出阳性测试报告,最长需要18 h。并可在第一时间将测试报告发送到指定邮箱,更适合应用于应急现场监测,做到早期预警,防止进一步危害的发生。
2010年,加拿大皇后大学研究人员和加拿大水质专家组成科研团队,提出使用聚合物光学传感器检测同类型微生物荧光指标的方法。该方法目前已经在全球十余个国家和地区得到广泛应用,并获得多个权威部门的认证,这些部门包括中国环境监测总站、中国疾病预防控制中心、美国环保署、AOAC协会、新西兰卫生部、菲律宾卫生部等。
1 实验部分
1.1 仪器设备及试剂
实验所用仪器和设备主要有微生物快速测定仪、培养箱、冰箱、高压蒸汽灭菌器、天平、采样瓶等。
实验试剂包括:粪大肠检测试剂套筒(以下简称FCA套筒)、乳糖蛋白胨培养液、EC培养基、伊红美蓝琼脂、硫代硫酸钠溶液、无菌水等。
1.2 反应原理
将一定量的水样与培养基混合均匀放置于44.5 ℃温度下培养,粪大肠菌群在选择性培养基上产生β-半乳糖苷酶,并分解荧光底物释放出荧光产物(疏水)。荧光产物逃离水样聚合至光学检测区,通过光度计测定,依据荧光强度与水中粪大肠菌群数成一定关系的原理,建立数学模型,从而得出粪大肠菌群的浓度。
1.3 实验方法
打开电源开关,设置添加样品,录入样品编号,选择TECTA-FCA-FC选项,点击“ADD”,设置完成。将注入100 mL水样的FCA套筒放入指定检测池。关闭上盖,仪器开始自动检测。当仪器检测到粪大肠菌群,自动检测停止,并报告检测数据。
2 结果与讨论
2.1 准确度的测定
微生物检测数据为偏态分布,按其统计分析要求,检测所得结果全部经对数(以10为底)转换后,再进行精密度与准确度的统计分析。
采用有证标准物质美国IDEXX粪大肠菌群标准菌株(NCTC 9001)验证方法准确性,标准菌株浓度为653MPN/100 mL(65~1 350MPN/100 mL)。
将无菌水加入FCA套筒中,并定容至100 mL。将标准菌株加入套筒中,盖紧上盖,摇匀。放入微生物检测仪中检测。
在6家实验室对标准菌株进行测定,每家实验室平行测定6次,测试结果见表1。

表1 标准菌株测试结果Table 1 Standard strain testing results MPN/L
对实验室数据进行汇总统计分析,计算实验室内相对误差,以计算荧光法的准确度。结果表明:6家实验室平行测定结果均在标准菌株浓度(65~1 350MPN/100 mL)误差范围内,实验室内相对误差为-2.75%~1.71%,准确度较高。
2.2 精密度测定
实验室精密度的研究需要采集高(4.6×107MPN/L)、中(4.6×105MPN/L)、低(4.6×103MPN/L)3个不同浓度水平实际水样进行测试,在6家实验室中每家实验室平行测定6次。
将待测水样加入FCA套筒中,并定容至100 mL。盖紧上盖,摇匀,放入微生物检测仪中检测,测试结果见表2~表7。

表2 1号实验室实际水样精密度测试数据Table 2 No.1 laboratory regular water sample precision test data
注:i为实验次数,S和RSD为原始数据以10为底,对数转化后计算所得,下同。

表3 2号实验室实际水样精密度测试数据Table 3 No.2 laboratory regular water sample precision test data
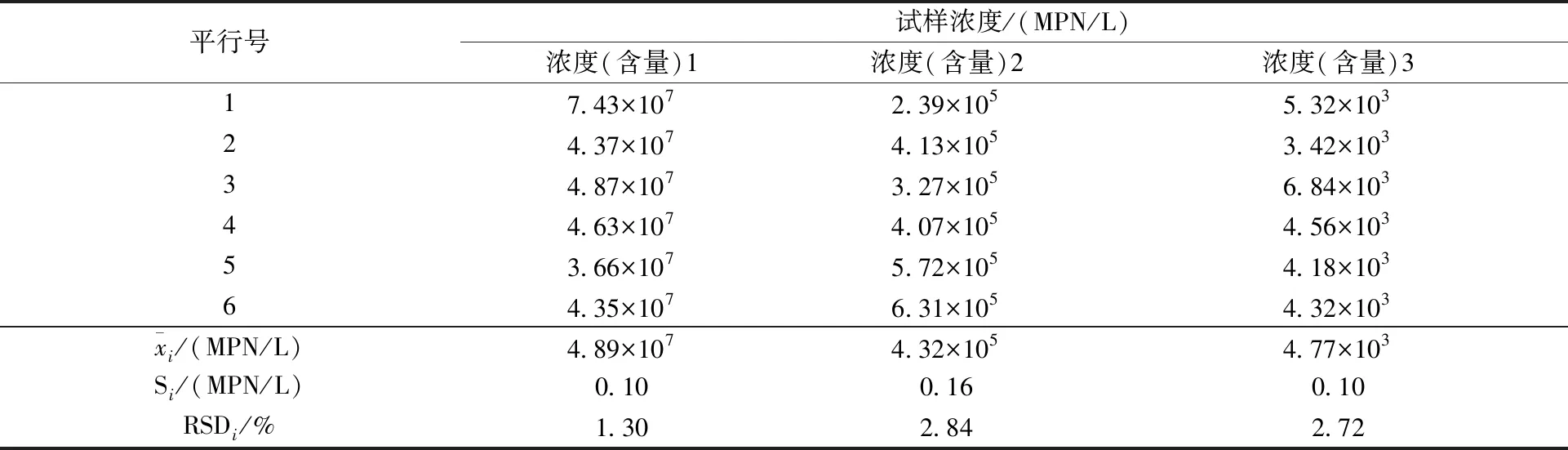
表4 3号实验室实际水样精密度测试数据Table 4 No.3 laboratory regular water sample precision test data

表5 4号实验室实际水样精密度测试数据Table 5 No.4 laboratory regular water sample precision test data

表6 5号实验室实际水样精密度测试数据Table 6 No.5 laboratory regular water sample precision test data

表7 6号实验室实际水样精密度测试数据Table 7 No.6 laboratory regular water sample precision test data
对实验室的数据进行汇总统计分析,计算实验室内精密度,以实验室内和实验室间相对偏差表示[5]。监测结果表明:6家实验室内的相对标准偏差范围分别为1.30%~3.93%、1.94%~4.72%、1.88%~4.54%,实验室间的相对标准偏差分别为1.14%、1.59%、1.72%,精密度较高。
2.3 荧光法与多管发酵法相关性实验
选择不同的地表水、废水样品进行荧光法与多管发酵法比对测试[6-9],讨论方法适用性。实验中采用38份地表水及污水水样进行粪大肠菌群的监测,多管发酵法所用培养基、试剂和测定方法参照《水质 粪大肠菌群的测定 多管发酵法和滤膜法(试行)》[4]的相关要求,荧光法操作步骤同上,荧光法和多管发酵法测粪大肠菌群的线性回归分析见图1。相关系数(r)为0.984 4,标准化系数为0.984,回归系数(B)为1.077,表明荧光法与多管发酵法结果之间有显著的线性相关关系。

图1 2种方法测定结果变化趋势Fig.1 The tendency chart of the ammonium determined by the methods
对2种方法检测的粪大肠菌群结果进行配对t检验[10-11],用来检验2种方法测定结果的差异性,统计结果表明,2种方法无显著差异。结果见表8。

表8 荧光法和多管发酵法t检验结果Table 8 Results of t test by fluorescence and multi-tube method
3 结论
精密度和准确度实验表明,荧光法测定粪大肠菌群具有较高精密度和准确度;荧光法和多管发酵法相关性实验表明,2种方法在测定结果一致性、相关性等方面没有显著差异,初步认为荧光法可应用于地表水和废水中粪大肠菌群的检测。
荧光法相比于传统多管发酵法具有明显优点,操作简单,监测时间短,可在现场直接监测,测定范围广,可同时测定多个样品,能快速判断水样的微生物污染状况,尤其适用于应急现场监测,可应用于地表水、废水中的粪大肠菌群检测。
