贝类中持久性有机污染物残留与检测技术研究进展
2019-05-15杜静黄会宫向红张秀珍
杜静,黄会,宫向红,张秀珍*
(1. 山东省海洋资源与环境研究院,山东省海洋生态修复重点实验室,山东 烟台264006; 2. 上海海洋大学食品学院,上海201606)
有机污染物,指进入并污染环境,导致环境的正常组成结构、状态和性质发生变化,最终直接或间接有害于生物生长、发育和繁殖的有机物质,广泛存在于水体、大气、土壤及生物体等环境中。自第二次世界大战以来,科学家已经确定了某些在环境中持续存在,并且能够通过食物链(网)积累,对海洋、人类及其他生物都有害的有机化学污染物,这些化学污染物被称为持久性有机污染物(persistent organic pollutants,POPs)[1],包括有机氯农药(organochlorine pesticide,OCPs)、多氯联苯(polychlorinated biphenyl,PCBs)以及多环芳烃(polycyclic aromatic hydrocarbon,PAHs)等。2015年中国农药类POPs废弃物总量约为4 059 ~ 6 093 t;含高浓度PCBs废物总量约50 000 t[2]。农药喷洒后,仅有30%左右作用于作物上,其余70%全部进入环境中[3]。残留在自然环境中的农药,不仅污染环境,还能通过食物链的富集作用[4]危害动植物。双壳类软体动物,对有机污染物具有较高的富集能力,且能够经过食物链产生生物放大作用[4],对人类、其他生物及自然环境产生危害,因而日益受到广泛关注。POPs已成为一个全球性问题,因此,阐明和量化POPs对动物和人体健康的影响具有重要意义。
1 POPs概况
1.1 POPs种类及来源
狭义上的POPs物质主要是指《关于持久性有机污染物的斯德哥尔摩公约》(又称国际POPs公约[5])所列物质。截至2017年5月,国际POPs公约共规制了29种POPs。2004年首批规制了12种,分别是艾氏剂(aldrin)、氯丹(chlordane)、狄氏剂(dieldrin)、异狄氏剂(endrin)、灭蚁灵(mirex)、七氯(heptachlor)、六氯苯/六氯代苯(hexachlorobenzene,HCB)、PCBs、毒杀芬(toxaphene)、滴滴涕(dichlorodiphenyl trichloroethane,DDT)、多氯代二苯并-二噁英(polychlorinated dibenzo-p-dioxins,PCDD)以及多氯代二苯并-呋喃(polychlorinated dibenzofurans,PCDF)。随着2009和2011年的两次增列,清单加入开蓬(chlordecone,十氯酮)、五氯苯(pentachlorobenzene,PeCB)、六溴联苯/六溴代二苯(hexabromobiphenyl)、甲型六氯环己烷/α-666(alpha hexachlorocyclohexane)、乙型六氯环己烷/β-666(beta hexachlorocyclohexane)、林丹(lindane)、商用五溴联苯醚(commercial pentabromodiphenyl ether tetrabromodiphenyl ether and pentabromodiphenyl ether,四溴联苯醚和五溴联苯醚)、商用八溴联苯醚(commercial octabromodiphenyl ether(hexabromodiphenyl ether and heptabromodiphenyl ether,六溴联苯醚和七溴联苯醚)、硫丹(technical endosulfan and its related isomers)以及全氟辛烷磺酸(perfluorooctane sulfonic acid,PFOS)及其盐和全氟辛基磺酰氟(perfluorooctane sulfonyl fluoride,PFOS-F)等11种。2013年增列六溴环十二烷(hexabromocyclododecanes,HBCDs)。2015年增列多氯化萘(polychlorinated naphthalene,PCNs)、六氯丁二烯(hexachlorobutadiene,HCBD)、五氯苯酚(pentachlorophenol,PCP)及其盐和酯。2017年5月份,公约增列十溴联苯醚(commercial decabromodiphenyl ether,c-decaBDE)和短链氯化石蜡(short chain chlorinated paraffins,SCCPs)等两种POPs。公约名单是开放性的,广义上POPs物质还包括一些具有POPs特性的其他物质,部分物质是目前公约正在审查的物质,如:四溴双酚A(tetrabromobisphenol A,TBBPA)、三氯杀螨醇(dicofol);十五氟辛酸(pentafluorooctanoic acid,PFOA,全氟辛酸)及其盐和PFOA相关化合物;全氟己烷磺酸(perfluorohexane sulfonic acid,PFHxS)及其盐类和PFHxS相关化合物[6];PAHs,包括萘(naphthalene,NAP)、苊(acenaphthene,ACE)、芴(fluorene,FLU)、蒽(anthracene,ACE)、菲(phenanthrene,PHE)、芘(pyrene,PYR)和屈(chrysene,CHR)等150余种化合物[7]。
29种POPs中共11种OCPs,这11种OCPs按作用性质看主要分为1种抗真菌剂HCB和10种杀虫剂。从结构性质看,10种杀虫剂主要分为以苯为原料,使用最早、应用最广的化学合成DDTs和六六六(hexachlorocyclohexane,HCH;benzene hexachloride,BHC)和以环戊二烯为原料的艾氏剂、氯丹、硫丹、狄氏剂、异狄氏剂、七氯、灭蚁灵和以松节油为原料合成的农药毒杀芬。化工产品类POPs主要是PCBs、多溴联苯(polybrominated biphenyls,PBBs)、多溴联苯醚(polybrominated diphenyl ethers,PBDEs)、HBCDs以及PFOS及其盐和PFOS-F;生产中无意产生的副产品类主要为PCDD和PCDF。相关OCPs[8-9]、PCBs[10-11]以及PAHs[12-13]等的研究较多。而关于TBBPA、PBDEs以及PFOS及其盐和PFOS-F等正日益引起高度关注。
1.2 POPs对贝类的毒性与危害
1.2.1 对生殖系统的影响
POPs可影响贝类生殖系统的正常功能。苗晶晶等[14]在研究中指出10 μg/L B[a]P处理10 d后,栉孔扇贝(Chlamysfarreri)的鳃丝结构和消化导管上皮结构损害严重,性腺结构破坏明显。Lehmann等[15]研究表明,PCBs暴露可导致河蚬(Orbiculafluminea)的性腺萎缩和氧化应激反应。
1.2.2 对内分泌系统的影响
对于内分泌系统,POPs的主要危害在于影响受体活动,导致贝的生理异常。Song等[16]研究发现,DDTs的代谢产物可导致雄性翡翠贻贝(Pernaviridis)渗透调节功能异常。Chen等[17]研究发现10 μg/L剂量的B[a]P可诱导马氏珠母贝(Pinctadamartensii)能量代谢紊乱,引起细胞损伤。Qiu等[18]的代谢反应试验结果表明,2,4′-DDT及其与B[a]P的混合物通过降低翡翠贻贝代谢产物精氨酸的表达,抑制牛磺酸的代谢,可诱导翡翠贻贝能量代谢和渗透调节紊乱。
1.2.3 对免疫系统的影响
对于免疫系统,POPs引起免疫功能失调。研究表明[19],POPs的存在会影响太平洋牡蛎(长牡蛎,Crassostreagigas)的防御反应,进而影响其抵抗传染病的能力。高质量浓度(10 μg/L)的B[a]P可引起马氏珠母贝免疫反应的异常[17]。蛋白质组学反应[18]显示,与单独的B[a]P处理相比,2,4′-DDT及其与B[a]P的混合物可诱导翡翠贻贝在氧化防御方面表现出更严重的紊乱。任加云等[20]研究发现,高质量浓度(10 μg/L)的PCBs可抑制栉孔扇贝的抗氧化酶活力,使扇贝机体出现明显的氧化损伤现象。
1.2.4 亚急性和急性毒性
POPs对贝类的毒性较高。通常在低质量浓度时γ-HCH即表现出毒性,按照急性吸入毒性分级标准[21],属于剧毒级。有研究表明,于16 μg/Lγ-HCH暴露15 d,即可引起太平洋牡蛎和浅沟蛤(Scrobiculariaplana)亚致死效应[22]。γ-HCH对太平洋牡蛎的急性毒性(12 dLC50)为2.22 mg/L[23]。PCBs对贝类具有较高毒性,尹翠玲等[10]的实验表明,急性毒性试验中PCBs对泥螺(Bullactaexarata)的96 hLD50值为92.7 mg/kg,无可见影响添加量为50 mg/kg。按照急性经口/皮毒性分类级别[21]判断,属于中/高毒级。
王琳等[11]的研究表明,B[a]P、PCB1254对栉孔扇贝幼贝单一染毒的LD50>10 mg/kg。Fathallah等[24]试验结果表明,黑暗和阳光条件下BaP的LC50值分别为34.53 μg/L和0.56 μg/L;阳光条件下BaP质量浓度为1 μg/L时菲律宾蛤仔(Ruditapesdecussatus)幼虫死亡率超过80%,BaP和PYR的质量浓度分别为5 μg/L和50 μg/L时蛤胚胎发育被完全抑制。谢嘉等[25]的研究表明PYR对马氏珠母贝D型面盘幼虫的发育和形态有显著影响,PYR暴露下12、24、36、48、72和84 h的LC50分别为309.43、110.39、67.31、56.28、43.50、40.17和33.87 μg/L。按照毒性分级[21],LC50<1 000 μg/L属于剧毒级,可见BaP和PYR对贝类毒性极强。
1.2.5 致突变
Martins等[26]对菲律宾蛤仔的研究表明,致癌性物质苯并荧蒽(B[b]F)和非致癌性物质PHE可诱导基因毒性,低质量浓度(沉积物250 ng/g,水<0.1 ng/L)下即使是非致癌物质的PHE也会对双壳类软体动物造成突变的危害。Di等[27]研究结果表明,56 μg/L BaP可导致紫贻贝(Mytilusgalloprovincialis)DNA链断裂和组织损伤,能够诱导肿瘤调节基因的表达。
POPs难以被化学降解和生物降解,易在沉积物及生物体内积累,在贝类及其生长环境中存留时间长,对贝类的生长存在有害影响,并能通过食物链对人类健康产生重大危害。
2 贝类中POPs残留检测技术
贝类有机污染物残留水平低,一般为μg/kg级,且基质复杂,因此对检测方法有较高要求,需要更灵敏、快捷的定性定量分析方法。目前国内对于POPs的检测以土壤[28]、沉积物[29]和水[30]等环境样品,乳品等食品[31-32],以及中药[33]等样品居多。水产品中以鱼类[34]居多,针对贝类中POPs的检测研究相对较少,且大多集中在OCPs类(如DDT、PCBs等)。
2.1 前处理方法
样品前处理方法优化指为提高有机污染物残留检测方法的准确度、灵敏度和回收率等,对含有目标分析物的样品进行目标物的提取、净化等预处理步骤。目前检测贝类体内几种POPs的前处理方法中,超声提取是最常见的提取方法,回收率通常在60.0%~118.0%,可满足检测需求。超声提取法具有操作简便、时间短和能耗低等优点,孙秀梅等[35]采用超声萃取法和固相萃取(SPE)结合,检测贻贝(Mytilusedulis)中的PCBs和OCPs残留,加标回收率为75%~115%。
目前净化方法主要采用液液萃取法(LLE)、SPE、基质分散固相萃取法(MSPD,也称QuEChERS法)、磺化法和凝胶渗透色谱法(GPC)等。QuEChERS法可以快速将待测物从复杂基质中分离出来,具有简单、高效和准确等优点,适用于各种分子结构的药物和多药物残留的提取净化。常用作SPE净化填料的有石墨化碳黑、弗罗里硅土、氧化铝以及活化硅胶等,其中弗罗里硅土用于检测含氯农药和PCBs较多。邹琴等[36]采用超声法提取和磺化法净化,检测牡蛎中的PCBs残留,前处理操作简单,回收率在82.0%~97.1%,净化比较充分。GPC自动化程度高,用于OCPS等有机污染物残留分析的前处理,具有高效、便捷、环境污染少、去除脂肪和色素效果好等优点。方杰等[37]利用GPC和铝硅胶柱,建立了可同时检测贻贝中的OCPs、PCBs和PAHs的实验室多残留前处理分析方法。
2.2 检测方法
色谱和色谱质谱联用技术是目前POPs检测的主要技术。气相色谱(GC)法是以气体为流动相的色谱法,根据固定相的状态分为气固色谱法和气液色谱法。气固色谱法用分子筛、硅胶、活性炭等做固定相,适于分析化学性质稳定的气体及C1~C4烃类气体;气液色谱法使用蒸汽压低、热稳定性好且在操作温度下呈液态的有机化合物做固定液,涂敷在惰性载体或毛细管内壁上作为固定相,适于易挥发且不发生分解的化合物的分离与分析。气相色谱法具有分离高效、选择性好、灵敏度高、分析快速和应用范围广等优点。GC通常配有高灵敏度的检测器,如氢火焰离子化检测器(FID)、电子捕获检测器(ECD)、火焰光度检测器(FPD)等,可检出低达10-11~10-13g的样品组分,适合于环境样品中痕量有毒物质的测定。ECD对电负性物质有较高的响应值,GC-ECD灵敏度高,选择性好且价格低廉,广泛应用于样品中痕量OCPs、PCBs及PFOS等的分析。气相色谱与质谱联用(GC-MS或GC-MS/MS)技术兼具了色谱仪的高度分离性能和质谱仪的高度灵敏的定性能力,克服了GC定性的局限性,可进行复杂混合化合物的定性定量分析,已成为痕量POPs检测中的常用方法。降升平等[38]采用GC-MS测定5种贝类[广大扁玉螺(Neveritareiniana)、红螺(RapanabezonaLinnaeus)、毛蚶(Scapharcasubcrenata)、四角蛤蜊(Mactraveneriformis)和牡蛎]中的10种PAHs,方法检出限为0.10~0.61 μg/kg,加标回收率为63.1%~98.1%,相对标准偏差为3.9%~15.2%,方法线性关系良好。目前主要用GC-MS技术分析测定PBDEs,高分辨的磁质谱和低分辨的四级杆质谱[39]如气相色谱-负离子化学源/质谱法(GC-NCI-MS)[40-41]等,在鱼贝类水产品及环境样品PBDEs的分析中都得到了广泛应用,常用的检测方法还有GC-ICP-MS[42]、HPLC[43]和HPLC-ICP-MS[44]检测法。马新东等[45]采用GC-NCI/MS检测法分析海洋贝类生物体样品中的PBDEs,方法检出限为1.0~3.0 μg/kg。马玉等[46]将GC-NCI/MS应用于分析贝类样品中5种PBDEs及5种多溴联苯(polybrominated biphenyls,PBBs)残留,方法检测限均低于0.20 μg/kg。
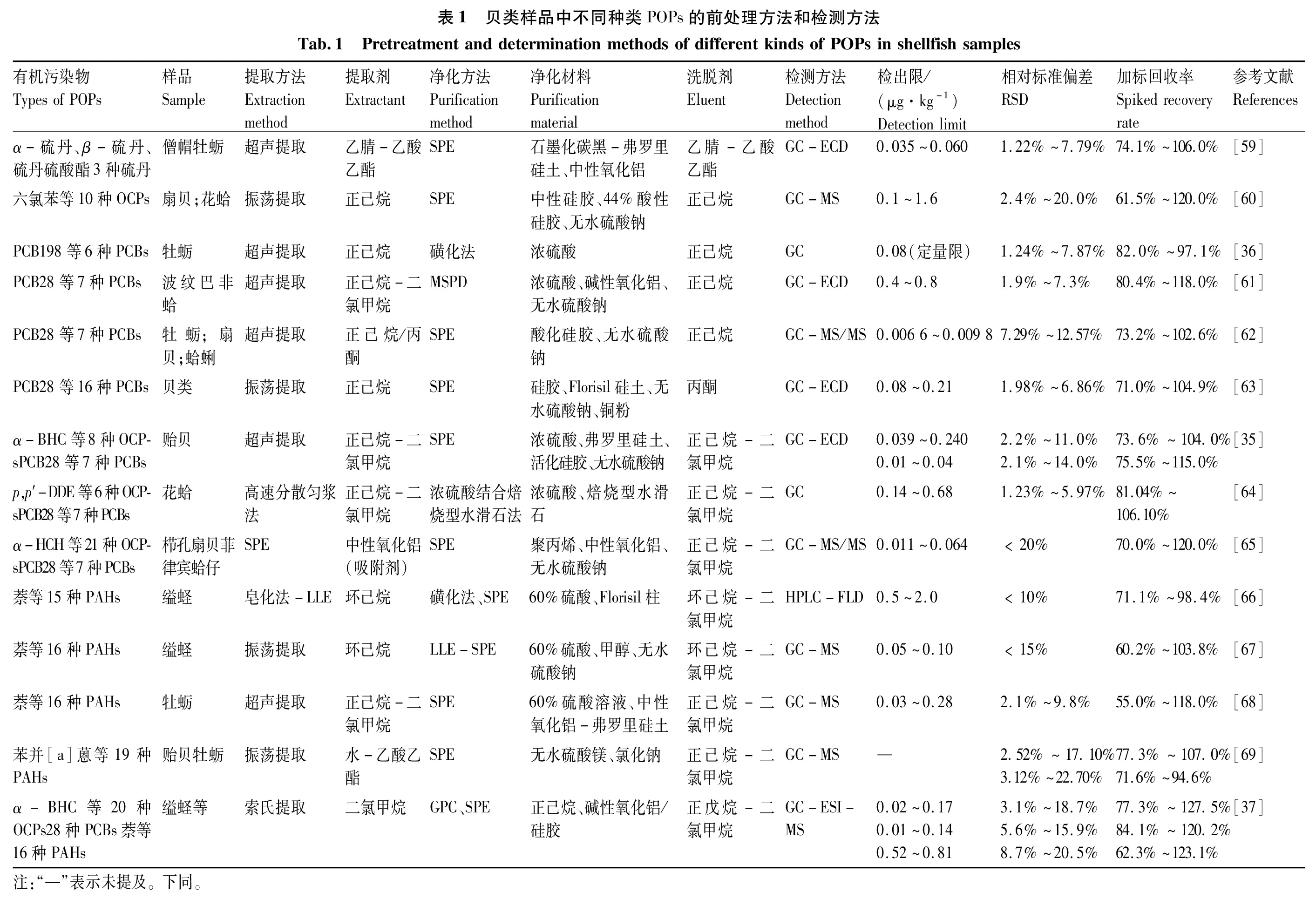
液相色谱(LC)作为GC-MS的补充,对于高沸点、高分子量,尤其是同分异构体的PAHs的分析是不错的方法,可以测定高沸点、弱热稳定性等不宜用气相色谱法测定的大分子量的化合物。海洋沉积物及海洋贝类中的一些有毒有机污染物,如PAHs[47-48]以及氟化合物等,都可以用HPLC进行快速、灵敏的分析测定。液相色谱-三重四级杆串联质谱法是目前文献报道中使用最为广泛的一种全氟类化合物定量检测方法[49-51],可定量检测环境基质中的全氟化合物(perfluorinated compounds,PFCs)。使用GC-MS方法测定TBBPA,需要先进行衍生化;使用LC-MS测定TBBPA,不需要进行衍生化。与单级质谱相比,串联质谱可提供被检测化合物的结构信息,分离模式多,且选择性好、灵敏度高,检测限低至ng/mL浓度水平[52],已有多项研究采用LC-MS/MS方法对贝类中的TPPBA进行定性定量的检测[53-56]。有报道[57]使用UPLC-MS/MS进行人乳和血清中TBBPA的检测,更先进的UPLC-MS/MS技术不但继承了LC-MS/MS技术的所有优点,还因采用了1.7 μm小颗粒固定相,大大缩短了待测物分析时间,提高了分析效率及检测灵敏度[58]。表1总结了研究者们对贝类样品中不同种类POPs的前处理方法及检测方法。
3 POPs污染状况
3.1 海洋环境中POPs污染状况
POPs具有疏水亲脂特性,因此水体中的POPs通常以吸附于悬浮固体颗粒的状态存在,并可沉降进入水体和沉积物。POPs不易降解,在水中溶解度低,存在时间长,如HCH、DDT等POPs,尽管已经多年不使用,但其残留物仍能在世界各地海域的海水和沉积物中被检测到。
3.1.1 国内表层海水中POPs污染状况
在国内表层海水中,POPs的残留水平一般在ng/L~μg/L范围内不等,处于低至中等的污染水平。周涛等[70]检测结果表明,南中国海的表层海水中OCPs和PCBs类化合物的质量浓度范围分别为n.d.(未检出)~92.3 ng/L和1.16~76.24 ng/L,两类化合物各检出6种(β-HCH、γ-HCH、δ-HCH、p,p′-DDE、p,p′-DDT、o,p′-DDT、PCB28、PCB101、PCB118、PCB138、PCB153和PCB180)。Guan等[71]对8条珠江入海支流的水样中17种PBDEs同系物进行了分析研究,发现其质量浓度水平范围在0.34~68.00 ng/L。PBDEs在水中的溶解度一般随溴原子个数的增加而减小,因此低溴代PBDEs在海水中检出率显著高于高溴代PBDEs[72]。Li等[73]对浙江杨浦湾表层海水中14种PAHs的研究表明,Σ14PAHs的含量在冬季和夏季分别为582.82~1 208.30 ng/L和952.40~1 201.70 ng/L。王璟等[74]研究结果表明,渤海湾海域Σ17PAHs含量为82.6~181.8 ng/L,黄河口外海域为43.7~122.4 ng/L,与渤海其他海域如辽东湾、莱州湾相比污染程度较轻,但比中国其他海域如黄海、东海PAHs污染程度要重,与国外一些海域相比,居于中等水平。王泰等[75]检测结果表明,海河和渤海湾表层水中PCBs、HCHs和DDT的含量分别为0.06~5.29 μg/L、0.05~6.07 μg/L和n.d.~1.21 μg/L。张玉凤等[76]研究表明,辽东湾表层海水中16种美国国家环境保护总署(Environmental Protection Agency,EPA)优先控制的PAHs在5月和8月的平均含量分别为367.4 ng/L和138.2 ng/L,季节变化明显。
综上,表层海水中POPs残留在南北地域方面差异较为显著,南中国海表层水的OCPs和PCBs残留量要分别高于海河和渤海湾中OCPs和PCBs的残留量;PAHs残留量为杨浦湾>辽东湾>渤海湾>黄河口,与国际海域表层海水相比处于低至中等污染水平,从季节分布上看,部分海域PAHs残留量有春季较夏季高[76],夏季较冬季高[73]的趋势。
3.1.2 国内海域沉积物中POPs污染状况
在国内海域沉积物中,POPs检测出的含量在μg/kg级别。其中,PAHs残留量大部分[77-79]处于中度污染水平。杭州湾海域2011—2014年沉积物中16种PAHs处于中度污染水平,各年份平均含量及标准偏差分别为(116.03±15.26)、(106.59±13.90)、(129.05±14.37)和(106.10±10.43) μg/kg,PAHs高值区主要集中于长江口以及舟山海域附近,近岸区域高于远岸区域,远岸区有个别相对高值区[77]。胶州湾大沽河河口中Σ16PAHs的平均含量为239.41 μg/kg,根据沉积物中PAHs污染等级划分,属于中度污染水平[78]。
国内各海域表层沉积物中POPs的含量见表2。可以看出,相近年份自北向南,渤海、黄海和东海沉积物中Σ7PBDEs的含量逐渐增加。周鹏等[89]研究发现,东海表层沉积物中PBDEs分布呈现离海岸线由近及远含量越来越低,由北到南含量上升的趋势。张利飞等[100]研究表明,近年环渤海区域沉积物中的PBDEs含量呈上升趋势。与国内其他海域相比,珠江三角洲[82]海域表层沉积物中的ΣPBDEs残留属于高等污染水平,这可能与该海域采样点中电子工业密集有关,其中东江流经一个大型电子制造中心,珠江口贯穿人口密集城市,而顺德支流位于一个工业城镇,并毗邻电子垃圾场。
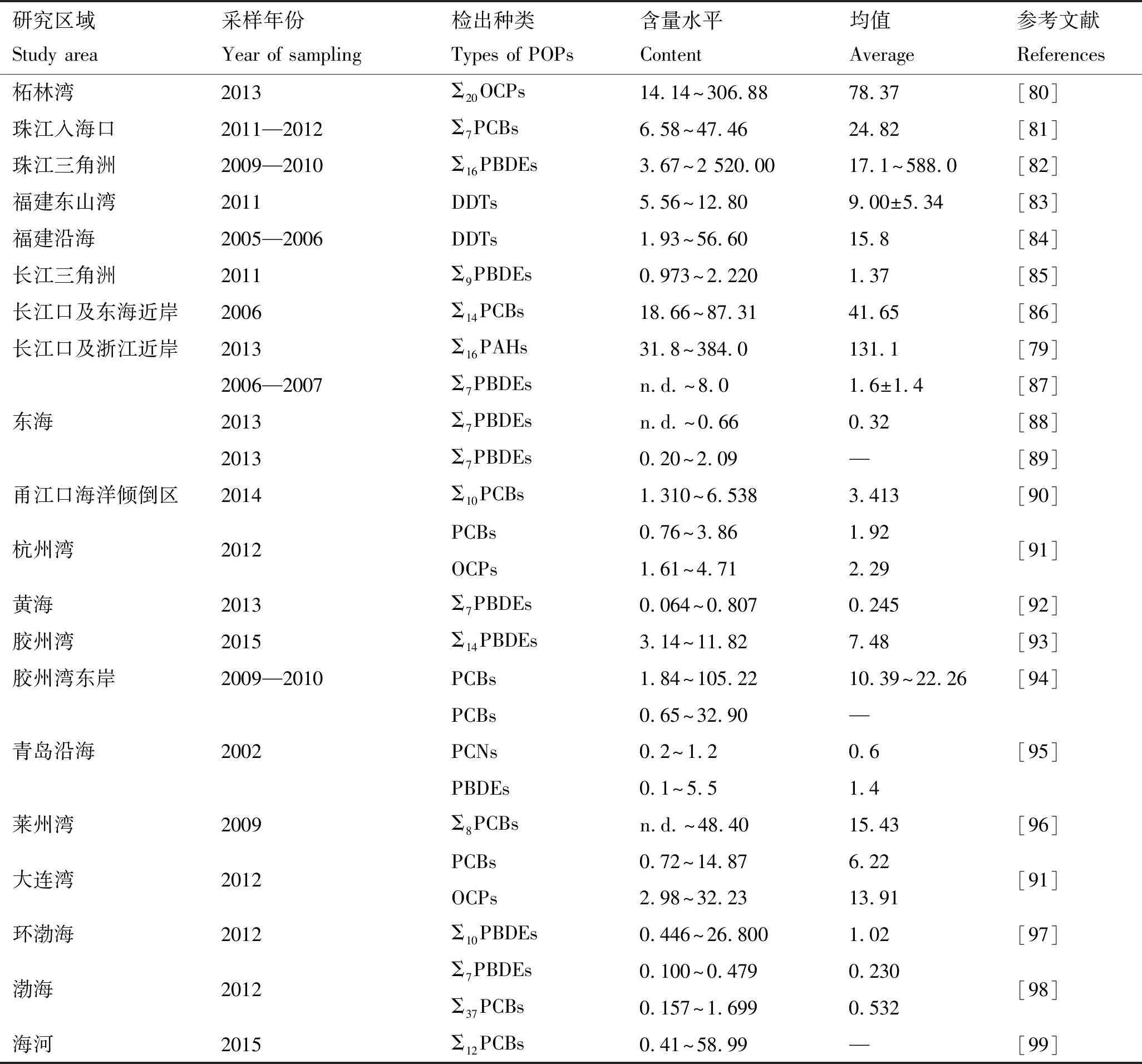
表2 国内各海域表层沉积物中POPs的含量Tab.2 Contents of POPs in surface sediments in different sea areas of China μg·kg-1
注:表中“n.d.”表示未检出。下同。
PCBs残留量在部分海域内部呈北高南低的趋势[96,99]。郭军辉等[96]研究发现,莱州湾东岸各调查海域表层沉积物含量是李村河>海泊河>石老人浴场,整体上呈现由北向南逐渐降低的趋势,各海域PCBs含量随季节的变化规律为夏季>秋季>冬季>春季。虽然近10年海域沉积物中PCBs残留量的研究中采样年份和PCBs同系物有差异,但通过比较发现,不同海域之间PCBs残留量污染水平在一定程度上为南高北低,与PBDEs的地域分布规律一致。其中,莱州湾沉积物中PCBs残留量在北部海域中属于较高污染水平。
值得关注的是,研究表明,部分海域沉积物中有新的PBDEs或DDTs输入。姚文君等[97]研究结果表明,PBDEs含量在所检测站位之间存在显著差异,其中莱州湾和锦州附近区域的结果明显高于其他区域,表明该区域存在PBDEs的生产和使用,有新的PBDEs输入。卫亚宁等[80]研究表明,柘林湾沉积物中DDTs的含量在13.88~300.50 ng/g之间,均超出中国《海洋沉积物质量》标准中的最低值(10 ng/g),其中4个站位点均有新的DDTs输入。姚婷等[91]的测定结果表明,大连湾沉积物中DDTs有新的污染源输入。
3.1.3 国外表层海水和海域沉积物中POPs污染状况
国外部分海域表层海水中POPs的含量见表3。其中,关于表层海水中PAHs和PBDEs含量的报道较多,由表3可见,POPs分别在世界多个国家(阿根廷、法国、匈牙利、土耳其和韩国等)水域表层海水中均有检出,普遍处于ng/L级别。

表3 国外部分海域表层海水中POPs的含量Tab.3 Contents of POPs in surface water in some foreign sea areas ng·L-1
对于沉积物中的POPs,其中OCPs、PCBs和PAHs的报道较多。据报道[106],2008年东爱琴海岸沉积物中OCPs和PCBs的总含量范围分别为n.d.~17.8 和n.d.~26.1 ng/g(dw)。另有研究[107]报道,埃及沿海沉积物中DDTs和PCBs的含量范围分别为0.07~81.50 ng/g(dw),0.29~377.00 ng/g(dw)。研究表明,北波斯湾沉积物ΣPCBs和ΣPAHs的污染水平分别为(2.5±0.8)~(462.0±206.7) ng/g(dw)和55.3~1 231.6 ng/g(dw)[108]。意大利15个海洋保护区沉积物中Σ16PAHs含量水平为0.7~1 500.0 μg/kg,均值为(155.26±396.39) μg/kg[109]。多瑙河上游地区和莫逊多瑙河分支河流表层沉积物中Σ16PAHs残留量为8.3~1 202.5 ng/g(dw)[平均值为(170±227) ng/g(dw)(n=46)][103]。Malik等[110]分析了印度古姆蒂河的96个表层沉积物样品,研究发现,表层沉积物中Σ16PAHs含量为5.24~3 722.87 ng/g(dw)[平均值为(697.25±1 005.23) ng/g(dw)(n=48)]。
Kim等[105]检测到韩国光阳湾沉积物中PBDEs的含量范围为1.16~43.60 ng/g(dw),PBDEs较高值出现在石化和钢铁工业园区附近的几个站点,表明工业活动可能导致海湾PBDEs的污染。Sudaryanto等[111]在2005年从流经老挝和泰国的湄公河的下游流域采集了沉积物,研究发现,PCBs和DDTs的含量范围分别为0.18~310.00 μg/kg和0.027~52.000 μg/kg,高于其他有机氯化合物(OCs),而氯丹化合物(CHL)、HCH和HCB的残留量则低1~3个数量级。Morales-caselles等[112]检测了加拿大萨利希海表层沉积物中POPs的残留量,检出的污染物含量排序为ΣPCBs>ΣPBDE>DDTs。
综上,国外海域沉积物中POPs残留量在ng/g级别。其中,埃及沿海沉积物中DDTs和PCBs的残留量远远高于的东爱琴海岸,北波斯湾沉积物ΣPCBs含量远远超过东爱琴海和埃及沿海中ΣPCBs的含量。
与国外海域沉积物相比,国内海域沉积物中PAHs残留处于中等污染水平;沉积物中PCBs残留量处于低至中等污染水平;在国内海域沉积物PBDEs残留的研究中,除Chen等[82]研究的珠江三角洲海域外,其他海域中PBDEs残留与国外海域相比均处于低至中等污染水平。
3.2 贝类中POPs残留富集状况
双壳贝类营滤食性生活,代谢率低,对海洋有机污染物具有很强的生物富集作用,生物富集系数(亦称生物富集因子,bioconcentration factor, BCF)/生物积累系数(bioaccumulation factor,BAF)越大,表明生物体从周围环境中富集/积累某种化合物的能力越强,即这种化合物在有机体内浓度与周围环境中浓度之比越高。在颗粒相和溶解相中的PAHs经过呼吸和滤水最终富集于双壳贝类体内,分子质量小、水溶性好的PAHs(lg kow>4)通过穿过细胞膜进入贝类组织;而分子质量大、与颗粒易结合的PAHs(lg kow>6),则以颗粒过滤的方式摄入贝类消化器官;lg kow介于两者之间的PAHs可通过以上两种途径,进入贝类体内。理论上,PAHs组分的Kow越高,其在生物体中积累得就越多,BAF也相应增大。聂利红等[113]研究表明,天津高沙岭潮间带底栖泥螺中ΣPAHs含量为1 712.1 ng/g,泥螺对沉积物中ΣPAHs富集系数为4.3,对沉积物中NAP、FLU、ANT和PHE这4种PAHs的富集系数分别为11.4、2.3、1.7和2.3。罗冬莲[114]研究结果表明福建漳江口僧帽牡蛎(Saccostreacucullata)和缢蛏(Sinonovaculaconstricta)体内DDTs富集因子分别为5 342和1 594。姚文君等[97]研究发现,5种不同的底栖生物对PBDEs均表现出一定的生物富集性,其中∑9PBDEs的BAF值按从大到小的顺序为菲律宾蛤仔(0.43~4.06,mean=1.19)>紫贻贝(0.34~2.86,mean=1.03)>四角蛤蜊(0.17~1.95,mean=0.82)>麻蛤(Scapharcasubcrenata)(0.13~2.33,mean=0.61)>牡蛎(0.09~1.20,mean=0.52)。
3.2.1 国内贝类中POPs残留状况
国内贝类中POPs的污染较为普遍。POPs残留量在不同品种间有显著差异,不同品种贝类对POPs的富集能力不同[80]。周明莹等[115]研究发现,栉孔扇贝对OCPs的富集能力尤为显著,DDTs平均残留量为69.4~123.1 μg/kg,菲律宾蛤仔和竹蛏(Solenstrictus)中OCPs残留量低。余颖等[116]研究发现,僧帽牡蛎、缢蛏和波纹巴非蛤(Paphiaundulata)对PCBs的富集能力最高,泥蚶(Tegillarcagranosa)和华贵栉孔扇贝(Chlamysnobilis)次之,菲律宾蛤仔和杂色鲍(Haliotisdiversicolor)富集能力最低。
有研究在对PBDEs的含量分析中发现,不同贝类对其的富集能力不同。夏斌等[117]对胶州湾养殖区贝类中的PBDEs含量进行分析,菲律宾蛤仔、长牡蛎和栉孔扇贝样品中Σ9PBDEs的含量分别为(422.2~512.6)×10-12(dw)、(957.0~1 102.7)×10-12(dw)和979.5×10-12(dw),同一采样点3种贝类体内Σ9PBDEs的含量比较,栉孔扇贝中Σ9PBDEs平均含量最高,富集PBDEs的能力强弱为:菲律宾蛤仔<长牡蛎<栉孔扇贝,可能与3种贝类对PBDEs的吸收和代谢能力的差异有关,同时发现位于海泊河口处的贝类主要由于受到海泊河工业污水的影响,生物体中PBDEs的含量较其他地区高,建议调查PBDEs污染时,可对该地区进行关注。马新东等[118]用GC-NCI-MS法对采自大连的贝类中PBDEs的质量分数进行检测,5种贝类体内Σ7PBDEs的含量比较:紫贻贝(352.80 pg/g)<毛蚶(628.13 pg/g)<四角蛤蜊(644.99 pg/g)<菲律宾蛤仔(1 159.34 pg/g)<牡蛎(1 189.44 pg/g)。
全氟化合物在贝类中的残留富集情况同样与贝的种类有关。潘媛媛等[119]以HPLC-MS/MS方法测定了2个贝类样品(毛蚶和文蛤)中的9种全氟化合物,文蛤中仅发现痕量的PFOS(0.22 ng/g),而在毛蚶中发现较低含量的PFOA(2.18 ng/g)及PFHxS(0.19 ng/g)。Pan等[120]对渤海沿海海域的11种软体动物进行PFOS、PFOA等9种全氟化合物检测,PFOA为最主要污染物,PFOA平均含量较高的4种贝类依次为文蛤(12.2 ng/g)<毛蚶(15.0 ng/g)<黄蚬(CorbiculaaureaHeude)(31.3 ng/g)(dw)。可以发现,毛蚶对PFOA的富集能力较文蛤强。
国内部分海域贝类中POPs的含量见表4。
贝类对DDTs的富集能力明显高于HCHs和PCBs。据报道[126],浙江沿岸海域经济贝类DDTs残留量平均值明显高于HCHs和PCBs,清江大桥海域2007年褶牡蛎(Crassostreaplicatula)、紫贻贝、菲律宾蛤仔、四角蛤蜊和泥蚶中HCHs的残留量为1.65 μg/kg,是2006年的14倍;在嵊泗及其他4个海域,2007年DDTs残留量比2006年分别增加了约9、10、10、11和6倍;PCBs残留量总体上呈下降趋势。另据文献[127]报道,浙南海域60.7%的贝类DDTs含量超《海洋生物质量》中的一类标准值(GB18421-2001)。
苏惠等[128]对中国部分沿海海域牡蛎体内的PAHs进行分析,研究发现,PAHs各组分中Phe的检出率最高,为27.4%。郑关超等[125]对环渤海养殖区贝类体内PAHs的调查结果与其一致,但Phe的检出率高达88.5%,表明环渤海养殖水产品中还存在一定的污染。
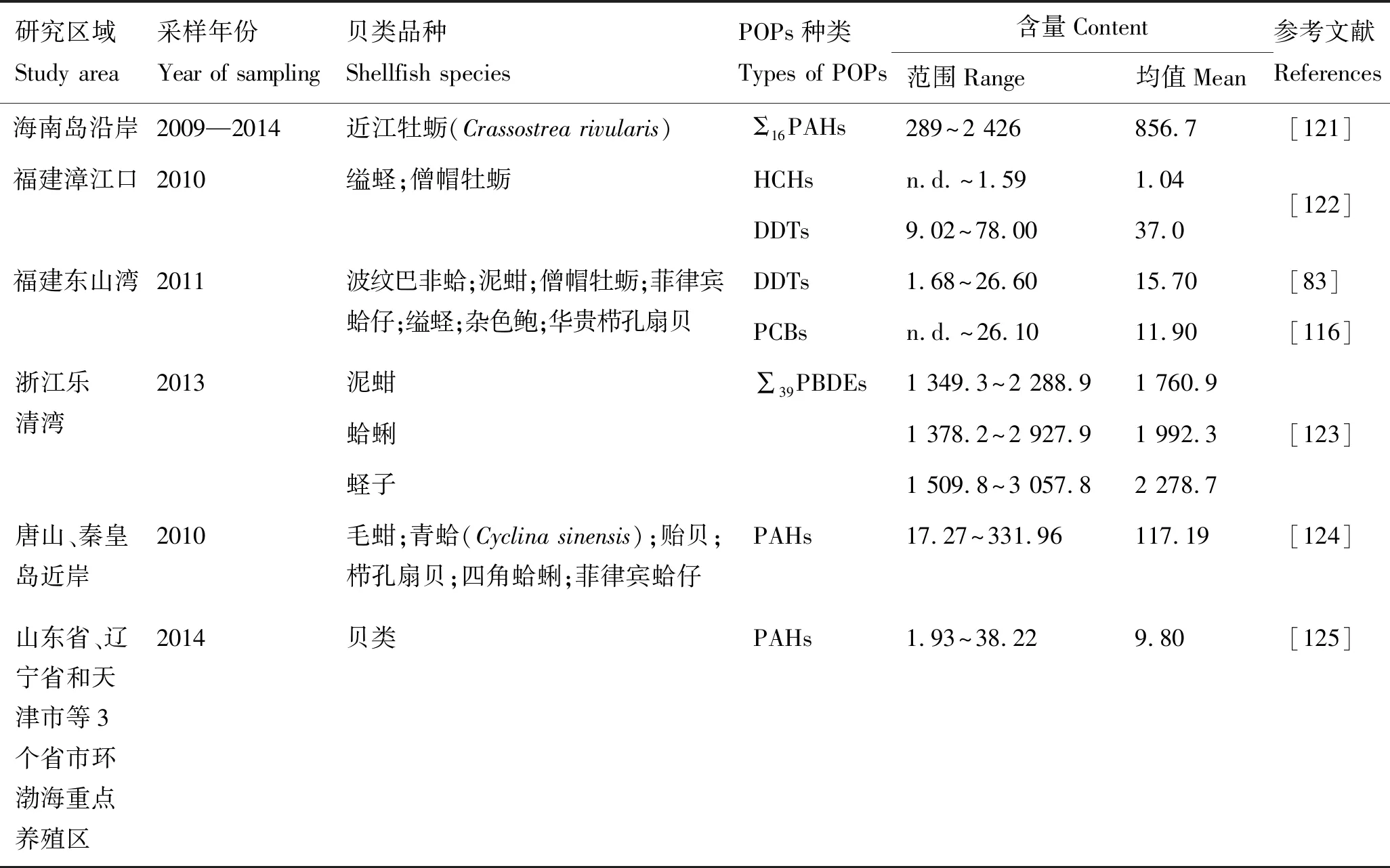
表4 国内部分海域贝类中POPs的含量Tab.4 Contents of POPs in shellfishes in some sea areas of China μg·kg-1
3.2.2 国外贝类中POPs残留状况
贝类对POPs具有生物富集作用,POPs浓度经由食物链浓缩,含量可被放大几十倍甚至上百倍。例如在美国长岛沿岸水域,浮游生物DDT的含量为0.04 μg/g,文蛤DDT的含量则增加到0.42 μg/g。国外部分海域贝类中POPs的含量见表5。
Subedi等[137]于1991—2005年从美国马萨诸塞州新贝德福德港(NBH)采集蓝贻贝样品进行了分析,研究发现,来自NBH上部和下部的贻贝的平均ΣPCB含量分别为942和182 μg/g(lw),并且以四氯联苯和五氯联苯同源物为主,共占ΣPCB含量的61%。ΣPBDEs的平均含量为277 ng/g(lw)。DDT是主要OCPs,平均含量为778 ng/g(lw)。1991—2005年间,ΣPBDEs、ΣPAHs和DDT的含量显著下降(r2≥0.56;p≤0.052),而PCBs和氯丹的含量未呈下降趋势(r2<0.50;p>0.076)。Francioni等[138]研究发现,瓜纳巴拉湾未受油污染地点的贻贝体内PAHs含量为100 μg/kg。将贻贝移植到受影响的地点,3个月后贻贝体内PAHs含量增加至300 μg/kg;而移植到未污染地区的贻贝体内PAHs含量则从380 μg/kg减少到80 μg/kg。
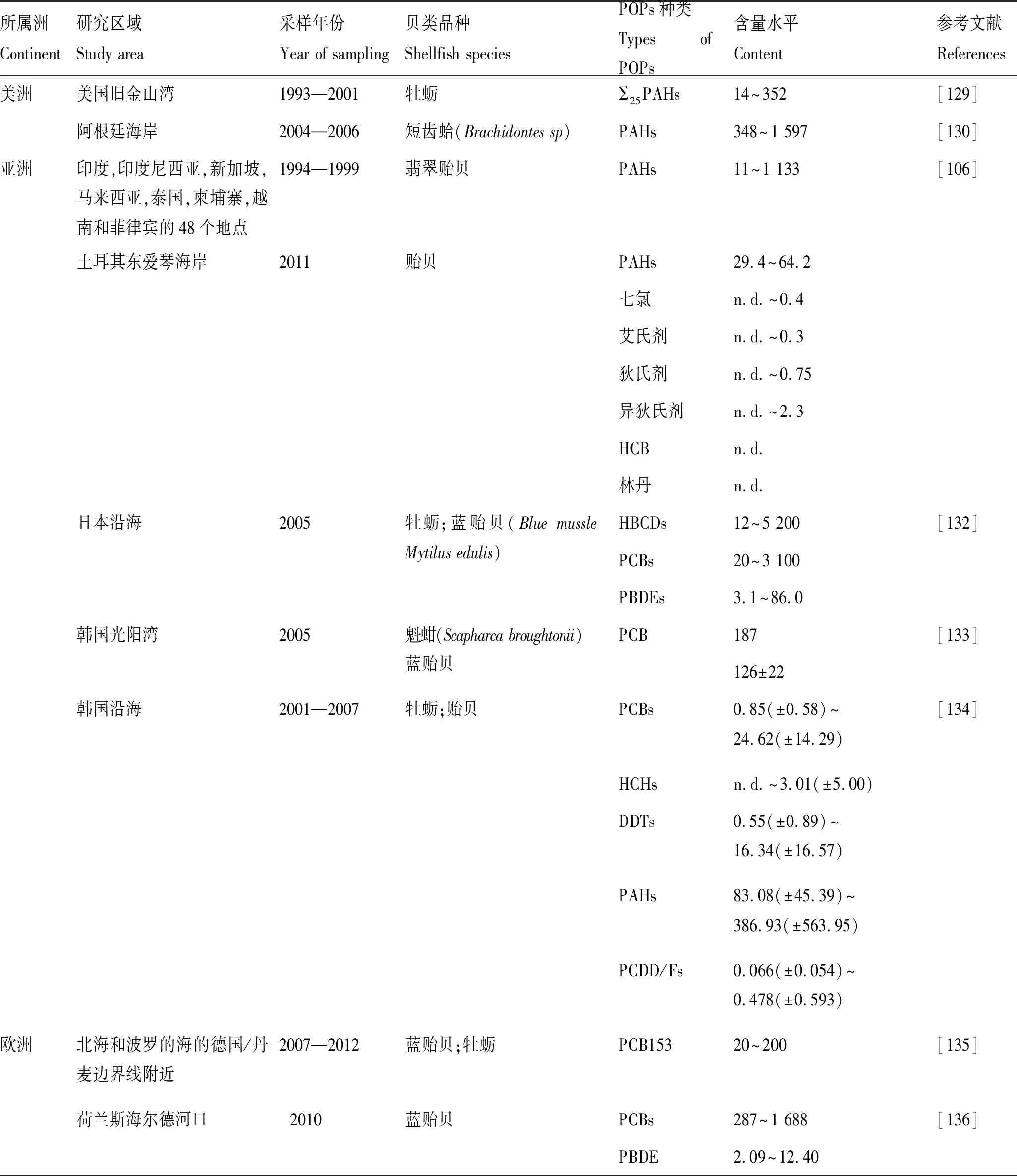
表5 国外部分海域贝类中POPs的含量Tab.5 Contents of POPs in shellfishes in some foreign sea areas μg·kg-1
亚洲范围内,Kaw等[141]在两项研究中分别发现从马来西亚收集的贻贝中PCBs的平均含量为56 ng/g和89 ng/g(lw),PBDEs的含量范围为0.84~16.00 ng/g(lw)。Habibullahalmamun[56]等通过HPLC-MS/MS方法检测到孟加拉国沿海地区贝类中PFOA含量为0.07~2.39 ng/g(ww),PFOS的含量为0.10~3.86 ng/g(ww)。Ueno等[132]检测到日本沿海牡蛎和贻贝样品中HBCDs含量范围为12~5 200 ng/g,>PCBs(20~3 100 ng/g)>PBDEs(3.1~86.0 ng/g),并通过海产品估计HBCDs和PBDEs的膳食暴露量分别为0.45~34.00 ng/(kg·d)和0.054~6.800 ng/(kg·d)。Gu等[142]在韩国水产养殖区采集牡蛎和贻贝,研究表明HBCDs在双壳类中含量为n.d.~67.52 ng/g(lw),与非水产养殖区相比,水产养殖区所有基质中的HBCDs和PBDEs含量显著提高(Mann-Whitney U检验,P<0.05),表明污染来源可能位于水产养殖区附近或与水产养殖区,不排除可能与工业园区和发泡聚苯乙烯浮标相关;BDE-47和α-HBCD的BCF分别为1.70×106L/kg 和1.05×106L/kg。
亚欧美地区研究结果比较可以发现,亚洲地区贝类中POPs含量一般要低于欧美地区贝类中POPs含量;综合国外研究结果并与国内研究结果比较发现,中国地区贝类中POPs含量处于中等水平。针对PFOS的可耐受每日摄入量(Tolerable Daily Intake,TDI),不同国家制定了不同的标准。2006年英国食品化学品毒性委员会(Commitment of Toxicant,COT)建议的PFOS TDI值为300 ng/(kg b.w.·d)[143],2008年欧盟食品安全局(European Food Safety Authority,EFSA)建议的PFOS TDI值为150 ng/(kg b.w.·d)[144],2012年德国联邦风险评估研究所(BfR)建议的PFOS TDI值为100 ng/(kg b.w.·d)[145]。Heo等[146]研究结果表明,韩国釜山贝类中PFOS平均含量为0.668 ng/g,与挪威[147]、荷兰[148]、瑞典[149]和西班牙[150]的贝类中的PFOS含量相似,对韩国成年人的每日PFOS摄入量估算值为0.47~3.03 ng/(kg b.w.·d),远远低于EFSA、COT和BfR建议的TDI值。
4 结论与展望
POPs具有难降解性、生物积累性和三致效应,其潜在的危害越来越引起人们的重视。中国目前已经进行了大量的POPs监测研究,但和国外的相关研究相比起步比较晚,对POPs的监测体系尚不完善。近年来,中国学者积极开展了大量的近海域环境及生物的POPs调查工作。国标方法分别规定了食品中PCBs、OCPs的测定方法,但操作繁琐,样品前处理技术相对落后,且目前尚未有针对食品中PCBs和OCPs多组分同时分析的标准方法。随着调查研究工作的深入开展,开发复杂样品基质中多种POPs组分的快速同时测定技术,进一步改进样品的分析检测过程,开发更加环保和高效的样品纯化方法,并结合更准确、灵敏的仪器分析技术,对食品中POPs检测技术尤其是标准方法的成熟和完善具有重要意义。
海洋贝类因味道鲜美、营养价值高,深受人们的喜爱。然而,贝类属于滤食性生物,对污染物具有较强的吸附累积能力。这些有害物质在贝类体内积累、残留,通过食物链的传递进入人体,危及人类的健康与安全。虽然HCH、DDT等OCPs已停止生产多年,但近年来的研究检测数据表明其在海洋环境中仍有不同程度的残留,且PCBs等POPs在某些海域中存在新的污染物输入源,因此,很长一段时间内仍然需要对POPs污染进行监测,完善贝类中残留POPs监测数据。
中国对于POPs的风险评估尚处于起步阶段,贝类体内POPs残留的风险评价研究更是缺少。开展海洋贝类中POPs污染的风险评价研究,评估POPs给人体健康带来的风险,逐步完善健康风险评价体系,可以更好地阐明和量化POPs对动物和人体健康的影响,为保障贝类食用安全提供依据,为中国更好地履行国际POPs公约及制定实施相应的污染控制和治理政策提供基础数据。
