麻痹性贝类毒素GTX1&4和GTX2&3标准样品的制备技术
2019-05-14郭萌萌彭吉星吴海燕郑关超姚琳翟毓秀谭志军
郭萌萌,彭吉星,吴海燕,郑关超,姚琳,翟毓秀,谭志军
(农业农村部水产品质量安全检测与评价重点实验室,中国水产科学研究院黄海水产研究所,山东 青岛 266071)
麻痹性贝类毒素(paralytic shellfish poisons,PSPs)是一类以石房蛤毒素为基本骨架,具有不同取代基的衍生化合物(分子结构见图1)[1],其被认为是危害最严重、分布最广的海洋生物毒素之一。根据PSPs 的化学结构特征,主要可分为4类化合物:氨基甲酸酯类毒素、N-磺酰胺甲酰基类毒素、脱氨甲酰基类毒素和脱氧脱氨甲酰基类毒素[2],根据R基团的不同,部分PSP的分类情况见表1。因PSPs属于高毒性的神经毒素,具不可预见性且在全球广泛分布,多次引发消费者中毒甚至死亡事件。因此,欧盟、美国、加拿大等多个国家或地区对其制定了严格的限量标准(800 μg STX eq./kg)并加以监控,PSPs已成为海产贝类国际贸易的主要限制对象[3]。毒素检测技术作为监控的必要手段,近年来得到了迅速发展,但很多检测方法因标准样品的匮乏而限制了应用范围。
贝类毒素标准样品的制备是保障贝类质量安全的基础。国际上,以加拿大国家海洋研究所为首的科研机构致力于贝类毒素有证标准物质的研发,目前已经建立了较为完善的贝类毒素分离纯化方法,并研制出20余种贝类毒素纯度标准物质[4],但由于对商业机密的保护,有关PSPs分离纯化的详细方法少有公开。近年来,中国已建立并完善了多种PSPs的检测方法,如小鼠生物法[5-7]、免疫分析法[8-10]、细胞毒性检测法[11-12]及理化分析方法[13-15]等。但这些方法均需要标准样品来定量和定性,同时需要质控样品对检测方法进行质量控制。目前中国市场中尚无自主研发的PSPs标准样品,在相关检测与科研工作中使用的PSPs标准样品均购自加拿大国家海洋研究所,不仅存在到货周期长、受出入境严格限制等问题,且无法保证运输过程中样品的稳定性,因而给PSPs的分析与检测工作带来很多困难。本研究以有毒贻贝为原料,制备了一种PSPs标准样品,该标准样品均匀、稳定、易稀释和储存,可作为标准溶液用于麻痹性贝类毒素的液相色谱-串联质谱法分析及质量控制,对确保食品安全及贝类产业的可持续发展具有积极意义。
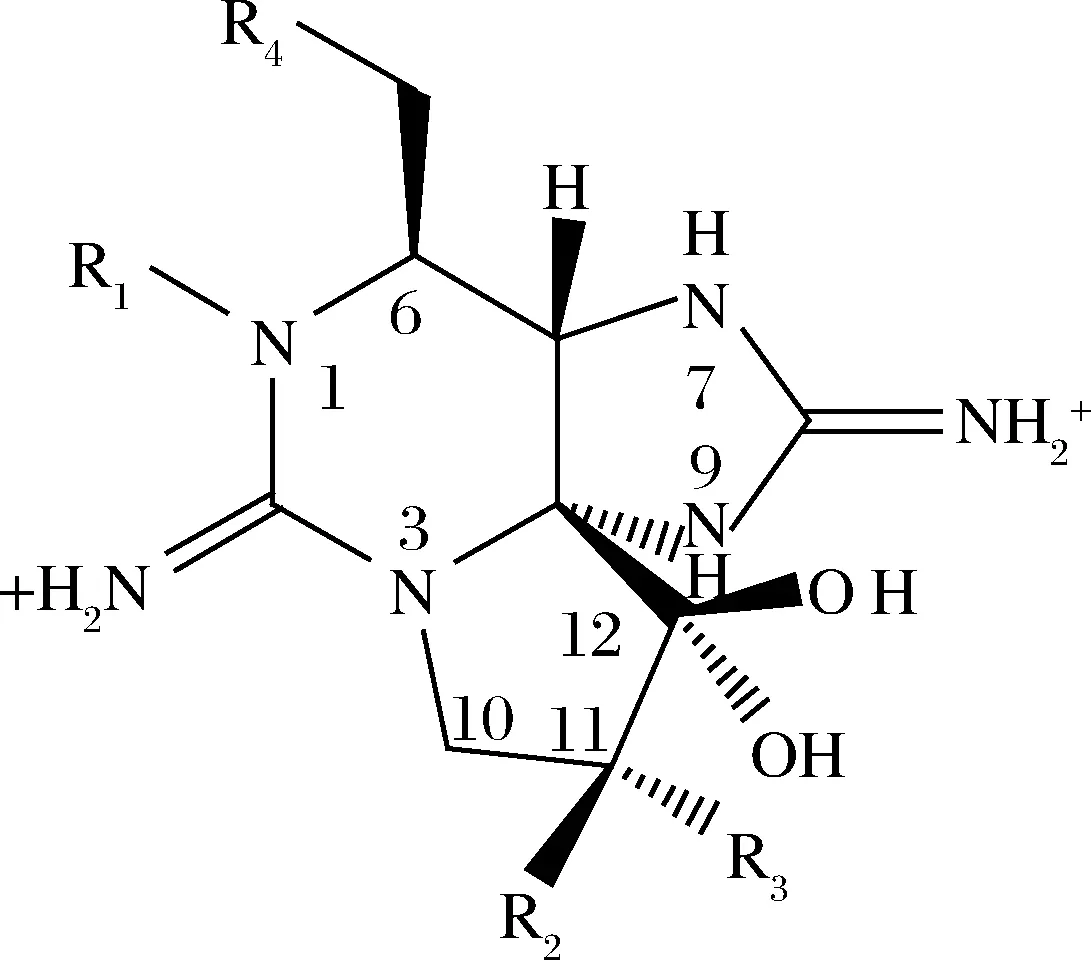
图1 麻痹性贝类毒素(PSPs)的分子结构[1]Fig.1 Molecular structure of paralytic shellfish poisons[1]
1 实验部分
1.1 仪器、试剂与材料
1.1.1 实验仪器
主要包括:AB 5500 QTRAP液相色谱-四极杆/离子阱复合质谱(美国AB SCIEX公司),配有电喷雾离子源(ESI);Q-Exactive四极杆-静电场轨道阱高分辨质谱系统及Dionex UltiMate 3000超高效液相色谱系统(美国Thermo Fisher公司);Waters e2695高效液相色谱仪,配有光电二极管阵列检测器;T18 basic均质机(德国IKA公司);XW-80A旋涡混合器(上海医大仪器厂); Himac CR 22GⅡ高速离心机(日立Hitachi公司);Milli-Q超纯水仪(美国Millipore公司);固相萃取装置(美国Supelco公司);恒温水浴锅(上海蓝凯仪器仪表有限公司);BSZ-100自动馏分收集器(上海沪西分析仪器厂有限公司);石墨化碳黑固相萃取柱(ENVI-CarbTM,250 mg/3 mL,美国Supelco公司);Sephadex LH20羟丙基葡聚糖凝胶(美国GE Healthcare公司)。
1.1.2 实验试剂
PSPs标准溶液购自于加拿大国家海洋研究所,其包括膝沟藻毒素GTX1>X4和GTX2>X3。甲醇、乙腈(HPLC级,美国Merk公司);甲酸、乙酸铵(HPLC级,瑞士Fluka公司);超纯水(18.2 MΩ. cm);其他未作特殊说明的试剂均为分析纯。

表1 麻痹性贝类毒素的分类Tab.1 The classification of paralyticshellfish poisons (PSPs)
1.1.3 实验材料
有毒贻贝(Mytilusedulis)样品于2017年4~7月份采自河北省秦皇岛某海域。用清水将贝壳外表洗净,切断闭壳肌,用蒸馏水淋洗,小心取出贝肉,勿切破贝体,在筛子上平铺沥水5 min,然后将贝肉采用组织均质器以12 000 r/min进行均质、混匀。
1.2 分析方法
参考文献[5]的方法,麻痹性贝类毒素标准样品的定值分析、均匀性检验和稳定性检验均采用液相色谱-串联质谱(LC-MS/MS)法。
液相色谱条件:TSK Amide-80(3 μm,2.0 mm×150.0 mm);柱温40 °C;流速0.35 mL/min;进样量10 μL。流动相A为水(含2 mmol/L甲酸铵,50 mmol/L甲酸),B为95%乙腈水溶液(含2 mmol/L甲酸铵,50 mmol/L甲酸)。洗脱梯度为0~3.0 min,20% A,80% B;3.1~5.0 min,20%~60% A,80%~40% B;5.1~10.0 min,60%A,40% B;10.1~11.0 min,60%~20% A,40%~80% B;11.1~13.0 min,20% A,80% B。
质谱条件:电喷雾离子源(ESI),多反应监测(MRM)负离子扫描模式;喷雾电压为-4.5 kV;离子源温度550 ℃;碰撞气压力Medium;气帘气压力30 psi;雾化气压力GS1为50 psi;辅助加热气压力GS2为50 psi。其他参数见表2。

表2 麻痹性贝类毒素的质谱参数Tab.2 The mass spectrometry parameters ofparalytic shellfish poisons (PSPs)
注:定量测定时选择子离子丰度较高且无干扰的子离子作为定量离子。
所有数据处理采用软件SPSS 19.0(美国IBM公司)进行统计分析。
1.3 标准样品的制备
1.3.1 提取
于每100 g贝肉中加入1%乙酸溶液100 mL,旋涡60 s,再置于100 ℃水浴加热5 min,超声提取10 min后于3 500 r/min离心5 min,取上清液至另一试剂瓶中,残渣继续加入100 mL提取剂重复上述步骤,合并上清液。每200 mL提取液分别用等体积正己烷和乙酸乙酯各萃取一次,取下层溶液于60 ℃水浴旋转蒸发至干。用5 mL 20%甲醇溶液(含0.1%乙酸)溶解残留物,获得毒素粗提溶液。
1.3.2 净化
毒素粗提溶液进一步用Sephadex LH20羟丙基葡聚糖凝胶柱进行净化,先取150 g Sephadex LH20用800 mL 20%甲醇溶液(含0.1%乙酸)活化过夜,然后取玻璃层析柱(5 cm×120 cm)用湿法装柱。将毒素粗提溶液于4 000 r/min离心5 min,取其上清液过凝胶柱进行层析净化。采用20%甲醇溶液(含0.1%甲酸)作为洗脱剂进行洗脱,自动馏分收集器收集馏分,设置每管收集时间为7 min,共收集100管。将每管收集液取500 μL过0.22 μm滤膜于进样小瓶中,进LC-MS/MS分析。收集含麻痹性贝类毒素组分的馏分,然后将其合并、40 ℃减压蒸馏浓缩近干,备用。
1.3.3 纯化
将1.3.2步骤收集的样品溶解于20 mL 20%乙腈溶液(含0.1%甲酸),采用配有光电二极管阵列检测器的液相色谱进行分离、纯化。采用TSK-GEL Hillic Amide-80色谱柱(4.6 mm×250.0 mm,5.0 μm);流动相A相为95%的乙腈水溶液(含0.1%甲酸),B相为水(含0.1%甲酸);柱温30 ℃;进样50 μL;流速1 mL/min。梯度洗脱:0~1 min,80%A,20%B;1~8 min,80%~40%A,20%~60%B;8~11 min,40%A,60%B;11~12 min,40%~80%A,60%~20%B;12~20 min,80%A,20%B,上述梯度洗脱为体积比。每针制备时间为20 min,根据目标物保留时间收集色谱峰,连续制备合并馏分,40 ℃减压蒸馏浓缩近干,用75%乙腈水(含0.25%甲酸)溶解并稀释至60 mL,备用。
1.4 定性分析
采用液相色谱-四极杆/离子阱复合质谱的提取离子谱图、二级碎片谱图与加拿大国家海洋研究所标准物质的多级质谱信息进行匹配,采用液相色谱-高分辨质谱仪测定精确质量数,通过两种方式进行定性确证。
1.5 定值分析
准确移取50 μL标准样品溶液,加入950 μL 75%乙腈水(含0.25%甲酸),充分混匀后进液相色谱-串联质谱测定。参照GB/T 15000.3—2008[16]标准要求,选择8家具有PSPs检测能力的实验室协同定值,每个实验室随机抽取3瓶标准样品采用1.2测定方法对样品进行定值分析。对各实验室的数据按大小顺序排列,进行Grubb’s和Cochran检验,如各实验室测试精度一致,则将总算术平均值作为毒素标准样品定值的结果。
1.6 均匀性检验
标准样品均匀性是指特性量值在空间分布的均匀程度,它是对标准样品总体空间分布的评价,是标准样品的重要质量指标之一。对同一批制备的麻痹性贝类毒素样品进行分装,每瓶标准样品溶液规格为0.5 mL,共100瓶。按照GB/T 15000.3—2008[10]规定,本研究随机抽取15瓶标准样品,每瓶样品重复测试3次,分析标准样品的毒素含量。所有试样以随机次序在重复性条件下测试,即在同一实验室中由相同人员使用相同测试方法和仪器在较短时间内测试。采用方差分析法进行差异性分析,得出均匀性结果。
1.7 稳定性检验
为了考察标准样品的长期稳定性,确定其有效期,取本标准样品模拟上市包装,在温度为4 ℃和-18 ℃的条件下进行稳定性试验。分别在第0、1、2、3和6个月时随机选取3个样品进行毒素测定。采用直线经验模型分析样品的稳定性,根据稳定性结果,确定标准样品的有效期。
2 结果与讨论
2.1 定性分析
采用液相色谱-四极杆/离子阱复合质谱测定的制备标准样品中毒素组分的提取离子色谱图,见图2,经液相色谱-高分辨质谱仪分析后获得的实验制备标准样品中毒素组分的精确质量数见图3。实验结果表明,制得的标准样品提取离子色谱峰的保留时间与标准溶液一致且二级碎片谱图匹配度大于90%,高分辨质谱实测精确质量数与理论值高度吻合(表3),两种检测方法均证明所分离的PSPs样品为膝沟藻毒素GTX 1&4和GTX 2&3,其中GTX1与GTX4,GTX2与GTX3互为同分异构体,是贝类体内富集较多的麻痹性贝类毒素[17]。
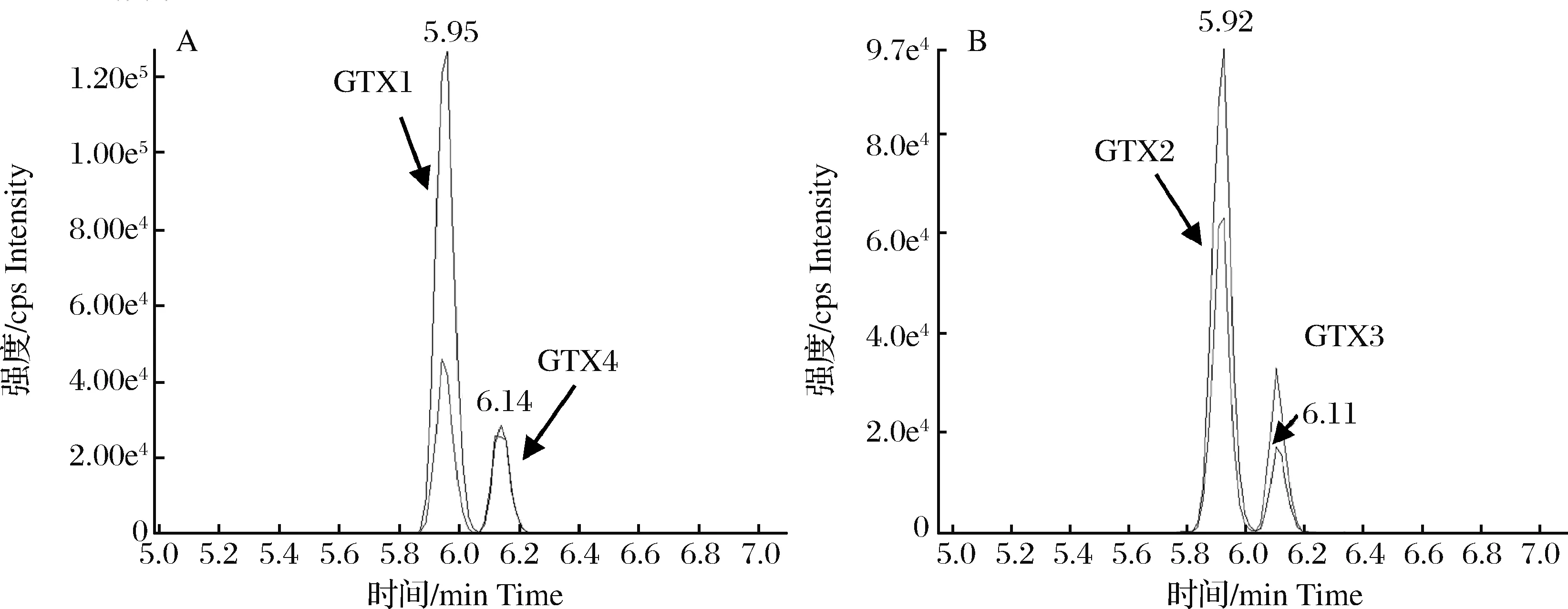
图2 PSPs制备样品中GTX1&4和GTX2&3的提取离子色谱图Fig.2 The extracted ion chromatograms of GTX1&4 and GTX2&3 in PSPs prepared sample

图3 PSPs制备样品中GTX1&4和GTX2&3高分辨质谱(high resolution mass spectrum, HRMS)图(1)GTX1的高分辨质谱图;(2)GTX4的高分辨质谱图;(3)GTX2的高分辨质谱图;(4)GTX3的高分辨质谱图。Fig.3 The HRMS spectra of GTX1&4 and GTX2&3 in PSPs prepared sample(1)The HRMS of GTX1; (2)The HRMS of GTX4;(3)The HRMS of GTX2; (4)The HRMS of GTX3.
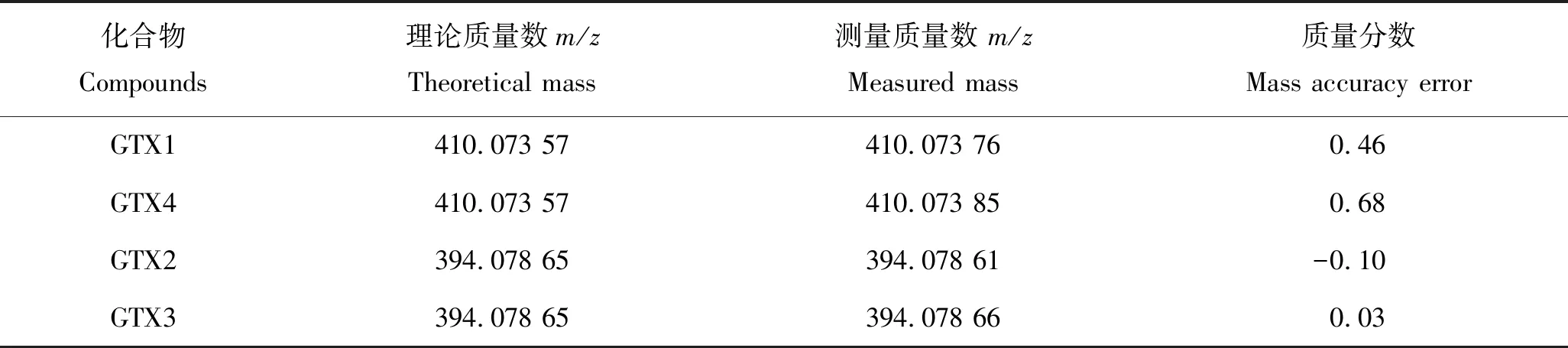
表3 PSPs制备样品的理论质量数、测量质量数和质量精度Tab.3 The theoretical mass, measured mass and mass accuracy error of prepared paralytic shellfish poisons (PSPs)
2.2 均匀性检验
研制的麻痹性贝类毒素标准样品的均匀性检验结果见表4,方差分析结果见表5。
F(0.05,14,30)=2.04,由表5可知,各组分的F值均小于F(0.05,14,30),说明在95%的置信区间,麻痹性贝类毒素标准样品均匀性良好。

表4 研制麻痹性贝类毒素标准样品的均匀性Tab.4 The homogeneity test results of paralytic shellfish poisons (PSPs) μg·L-1
2.3 稳定性检验
研制的麻痹性贝类毒素标准样品的稳定性测定结果及其直线模型分析结果分别见表6和表7。

表5 均匀性检验方差分析结果Tab.5 The variances results of homogeneity test

表6 研制麻痹性贝类毒素标准样品的稳定性Tab.6 The stability test results of paralytic shellfish poisons (PSPs) μg·L-1,n=1
表7 研制麻痹性贝类毒素样品稳定性的直线模型分析Tab.7 The linear model analysis results of paralytic shellfish poisons (PSPs) n=3
注:b1为截距;b0为斜率;s为标准偏差;s(b1)为与斜率相关的不确定度;95%置信水平下自由度为n-2的t因子t0.95,n-2=3.18。
由表7可知,各组分在4 ℃和-18 ℃条件下,|b1|均小于t0.95, n-2×s(b1),故拟合的直线斜率不显著,未监测到不稳定性,由此说明在4 ℃和-18 ℃条件下储存6个月,标准样品的稳定性良好。
2.4 定值结果
参照CNAS-CL04[18]的要求,本研究选择8家具有麻痹性贝类毒素检测能力的实验室进行协同定值。每个实验室随机抽取3瓶样品,采用上述1.2的统一测定方法对样品进行定值分析(表8)。采用Grubb’s法检验平均值,结果无异常值,计算结果的平均值及标准偏差。对结果的标准偏差进行Cochran检验,计算Cochran值(C)。

表8 研制麻痹性贝类毒素标准样品的定值结果Tab.8 The contents of paralytic shellfish poisons (PSPs)
式(1)
式(1)中:Si为各实验室测定结果的标准偏差;Smax为Si中的最大值;n为实验室数量。
由表8计算得到:GTX1的Cochran值为0.378,GTX4的Cochran值为0.282,GTX2的Cochran值为0.278,GTX3的Cochran值为0.208。查表得C8,3(0.05)=0.516,各组分测量的Cochran值均小于0.516,表明各实验室间的测量属于等精度测量,因此计算总算术平均值可作为最终的样品定值结果。总平均值为X(GTX1)=3 663 μg/L,X(GTX4)=1 147 μg/L,X(GTX2)=1 884 μg/L,X(GTX3)=797 μg/L。
2.5 定值结果的不确定度评定
标准样品定值结果的不确定度主要由标准样品定值过程引入的不确定度、均匀性检验引入的不确定度和稳定性检验引入的不确定度组成[19-20]。依据全部测定结果,计算麻痹性贝类毒素标准样品的合成标准不确定度及扩展不确定度。
1)标准样品定值实验引入的不确定度uX,按照加权法计算标准样品定值的不确定度为:
式(2)
经计算得到uX(GTX1)= 0.582,uX(GTX4)= 0.494,uX(GTX2)= 0.672,uX(GTX3)= 0.466。
2)均匀性检验引入的不确定度ubb,瓶间方差:
式(3)
式(3)中:MSamong为组间均方差,MSwithin为组内均方差,具体数值表5;n0为3。
均匀性检验引入的不确定度ubb=Sbb,经计算得到ubb(GTX1)=0.229,ubb(GTX4)=0.213,ubb(GTX2)=0.449,ubb(GTX3)=0.245。
3)稳定性检验引入的不确定度ults。由2.3稳定性检验试验可知,稳定性检验引入的不确定度:ults=s(b1) ×t,其中ults为不同温度引入的合成不确定度;t代表稳定性检验时间(月份)为6。
经计算ults(GTX1)=4.884,ults(GTX4)=4.919,ults(GTX2)=5.431,ults(GTX3)=5.911。
4)标准样品定值结果的不确定度:
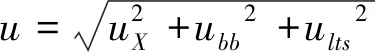
式(4)
则u(GTX1)= 4.924,u(GTX4)=4.948,u(GTX2)=5.491,u(GTX3)=5.934。
k=2时的扩展不确定度:urel=u×k。则urel(GTX1)=9.85,urel(GTX4)=9.90,urel(GTX2)= 10.98,urel(GTX3)=11.87。

表9 研制麻痹性贝类毒素标准样品中毒素含量的不确定度分量Tab.9 Uncertainty evaluation for paralytic shellfish poisons (PSPs)
本研究中定值数据及均匀性、稳定性引入的不确定度分析统计结果见表9。本标准样品中GTX1含量的特性值和扩展不确定度为(3 663±10)μg/L,k=2;GTX4含量的特性值和扩展不确定度为(1 147±10) μg/L,k=2;GTX2含量的特性值和扩展不确定度为(1 884±11)μg/L,k=2;GTX4含量的特性值和扩展不确定度为(797±12)μg/L,k=2。
3 结论
本研究以含毒贻贝为原料,经提取、浓缩及凝胶柱净化等步骤获得PSPs粗品,再采用高效液相色谱进行分离、纯化后制得麻痹性贝类毒素标准样品,此标准样品为GTX 1(3 663 μg/L)>X4(1 147 μg/L)和GTX 2(1 884 μg/L)>X3(797 μg/L)的混合溶液,溶剂为75%乙腈水(含0.25%甲酸)。通过对该标准样品进行均匀性检验、稳定性考察及多家实验室联合定值,结果表明,该标准样品的均匀性与稳定性良好,量值可靠。该标准样品能满足麻痹性贝类毒素化学检测方法中毒素质量分析的要求,可用于麻痹性贝类毒素的定性或定量检测、测试结果的质量控制及检测方法验证等,为中国贝类毒素标准样品的研发提供了技术储备,对提升中国突破国际技术壁垒的能力具有积极作用。
