2种乌贼雌激素相关受体基因的克隆与表达特性分析
2019-05-15庞赞张瑶刘立芹吕振明
庞赞,张瑶,刘立芹,吕振明
(海洋生物种质资源发掘利用国家地方联合实验室,海洋科学与技术学院,浙江海洋大学,浙江 舟山316022)
雌激素(estradiol, E2)是影响动物性腺分化、性成熟及生殖活动重要的性类固醇激素,在脊椎动物中,雌激素通过与雌激素受体(estrogen receptor,ER)相互作用来发挥其生物学功能[1]。在软体动物中,雌激素同样在生殖方面发挥着重要功能。如在真蛸(Octopusvulgaris)和砂海螂(Myaarenaria)的研究中发现,生物体内的雌激素浓度随生殖周期的转换而呈现出显著波动,暗示了其在生殖活动中的重要功能[2-3]。在虾夷扇贝(Mizuhopectenyessoensis)的研究中发现,体内雌激素注射可有效促进配子细胞的生成[4];在太平洋牡蛎(Crassostreagigas)的研究中发现,雌激素注射则可有效促进卵黄蛋白原的合成和配子的成熟[5]。然而,在软体动物中,雌激素则可能并非是通过与雌激素受体结合而发挥生物学功能。虽然在软体动物中也成功克隆得到了类似于脊椎动物的ER基因,但由于其蛋白高级结构与脊椎动物的ER相比发生了显著的变异,故而不能与雌激素或其他性类固醇激素结合而激活[6]。因此,在软体动物中,有关雌激素通过何种信号途径发挥其生物学功能的问题,目前还并不清楚。但近年来,在软体动物中一种与ER同源的雌激素相关受体(estrogen-related receptor,ERR)的发现,可能为探究雌激素的生物学功能及其作用机制提供了新的途径。
ERR是一类与ER有较高同源性的孤儿核受体,最早是由Giguere等[7]于1988年提出,是针对ER的DNA结合域(DNA binding domain, DBD)的保守序列,采用低严谨度杂交方法筛选得到的。目前在脊椎动物中主要发现了ERRα、ERRβ和ERRγ3个亚型[8],相关研究表明,ERR除参与骨骼发生、胚胎发育和能量代谢外,在脊椎动物生殖发育中同样起着重要的调控作用[9]。ERR基因在大鼠生殖系统中进行大量表达,其表达周期从生殖细胞开始一直维持到性别的分化,ERR的缺失能使生殖细胞的数量显著减少[10];相反,ERR的过表达可促进生殖系统性激素的大量分泌[11],暗示了ERR的生殖调控功能。然而ERR生物学功能的发挥并不依赖于ERR与雌激素受体的结合,而是通过单体或同源二聚体的形式直接结合于下游基因的雌激素响应元件(estrogen responsive element,ERE)或雌激素相关受体响应元件(EERE)上,从而调控这些基因的转录,但ERR的功能却可被雌激素浓度依赖性地调节,雌激素的添加可显著增强ERR的活性及其生理作用[12],暗示了ERR在雌激素信号途径中发挥着重要作用。然而目前,ERR在动物体内发挥的生物学功能及其信号途径仍未阐明,有关其在软体动物中的生殖调控作用及其机制则知之甚少。
本研究首次在2种头足类动物:曼氏无针乌贼(Sepiellajaponica)和白斑乌贼(Sepialatimanus)中克隆得到了ERR全长序列,比较分析了其在2种乌贼不同组织的表达特性,探究了其在不同性腺发育时期的表达谱,并与其他软体动物中的ERR基因研究相比较,为探究ERR在软体动物头足类中的生殖调控功能及其作用机制积累资料,同时也为软体动物头足类的人工繁育和健康养殖提供理论参考。
1 材料与方法
1.1 实验材料
用于ERR基因克隆、组织特异性表达研究的曼氏无针乌贼和白斑乌贼为2016年3月取自广东省湛江硇洲岛自然海域的繁殖亲体,曼氏无针乌贼体重约为100~150 g,白斑乌贼约为800~1 200 g,经活体解剖,取脑、肝脏、鳃、肌肉和卵巢等组织,液氮保存备用。用于不同性成熟阶段ERR表达检测的样品分别于2016年1月、3月和5月取自硇洲岛海域。南海海域的曼氏无针乌贼和白斑乌贼于每年秋季性腺开始发育,到次年的2~3月进入繁殖季节[13-14],因此,实验分别选取1月份(性腺已经发育但尚未完全成熟)、3月份(繁殖期,性腺已完全成熟)和5月份(产卵已经结束,为性腺耗散期)的乌贼,取卵巢组织,液氮保存备用,用于考察不同发育时期ERR的表达特性。
1.2 实验方法
1.2.1ERR基因的克隆
取乌贼肝脏组织,采用Trizol RNA提取试剂盒(Invitrogen,Carlsbad,USA),参照说明书的方法进行RNA的提取。RNA经Nanodrop ND-2000(Thermo electron corporation, USA)分光光度计定量和琼脂糖检测后,用DNase I (Invitrogen, Carlsbad, CA, USA)去处多余的DNA,纯化的RNA用反转录试剂盒(Invitrogen, USA)反转录为cDNA第一链后,以此cDNA为模板,以课题组构建的曼氏无针乌贼转录组中注释的ERR序列设计引物(表1),扩增2种乌贼的ERR核心片断。PCR扩增采用25 μL反应体系,内含100 ng模板cDNA、1×buffer、2.0 mmol/L MgCl2、0.2 μmol/L各种引物、0.2 mmol/L dNTPs和4.0 U的TaqDNA聚合酶 (Promega, USA)。PCR反应条件为:94 ℃预变性5 min,94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸30 s,35个循环,最后72 ℃延伸10 min。PCR产物链接到pGEM-T载体(Promega, USA)后,送至上海生工公司双向测序。采用3′RACE 和 5′RACE扩增的方法获得ERR的全长序列,其基本过程如下:根据已获得ERR核心片断设计3′RACE上游引物和5′RACE下游引物(表1),以SMARTTMRACE试剂盒(Clontech, Palo Alto, CA, USA)反转录合成的cDNA第一链为模板,用3′RACE和5′RACE引物与SMARTTMRACE试剂盒自带的通用引物配对,并参照试剂盒说明书进行ERR基因3′和5′端序列的扩增。所有的PCR扩增产物链接到pGEM-T载体(Promega, USA)后,送至生工生物工程(上海)股份有限公司进行双向测序。
1.2.2 序列特征与系统进化
将获得的2种乌贼ERR全长序列与GeneBank中的ERR基因序列进行BLAST比对,分析其同源性;采用cNLS Mapper软件(http://nls-mapper.iab.keio.ac.jp/cgi-bin/NLS_Mapper_form.cgi)分析核定位序列。采用SMART软件(http://smart.emblheidelberg.de/)预测ER的保守结构域。采用Clustal W程序进行ERR基因的同源比对,采用Mega 3.1软件采用neighbor-joining法进行系统树的构建,并采用bootstrap重复抽样1 000次检验聚类树各分支置信度。
1.2.3ERR基因的组织特异性表达研究
采用qRT-PCR法定量分析ERR在2种乌贼不同组织中得表达情况。从性成熟的乌贼脑、肝脏、鳃、肌肉和卵巢等组织中提取总RNA,采用DNase I去处多余的DNA,纯化的RNA用反转录试剂盒制备cDNA模板。以β-actin基因为内参,采用SYBR PrimeScriptTMRT(Perfect Real Time)(TaKaRa, Kusatsu, Japan)试剂盒进行ERR基因的实时定量扩增,所用引物见表1。PCR扩增采用20 μL反应体系,内含10 μL的SYBR荧光染料预混extaq酶(TaKaRa),100 ng 第一链cDNA,0.2 μmol/L双向引物。扩增反应条件为94 ℃预变性5 min,94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸30 s,40个循环,最后72 ℃延伸10 min。荧光定量PCR数据分析采用相对2-ΔΔCt法计算,每种组织基因表达量以5个样本的均值来确定,随机选择一个组织设定其基因表达量为100%,其他组织的表达量则以相对于该组织的相对表达量为计,采用SPSS17.0统计软件比较分析ERR在每种组织中的表达差异,检验时先进行表1EER基因克隆和表达试验中所使用引物的方差齐性分析,方差齐性则运用 LSD 法进行单因素方差多重比较,方差非齐性则采用Tamhane’ T2法进行单因素方差分析,然后进行Duncan氏多重比较各实验组间差异的显著性,P<0.05定义为有显著性差异。

表1 EER基因克隆和表达试验中所使用的引物Tab.1 Primers of theEERgene in cloning and expression analysis
1.2.4ERR基因发育时期的表达特性分析
为检测不同性腺发育时期的乌贼ERR基因在性腺的表达情况,分别选取1月、3月和5月的卵巢组织,参照如上方法进行RNA提取、cDNA链反转录和qRT-PCR扩增,分析不同性成熟阶段乌贼卵巢ERR基因的表达情况,同样采用SPSS17.0统计软件比较分析ERR在不同发育时期中的表达差异。
2 结果与分析
2.1 2种乌贼ERR基因cDNA的特征
采用5′和3′RACE技术获得了曼氏无针乌贼和白斑乌贼的ERR基因的全序列,分别长1 513 bp(Gene Bank号:MG518633)和1 547 bp(Gene Bank号:MH508243),包含一个长片段的开放阅读框ORF(SjEERaa1-339;SlEERaa 1-351),一个小片段的5′-UTR(SjEER12 bp;SlEER127 bp),一个小片段的3′-UTR(SjEER109 bp;SlEER109 bp)(图1)。结构域分析表明,2种乌贼的开放阅读框都可检测到典型的ERR基因家族结构域,分别包含N端的A/B结构域,DNA结合C结构域(DBD),连接D结构域,配体结合E结构域(LBD)(图2)。核定位信号序列预测表明,2种乌贼的C~E结构域中均存在2个核定位信号序列(NLS)(图2),呈现出其核受体的基本特征。氨基酸序列比较表明,曼氏无针乌贼、白斑乌贼的ERR与同为头足类的双斑蛸(Octopusbimaculoides)的ERR同源性最高,分别达95%和85%,其次是虾夷扇贝(Mizuhopectenyessoensis),同源性分别达69%和67%。2种乌贼ERR的相似性较高,可达99%,而2种乌贼与脊椎动物的同源性相对较差。不同物种ERR不同,结构域的保守性也相去甚远,其中A/B、D结构域,不同物种差异较大,C(DBD)、E(LBD)结构域则相对保守,但相对而言,C(DBD)结构域的保守型更高,2种乌贼与虾夷扇贝C(DBD)结构域的相似性分别高达95%和92%。这可能是因为在雌激素受体ER中LBD是配体结合结构域,依靠其独特的构型与雌激素E2结合而启动雌激素信号通路,强大的选择压力使该结构域异常保守[6]。
然而,由于ERR是孤儿受体,其行使功能时并不依靠LBD结构域与E2的结合,因此ERR中的LBD结构域因配体结合功能的丧失已出现了较多的变异(图2)。而ERR中的DBD结构域则是一个功能性结构域,在ERR信号通路中,其掌控ERR与DNA的结合,从而启动特定基因的转录,即ERR可在无E2结合的状态下以单体或者同源二聚体的形式与目标调控基因上的ERE或ERRE(ERRresponsive element)位点结合,从而起到调控转录的目的[15],该功能性的DBD结构域可能因受到了强大的选择压力而显得比LBD更加保守(图2)。

图1 2种乌贼核苷酸ERR基因cDNA全序列带下划线的ATG为启动子, TGA(*)为终止子。Fig.1 The full length cDNA sequences of the ERR from S. jaopinca and S. latimanusThe underlined ATG shows the position of the start codon and TGA(*) shows position of the stop codon.
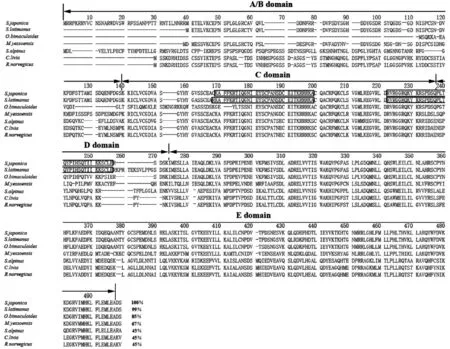
图2 2种乌贼与其他动物ERR氨基酸序列比对图Fig.2 Alignment of deduced ERR amino acid sequences from S. japonica and S. latimanus with other animal speciesInformation of gene accession:曼氏无针乌贼S.japonica(MG518633); 白斑乌贼S.latimanus(MH508243); 双斑蛸O.bimaculoides(XP_014789866.1); 虾夷扇贝M.yessoensis(XP_021379968.1);红点鲑S.alpinus(XP_023830199.1); 鸽C.livia(PKK24791.1);褐家鼠R.norvegicus(AAQ90023.1).
图3 基于NJ的ERR氨基酸序列构建的系统聚类图Fig.3 Phylogenetic tree based on ERR amino acid sequences by neighbor-joining methodInformation of gene accession:鸡Gallus gallus ERRγ(NM_001007081.1);鸽Columba livia ERRγ(XM_005510041.3);人Homo sapiens ERRγ(AB362218.1);褐家鼠Rattus norvegicus ERRγ(AY341057.1);斑马鱼Danio rerio ERRγ(AY556397.1);红点鲑Salvelinus alpinus ERRγ(XM_023974431.1); 猪Sus scrofa ERRβ(KP717448.1);人Homo sapiens ERRβ(BC131517.1);大黄鱼Larimichthys crocea ERRβ(XM_027274496.1);底鱂Fundulusheteroclitus ERRβ(DQ241377.1);青鳉Oryziaslatipes ERRα(XM_011483687.3);斑马鱼Danio rerio ERRα(AY556395.1);人Homo sapiens ERRα(NM_004451.5);猪Sus scrofa ERRα(NM_001170521.1);曼氏无针乌贼Sepiella japonica ERR(MG518633);白斑乌贼Sepia latimanus ERR(MH508243);双斑蛸Octopus bimaculoides ERRγ(NW_014776465.1); 苹果螺Marisa cornuarietis ERR(DQ923065.1);紫贻贝Mytilus edulis ERR(AB257133.2);太平洋牡蛎Crassostrea gigas ERRγ(AB259818.1); 美洲牡蛎Crassostrea virginica ERRγ(XM_022473131.1).
NJ系统树构建表明,在现有动物中主要存在3种ERR亚型,分别为ERRα、ERRβ和ERRγ。脊椎动物中3种亚型的ERR都存在,而在无脊椎动物中仅发现一种类型的ERRγ。本研究尽管采用多种兼并引物,但仅扩增得到了1种ERR,该结果与本课题组在乌贼转录组文库中注释到仅1种ERR的结果相一致[16],在其他软体动物中,至今也仅发现了1种ERR基因,表明在头足类等软体动物中确实可能仅存在一种亚型的ERR。聚类分析表明,2种乌贼的ERR与软体动物ERRγ聚为一支,而与脊椎动物的其他亚型ERR分歧较大,因此认为本研究克隆得到的ERR可能为ERRγ亚型(图3)。
2.2 2 种乌贼ERR基因的组织特异性表达
采用qRT-PCR法分析了繁殖期2种乌贼脑、卵巢、鳃、肌肉和肝脏中ERR的特异性表达,结果表明,2种乌贼ERR基因在不同组织中表达谱相仿,所有组织中均检测到了ERR基因的表达,然而其在生殖相关组织中,如卵巢、脑和肝脏中的表达量明显高于其他组织,特别是卵巢中其表达量显著高于其他组织(P﹤0.05),为鳃、肌肉等非繁殖相关器官的30~40倍(图4)。在大鼠模型中,ERR也在大鼠生殖系统中大量表达,其表达从生殖细胞开始一直维持到性别的分化[11]。在昆虫中,ERR在拟黑多刺蚁(Polyrhachisvicina)[17]、黄脸油葫芦(Teleogryllusemma)等性腺中表达量较高[18]。在鱼类中,ERR在青鳉(O.latipes)和底鳉(F.heteroclitus)的脑和性腺中表达量最高[19-20],目前对ERR在软体动物中表达的相关研究较少,ERR在苹果螺(Marisacornuarietis)[21和贻贝(Mytilusedulis)[22]的生殖腺中大量表达,这些结果均说明ERR可能在软体动物的生殖发育和性成熟中发挥着重要的调控作用。
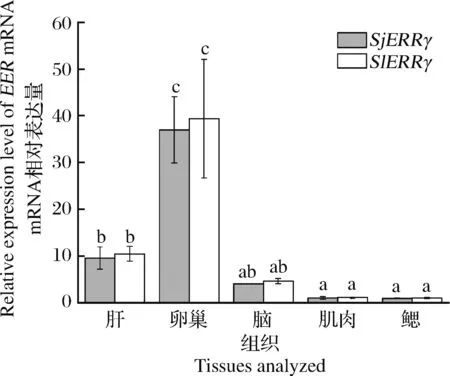
图4 2种乌贼ERR基因的组织特异性表达分析柱状图上不同字母代表有显著性差异(P<0.05)。下同。Fig.4 qRT-PCR analysis of SjEER and SlEERmRNA expression in different tissues of the female cuttlefishBars with different letters are significantly different (P<0.05).The same below.
2.3 不同性腺发育时期2种乌贼ERR基因的变化
由于ERR在2种乌贼卵巢中的表达量均最高,因此研究采用qRT-PCR法分析了不同繁殖阶段的2种乌贼卵巢中ERR的表达特征。结果表明,2种乌贼ERR的表达都随不同繁殖阶段而呈现出明显的波动:在1-3月随着性腺发育和繁殖季节的到来而显著升高(P<0.05);5月随着性腺耗散和繁殖季节的结束而显著降低(P<0.05)(图5)。ERR在性腺中的表达量随性腺发育时期的变化周期性的波动还见于黄脸油葫芦[18]和拟黑多刺蚁[23]中,在底鳉中ERR的表达受雌激素的显著调控[20],这些结果进一步表明ERR可能在乌贼性腺发育及生殖过程中起重要的调控作用。
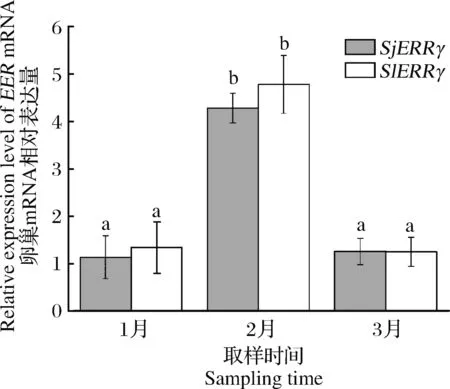
图5 2种乌贼ERR基因在不同发育时期的表达特性分析Fig.5 qRT-PCR analysis ofSjEERandSlEERmRNA expression in different season of the female cuttlefish
3 结论
本研究克隆得到的2种乌贼的雌激素相关受体ERR为典型的核受体基因,具NLS信号序列,具备典型的A/B、C、D和E 4个典型的雌激素受体结构域。该ERR受体为ERRγ亚型受体,与软体动物的ERRγ高度同源。2种乌贼ERR基因在脑、肝及卵巢等生殖相关器官中表达量最高,在卵巢中的表达量随性成熟时间的推进而呈现显著波动,表明其在乌贼生殖发育和性成熟过程中起着重要的调控作用。
