ROS1融合基因突变在非小细胞肺癌诊断与治疗中的研究进展*
2019-05-14江薇综述王懿娜审校
江薇 综述 王懿娜 审校
据研究统计,肿瘤居美国疾病死亡率第2位,美国癌症协会预测2018年仅肺癌新发患者将达到23.5万例,而死亡人数为15.5万例[1]。其中,晚期非小细胞肺癌是肺癌中最为常见的病理学类型,约占80%~85%[2]。对于肿瘤的治疗手段,从传统的放化疗,发展到分子靶向治疗、免疫治疗及联合治疗等。在靶向治疗中,EGFR突变、ALK重排、ROS1重排等基因的治疗方式均已比较成熟。其中,约有1%~2%的非小细胞肺癌(non-small cell lung cancer,NSCLC)患者携带ROS1基因重排[2]。美国每年新增约2 000至4 500例ROS1融合基因阳性的NSCLC患者[3]。本文就ROS1融合基因阳性NSCLC的最新研究进展进行综述。
1 ROS1融合基因的研究背景
ROS1 基因最初是于1986年在鸟肉瘤病毒(UR2)发现的具有独特致癌作用的基因序列[4],于2007年首次在NSCLC 中被发现[5],除了肺癌,也在卵巢癌、胃癌、大肠癌等恶性肿瘤中检测到ROS1 融合[6-8]。ROS1 属于胰岛素受体家族的一种单体型受体酪氨酸激酶。其在人类中的生物学作用尚未明确,仍然是一个“孤儿”受体酪氨酸激酶,尚未找到已知的配体[9]。人类的ROS1 基因定位于6q21 染色体[10],属于酪氨酸激酶胰岛素受体基因,由胞内酪氨酸激酶活性区、跨膜区及胞外区3 部分组成,编码具有酪氨酸激酶活性的嵌合蛋白[11]。ROS1基因发生重排时丢失细胞外区域,保留跨膜区和胞内酪氨酸激酶区域,重排位点主要发生在ROS1 基因的32~36 外显子。在NSCLC 中ROS1 基因主要与CD74、SLC34A发生融合[12],并持续激活ROS1酪氨酸激酶区及下游JAK/STAT、PI3K/AKT、RAS/MAPK 等信号通路[9],进而引起肿瘤的发生。
ROS1 重排的患者有以下几个临床特点:年龄偏小(中位年龄49.8 岁),女性,从未吸烟/轻吸烟者,亚裔,以及腺癌的组织病理学诊断[13]。一项回顾性分析表明ROS1重排的患者中位生存期(36.7个月)高于其他基因重排的肿瘤,如EGFR 突变和ALK 重排的NSCLC(分别为25.3个月和23.9个月)[14]。
2 ROS1融合基因的检测方法研究进展
ALK的基因检测主要通过4种不同的方法进行,分别是荧光原位杂交(fluorescencein situhybridization,FISH),免疫组织化学法(immunohistochemistry,IHC),聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR),及第二代测序技术(next-generation sequencing,NGS)[15]。与ALK 相比,ROS1 融合还没有正式被美国食品药品监督管理局(FDA)批准为辅助检测方法。由于ROS1 和ALK 在其ATP 结合位点中共享>80%的标志序列[16],因此通常借鉴ALK 的检测方法进行ROS1 基因检测。有临床试验显示克唑替尼对以FISH阳性为筛查入组条件的患者有效,因此该方法被认为是确定ROS1阳性的“金标准”,但由于FISH 荧光信号的快速消减及价格昂贵限制了其广泛应用[17]。与FISH 相比,IHC 具有高效、快速及价格低廉等优势,其敏感性和特异性可达90%以上。但由于肺泡Ⅱ型肺细胞和巨噬细胞,骨转移灶中破骨细胞均能表达ROS1[18],加上ROS1 的染色模式可能因ROS1 融合的细胞内定位不同而有所不同[19],因而IHC会出现一定比例的假阳性。RTPCR技术在实验室中应用更为广泛,其敏感性和特异性均较好,但由于ROS1 已知有14 个融合基因,且要从FFPE小样本中获得高质量RNA的难度较大[18],所以临床应用较少。
NGS不仅可准确检测已知的基因,更能准确检测罕见突变及其他未知的变异。NGS 的另一优点是可以经血浆的基因分型获取,并可重复检验,与单纯组织活检相比检出率从20.5%提高至35.8%[20],且方便实时检测有无复发及转移。但NGS价格较贵且需较长检验周期,不同检测平台又存在各自的检验标准,降低了其检测的准确性。
荧光条形码标记单分子检测技术(nCounter platform,CP)是一种基于多重mRNA的检测方法,相对于其他检测手段,具有较高的特异性和灵敏度,且检测快速、价格低廉[21],可用于包括ROS1 在内的多种基因检测,3个工作日内即可完成[22-23](表1)。
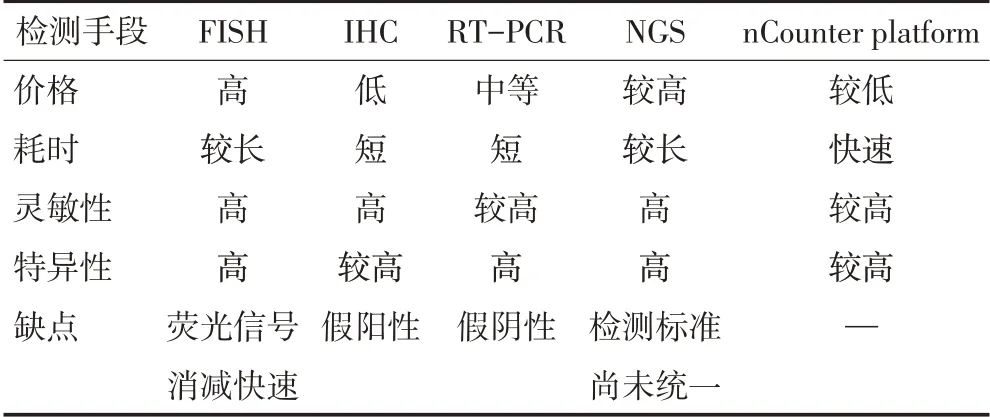
表1 ROS1融合基因检测方法优缺点比较
3 ROS1抑制剂的研究进展
由于ALK和ROS1的激酶结构域的相似性,研究者尝试将ALK抑制剂应用于ROS1重排患者的身上,结果表明除了艾乐替尼外,所有的ALK 抑制剂均能有效的控制ROS1融合患者的病情。
3.1 第一代ALK抑制剂—克唑替尼(crizotinib)
克唑替尼是一种针对ALK、MET及ROS1基因重排的酪氨酸激酶抑制剂。最初是作为MET抑制剂研发的[24],其后被批准用于ALK 融合患者的一线治疗。由于ALK 和ROS1 在激酶结构域有49%的氨基酸序列同源性,在三磷酸腺苷(ATP)结合位点上有77%的同源性,2014年Shaw 等[12]将ROS1 重排的NSCLC 患者纳入临床研究PROFILE 1001 的扩展队列,共50例NSCLC患者入组,其中有3例达到完全缓解,总体反应率(overall response rate,ORR)为72%,中位无疾病进展时间(median progression-free survival,mPFS)为19.2 个月。基于以上研究结果,克唑替尼被FDA 和欧洲药品管理局(EMA)批准治疗晚期ROS1-重排的NSCLC[25]。在欧洲的一项回顾性研究中,纳入32例符合条件的患者,ORR为80%,mPFS为9.1 个月[26]。OO-1201 是一项针对东亚ROS1 阳性晚期NSCLC患者的单臂Ⅱ期临床试验,入组的127例患者中,17 例完全缓解,ORR 为71.7%,mPFS 为15.9 个月[27]。目前还有多项Ⅱ期临床试验正在进行中。
克唑替尼相关不良反应主要为腹泻(56%)、恶心(55.3%)、呕吐(43.9%)、便秘(37.1%)和疲劳(21.7%)。ALT 和AST 异常发生率也较高(21%),而间质性肺炎发生率为2.4%[28]。
3.2 第二代ALK抑制剂-色瑞替尼(brigatinib)
色瑞替尼是一种针对ALK、ROS1 基因重排的靶向药物。在韩国一项Ⅱ期临床试验中,共招募32 例ROS1 阳性的患者(平均接受过3 种其他方式的治疗)。其中2例经过克唑替尼治疗的患者在服用药物后未见明显疗效,说明色瑞替尼可能对克唑替尼耐药患者无明显疗效。排除这2 例患者后,其他30 例患者的ORR为67%,疾病控制率(disease control rate,DCR)为87%,mPFS为19.3个月。研究中有8例脑转移患者,颅内ORR为25%,颅内DCR为63%[29]。
在该Ⅱ期研究中,色瑞替尼相关不良反应主要为腹泻(78%)、恶心(59%)、厌食症(56%)和呕吐(53%)。与克唑替尼相比,不良反应更明显。但在ASCEND-8研究中,调整色瑞替尼的剂量750 mg/d至450 mg/d 后,15 个月无进展生存率升高,而不良反应减低[30]。
3.3 第二代ALK 抑制剂—布加替尼(brigatinib-AP26113)
布加替尼是一种针对ALK、ROS1 基因重排的靶向药物,同时也是EGFR 突变抑制剂[31]。2017年被FDA批准用于ALK阳性NSCLC患者的二线治疗。在体外,克唑替尼、色瑞替尼和布加替尼对Ba/F3 细胞的生长有明显抑制作用,IC50分别是2.12 nmol/L,10.92 nmol/L和2.68 nmol/L[32]。
在一个关于ALK 阳性的Ⅲ期临床试验中,布加替尼相关不良反应主要是胃肠道症状、血肌酸激酶水平升高和丙氨酸转氨酶水平升高(>25%)。布加替尼组有61%的患者发生了3~5 级的不良事件,与克唑替尼组相比高11%[33]。
3.4 第三代ALK抑制剂-劳拉替尼(lorlatinib-3922)
劳拉替尼是针对ALK和ROS1的第三代酪氨酸激酶抑制剂。劳拉替尼拥有较高的中枢神经系统穿透能力,在标准剂量为100 mg的患者中,劳拉替尼的脑脊液与血浆比值为61%~96%[34]。在一项开放标签,单臂Ⅰ/Ⅱ期临床试验中第一阶段(NCT01970865)共纳入ROS1阳性NSCLC患者12例,6例(50%)部分缓解(PR),2例(17%)病情稳定(SD),ORR为50%,mPFS为7个月。值得关注的是,劳拉替尼的平均脑脊液浓度相当于未结合血浆浓度的75%,在该临床试验中共5例患者有颅内可测量病灶,3例有颅内的客观反应(60%)包括2例先前克唑替尼治疗无效的患者[35]。在该临床试验第二阶段,共纳入ROS1阳性NSCLC患者47例,结果尚未公布。另外,劳拉替尼对比克唑替尼一线治疗NSCLC Ⅲ期研究CROWN(NTC03052608)正在进行中。
劳拉替尼安全性能较好,相关不良反应主要是高胆固醇血症(72%),高甘油三酯血症(39%),水肿(39%)和周围神经病变(39%)[36]。
3.5 第四代ALK 抑制剂-洛普替尼(repotrectinib TPX-0005)
洛普替尼是新一代ROS1、TRK 和ALK 的酪氨酸激酶抑制剂。与临床上现有的同类抑制剂相比,洛普替尼的分子量更小,因此可以更好地穿透血脑屏障。在细胞实验中,与克唑替尼、恩曲替尼、色瑞替尼、布加替尼及卡博替尼相比,洛普替尼拥有对野生型ROS1 重排更强的活性,并且对产生G2032R 耐药突变的细胞株上,洛普替尼和卡博替尼活性相近(1.3vs.0.2 nmol/L),明显高于劳拉替尼(160.7 nmol/L),同样对于D2033N突变,洛普替尼活性略低于卡博替尼(1.3vs.0.2 nmol/L),但强于劳拉替尼(3.3 nmol/L)[37]。目前,关于洛普替尼在有ALK/ROS1/NTRK1-3 重排的实体肿瘤作用的一项Ⅰ/Ⅱ期临床试验(NCT-03093116)正在进行中。
洛普替尼的不良反应目前尚不明确,有研究表明1例服用该药物的患者耐受性较好,仅出现不良反应(AE)1级的共济失调、偏瘫和恶心等不适,并经药物治疗后有所缓解[37]。
3.6 卡博替尼(cabozantinib XL184)
卡博替尼是一种具有抗ROS1、MET、VEGFR 2、Axl和RET等的酪氨酸激酶抑制剂。除了肺癌,其在甲状腺髓样癌、晚期肾细胞癌和肝细胞均有一定疗效[32]。卡博替尼是野生型ROS1 激酶的一种有效抑制剂。另外,在服用克唑替尼后产生L2026M 和G2032R 耐药突变的患者中,卡博替尼也表现出较强的治疗效果[38]。在一项临床研究中,通过挑选携带G2032R耐药基因表达CD74-ROS1的MGH047细胞,卡博替尼很好抑制该细胞生长[32]。目前,一项关于卡博替尼的针对RET/ROS1/NTRK融合或MET/Axl扩增第二阶段的试验正在进行中,以更加明确卡博替尼对ROS1重排的疗效(NCT 01639508)[39]。
卡博替尼不良反应较明显,相关不良反应达AE3/4 级的是疲劳(13%)、掌跖发红(10%)、腹泻(7%)、高血压(7%)和乏力(5%)[40]。
3.7 恩曲替尼(entrectinib RXDX-101)
恩曲替尼是一种强效的小分子酪氨酸激酶抑制剂,可抑制ROS1、NTRK 和ALK 的致癌重排。截至2017年9月,32例未接触过靶向治疗的ROS1融合阳性肺癌患者入组Alka-372-001、STARTRK-1 和STARTRK-2 的临床试验,25 例患者有反应,ORR 为78%,mPFS 29.6个月。除此之外,恩曲替尼表现出较强的中枢神经系统(CNS)活性,6 例颅脑转移患者中有5例(ORR 83.3%)有治疗反应[41]。然而,恩曲替尼对最常见的ROS1 耐药突变,包括守门突变L2026M,G2032R和D2033N突变,没有显示出活性[42]。
恩曲替尼不良反应较轻,在该Ⅱ期临床试验中,相关不良反应主要是疲劳(46%)、体位障碍(42%)、胸闷(29%)、恶心(28%)和肌萎缩(23%)。仅1 例患者在双倍剂量下发生一起AE 4级的嗜酸粒细胞性心肌炎,停药后恢复[43]。
3.8 DS-6051b
DS-6051b 是一种小分子酪氨酸激酶抑制剂,可抑制ROS1、NTRK的致癌重排。在一项日本关于DS-6051b的Ⅰ期临床试验(NCT02675491),共招募15例ROS1 阳性的NSCLC 患者,其中12 例有可测量病灶,ORR为66.7%,DCR为100.0%。4例患者先前接受了克唑替尼治疗,1 例PR,2 例SD,但由于样本容量较小,不能充分说明DS-6051b 对克唑替尼耐药的患者有明确的疗效[44]。同时,美国目前也正在进行一项Ⅰ期临床试验(NCT 02279433)。
上述临床试验中,DS-6051b 相关不良反应主要是肝酶升高(80%),腹泻,恶心与便秘发生率也较高,但都是AE2级或以下[44]。
4 ROS1抑制剂的耐药机制
靶向治疗的发展对于肿瘤患者来说,降低了治疗痛苦,提高了生存质量,延长了生存时间。但是,在用药一定时间后,耐药基因的出现将导致靶向药物失效,疾病进展。
4.1 克唑替尼(crizotinib)的耐药机制
4.1.1 ALK 激酶抑制剂 获得性耐药是由多种机制引起如激酶区突变和基因拷贝数的扩增,以及旁路信号的激活[45]。参考ALK的机制,ROS1的激酶催化结构域突变是对ROS1 重排NSCLC 最常见的耐药机制(约占50%~60%)。在一项研究中,共收纳39 例ROS1 重排患者,其中16 例患者进行耐药检测,耐药突变率为62.5%(10/16)。ROS1 突变包括:G2032R(41%)、D2033N(6%)和S1986F(6%)[46]。G2032R 突变位于ATP 结合位点的前沿区域,类似于ALK 中的G1202R,该突变首次在1例ROS1重排NSCLC女性患者中被发现[47]。它的出现加速了细胞集落形成和侵袭的进程,并通过增加Twist 1(一种转录因子)[48]的表达而诱导上皮间充质转换[49],其能增强肿瘤细胞的侵袭和转移能力,而且还能使肿瘤细胞具有类似干细胞的能力[50]。D2033N 也是相同区域的突变,类似于ALK 中的D1203N,而D2033N 会导致ATP 结合邻位残基与克唑替尼发生相互作用,造成D2033和克唑替尼之间失去关键的静电相互作用[51]。而S1986F是通过影响富甘氨酸环在α-C螺旋末端的位置来产生影响[52]。还有L2026M 和L1951R 等突变,产生耐药机制尚不明确。
4.1.2 旁路通路激活 由于克唑替尼的使用,ROS1通路由于信号无法向下游传导,肿瘤细胞即可激活其他致癌驱动程序及其信号通路来代替,即ROS1通路占优势的耐药,而出现EGFR突变、KRAS突变、KIT扩增、ErbB、MET 扩增等其他通路[53],目前该说法尚未明确,仅有几例个案,亟待临床去证实。
4.1.3 肿瘤的异质性 NSCLC 是基因及细胞异质性最强的肿瘤之一,其突变基因的多样性及基因拷贝扩增数的不同致使患者对克唑替尼有不同的敏感性,而同一肿瘤的不同亚群对药物的敏感程度也不尽相同,现今的基因检测由于技术及标本量的限制尚不足以完全测出肿瘤组织的全貌。
4.1.4 自噬现象的存在 自噬细胞是对功能失调的蛋白质和细胞器的降解,是一种代谢补偿[54]。大量的研究表明,自噬既能促进细胞存活,亦能诱导细胞程序性死亡。Han 等[55]发现EGFR 抑制剂可以在野生型EGFR 的耐药NSCLC 中通过抑制PI3K/AKT/mTOR信号通路提高自噬水平,而在耐药细胞中加入自噬抑制剂后药物的细胞毒性作用得到明显增强。克唑替尼也具有促使肿瘤细胞自噬作用发生的能力,当克唑替尼和自噬抑制剂同时使用也可以增强肿瘤生长的抑制效果。因此,自噬作用可能导致克唑替尼耐药的产生。
5 结语
随肿瘤患病人数逐年增加,NCCN指南建议对已经失去手术机会转移的NSCLC 病例先行基因检测,包括EGFR,ALK,ROS1 及KRAS 等基因。自首次报告NSCLC的ROS1重排已经过去了十余年,虽然不断有新药研发,且正在进行众多临床试验,但截至目前为止,克唑替尼仍是FDA 和EMA 批准治疗ROS1 重排NSCLC 患者的唯一药物。关于如何选择一线药物,仍有较大争议。一方面,在细胞实验中,克唑替尼对于野生型的ROS1重排Ba/F3 cells活性显著低于洛普替尼、卡博替尼和劳拉替尼[37]。同时,由于ROS1重排的患者OS 较长,疾病发展的进程中,易转移至CNS,而劳拉替尼,洛普替尼和恩曲替尼由于分子量较小,入脑浓度较克唑替尼更高,能更好的控制CNS的转移或者进展。另一方面,克唑替尼的耐药机制相对其他药物较明确,在患者耐药后,可以根据情况选择序贯药物治疗,但如一线就采用其他药物,后续用药的缺乏可能导致最终的OS低于一线使用克唑替尼的患者。所以,用药究竟该如何选择,期待更多的临床试验给予答案。
除研发更强效的ROS1抑制剂之外,是否可以在患者能耐受的情况下,进行靶向药物与免疫治疗联合,在迄今最大的亚洲分析NSCLC 组中,发现14 例ROS1 重排患者,其中5 例(35.7%)提示PD-L1 高表达[56]。在一项PDL-1表达与癌基因驱动突变状态的相关性研究中,共纳入196 例NSCLC 患者,包括3 例ROS1重排阳性,其中2例PD-L1表达>50%,另1例也有50%的表达[57]。2018年ASCO 会议上,一项纳入527 例携带驱动基因变异并接受过免疫检查点抑制剂治疗的Ⅳ期NSCLC 患者回顾性多中心研究中,共有5 例ROS1 重排的患者,ORR 为20%。上述研究说明ROS1重排患者可能存在PD-L1高表达,靶向药物与免疫治疗联合也许能够取得一定的疗效,期待相关临床试验的数据报道和更新。
