117例胃神经内分泌肿瘤的临床病理特征和预后分析*
2019-05-14王超张靖宜张振霞孙琳郭玉虹邵兵赵帅孙燕
王超 张靖宜 张振霞 孙琳 郭玉虹 邵兵 赵帅 孙燕
神经内分泌肿瘤(neuroendocrine neoplasm,NEN)是一组起源于肽能神经元和神经内分泌细胞的异质性肿瘤,以消化系统最多见。消化系统肿瘤世界卫生组织(WHO)分类(2010年版)对消化系统NEN进行了新分类,但在实践中遇到了一些新问题。胃NEN在消化系统NEN中所占的比例及其临床病理特征在国内外患者中存在差异。另外,不同部位的NEN具有不同的特点,而目前国内单独研究胃NEN的报道较少。因此,本研究收集并复核了117例胃NEN的临床病理资料和随访数据,依据WHO分类进行细致分析,旨在探讨中国胃NEN患者的临床病理特征及其与复发生存相关的因素。
1 材料与方法
1.1 病例资料
回顾性分析2011年3月至2017年12月在天津医科大学肿瘤医院手术或胃镜切除的胃NET病例,并收集患者的临床病理及随访数据(随访时间从疾病确诊之日截至2018年6月)。
1.2 方法
1.2.1 诊断及分类 全部病例经2位病理医师复核,依据消化系统肿瘤WHO分类(2010年版)[1],将NEN分为神经内分泌瘤(neuroendocrine tumor,NET)G1、NET G2、神经内分泌癌(neuroendocrine carcinoma,NEC)和混合性腺神经内分泌癌(mixed adenoneuroendocrine carcinoma,MANEC)。
1.2.2 免疫组织化学法 每例肿瘤组织经福尔马林固定和石蜡包埋,均进行突触素(synaptophysin,Syn)、嗜铬素A(chromogranin A,CgA)、Ki-67免疫组织化学染色。当Syn或CgA表达不佳时,加染CD56;并根据鉴别诊断的需要,补充其他相应指标的免疫组织化学染色。所有石蜡标本制成4 μm切片后常规脱蜡,枸橼酸钠抗原修复,加入3%过氧化氢封闭10 min,按照说明书常规进行免疫组织化学染色检测。
1.3 统计学分析
应用SPSS 20.0软件进行统计学分析。计量资料以表示,组间比较使用t检验;计数资料组间比较使用Pearsonχ2检验或连续校正法或Fisher确切概率法;单因素生存分析采用Kaplan-Meier法,多因素生存分析采用Cox回归。以P<0.05为差异具有统计学意义。
2 结果
2.1 胃NEN患者的分类及基本情况
经2位病理医师复核后,最终纳入117例胃NEN,包括13例(11.1%)NET G1、6例(5.1%)NET G2、57例(48.7%)NEC和41例(35.1%)MANEC。全部病例的临床病理特征见表1。
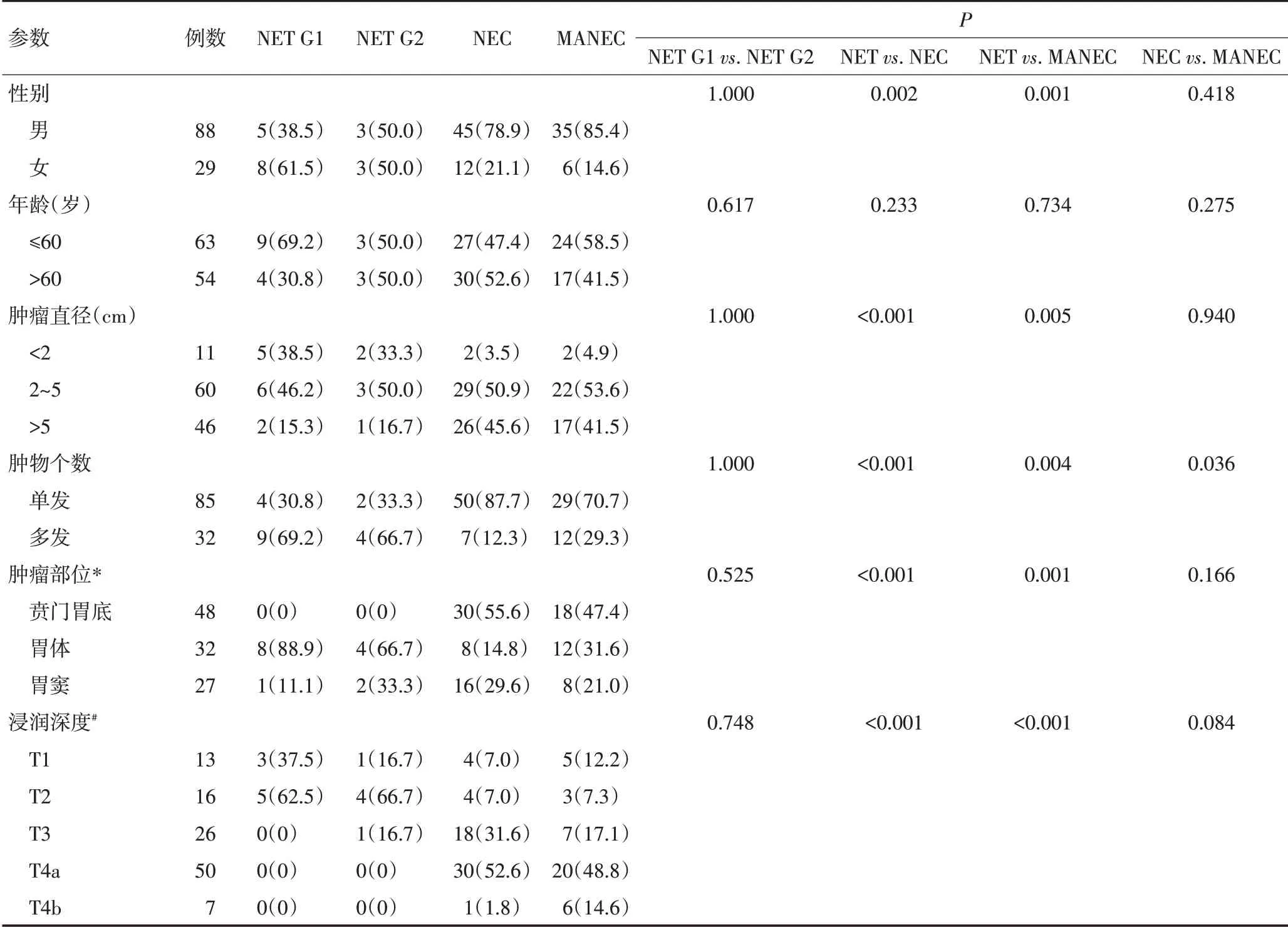
表1 117例胃NEN的WHO 2010分类及其临床病理特征 n(%)
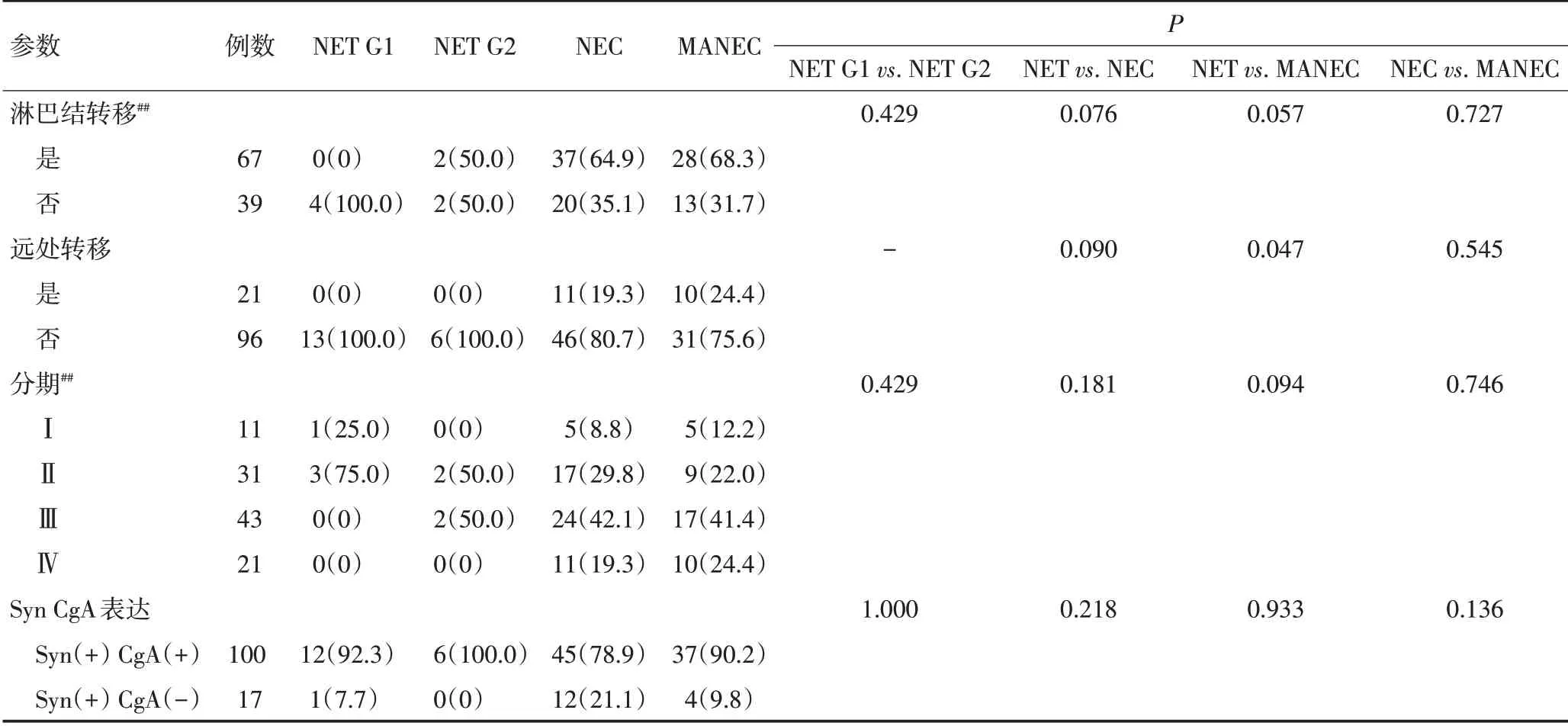
表1 117例胃NEN的WHO 2010分类及其临床病理特征 n(%)(续表1)
全部病例的随访时间为1~87个月,平均32.3个月。截至随访结束,53 例(45.3%)复发或转移;44 例(37.6%)死亡,均为肿瘤相关性死亡。无进展生存期(progression-free survival,PFS)为1~86 个月,中位PFS为14.0个月。总体生存期(overall survival,OS)为1~87 个月,中位OS 为24.0 个月。单因素生存分析显示,WHO(2010年版)分类与胃NEN 的PFS(P=0.019,图1A)和OS(P=0.010,图1B)显著相关。
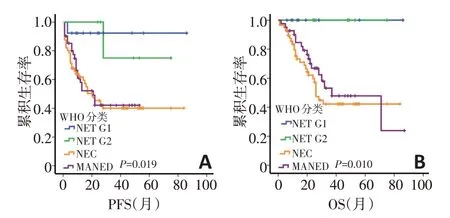
图1 117例胃NEN的WHO 2010版分类与患者生存的关系
2.2 胃NET G1/G2患者的临床病理特征和预后分析
19 例患者中经免疫组织化学法证实,13 例为NET G1(图2A~C,表1)。Syn、CgA 的阳性表达率分别为100%(13/13)和92.3%(12/13)。12例(92.3%)伴随神经内分泌细胞线性增生、微结节性增生、腺瘤性增生、异型增生等NET前驱病变(图2D~E)。7例经胃镜黏膜下剥离术(endoscopic submucosal dissection,ESD)切除,6 例经开腹手术切除,4 例进行淋巴结清扫。根据美国癌症联合委员会(AJCC)TNM 分期第8版标准[2],4例经淋巴结清扫的病例中,1例为Ⅰ期、3例为Ⅱ期。1例胃体多发NET G1伴发胃体浆膜下极低危险度间质瘤。截至随访结束,随访时间6~86个月,1例出现肝转移,全部病例未死亡。
6 例被证实为NET G2(图2F~H,表1)。Syn、CgA 的阳性表达率均为100%(6/6)。3 例(50.0%)伴随NET 的前驱病变。5 例经开腹手术切除,1 例经腹腔镜手术切除,4例行淋巴结清扫,其中2例均有淋巴结转移(图2I),同时行术后化疗。4例经淋巴结清扫的病例中2例为Ⅱ期、2例为Ⅲ期。截至随访结束,随访时间24~75个月,1例NET G2出现复发,全部病例未死亡。
NET G1 和G2 在性别构成、确诊年龄、原发肿物的数量、大小和部位、TNM分期、Syn和CgA表达水平等无显著性差异(表1)。
2.3 胃NEC患者的临床病理特征和预后分析
57例胃NEC的临床病理信息见表1。其中,大细胞型52 例(91.2%,图3A~D),小细胞型5 例(8.8%,图3E~H),小细胞型的Ki-67 指数更高(P=0.016)。Syn、CgA的阳性表达率分别为100%(57/57)和78.9%(45/57),但两个指标均存在部分表达或弱表达(图3B~C,F~G)。在57 例胃NEC 中,49 例(86.0%)分化较差,8 例(14.0%)分化较好,分化较差NEC 的Ki-67 指数更高(P<0.001);分化较好的病例中,6 例Ki-67≤55%,根据Milione 等[3]的报道,归为高增殖活性NET G3(图3I~L)。另外,有37 例(64.9%)和11 例(19.3%)分别可见脉管瘤栓和神经侵犯。根据AJCC TNM分期第8版标准,37例(64.9%)有淋巴结转移,5例(8.8%)、17 例(29.8%)、24 例(42.1%)、11 例(19.3%)分别为Ⅰ、Ⅱ、Ⅲ、Ⅳ期。
患者全部行手术切除,其中19例同时行腹腔热灌注化疗,3例Ⅳ期患者同时行肝转移病灶切除。11例Ⅳ期患者中,4例行术前新辅助治疗,全部病例均行术后辅助治疗,以顺铂联合依托泊苷方案(EP)为主。
随访时间为1~84个月。30例(52.6%)出现复发或转移,转移部位为肝、肺、腹腔、Virchow 淋巴结和骨,中位PFS 为12.0 个月。单因素生存分析显示,肿物多发(P<0.001)、小细胞型(P=0.005)、发现远处转移(P<0.001)和诊断时为进展期(P<0.001)与较差的PFS 有关(图4A~D),胃NEC 的分化程度(P=0.877)和Ki-67 指数(以55%为界值,P=0.647;以平均数68.8%为界值,P=0.829)与PFS 无相关。对单因素分析有意义的指标进行Cox回归分析,结果显示远处转移(P<0.001,HR=6.844,95%CI:2.898~16.160)是提示胃NEC PFS 较差的独立预后因素。至随访结束,27 例(47.4%)死亡,中位OS 为20.0 个月。单因素生存分析显示,肿物多发(P<0.001)、小细胞型(P=0.012)、发现远处转移(P<0.001)、诊断时为进展期(P=0.001)以及随访期间复发或转移(P<0.001)与较差的OS 有关(图4E~I),胃NEC 的分化程度(P=0.759)和Ki-67指数(以55%为界值,P=0.613;以平均数68.8%为界值,P=0.680)与OS 无相关。对单因素分析有意义的指标进行Cox回归分析,随访期间复发或转移(P<0.001,HR=17.893,95%CI:4.176~76.668)是提示胃NEC OS较差的独立预后因素。
2.4 胃MANEC患者的临床病理特征和预后分析
41例胃MANEC的临床病理信息见表1。有研究报道,将MANEC分为“碰撞型”(collision type,即两种成分相邻但不混合)和“组合型”(combined type,即两种成分相互交叉混合)[4-5]。Lewin[6]提出MANEC 具有“组合型”、“碰撞型”和“双泌型”(amphicrine type,即肿瘤细胞分泌黏液的同时表达神经内分泌标记物)3种亚型。本组病例中,13例(31.7%)为“碰撞型”(图5A~C),18例(43.9%)为“组合型”(图5D~F),10例(24.4%)为“双泌型”(图5G~I)。神经内分泌成分包括39 例大细胞型、2 例小细胞型;腺癌(adenocarcinoma,AC)成分包括高、中、低分化腺癌、黏液腺癌及印戒细胞癌;还有1例包含大细胞型NEC、高-中分化腺癌、鳞癌3 种成分。神经内分泌成分中,Syn、CgA的阳性表达率分别为100%(41/41)和90.2%(37/41),但两个指标均存在部分表达或弱表达。另外,13 例(31.7%)和14例(34.1%)分别查见脉管瘤栓和神经侵犯,28例(68.3%)检测到淋巴结转移。在有淋巴结转移的28例MANEC中,8例、12例和8例的转移成分分别是单纯的腺癌、单纯的NEC 及两种成分均有转移。5 例(12.2%)、9 例(21.9%)、17 例(41.5%)、10 例(24.4%)分别为Ⅰ、Ⅱ、Ⅲ、Ⅳ期。
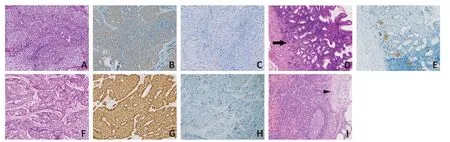
图2 胃NET G1/G2的典型组织病理学图像
患者全部行手术切除,其中16 例同时行腹腔热灌注化疗,2 例Ⅳ期患者同时行肝脏转移病灶切除术。10例Ⅳ期患者中,2例行术前新辅助治疗,8例行术后化疗,2 例行术后同步放化疗,化疗方案以顺铂联合依托泊苷(EP)方案为主。另外,部分MANEC病例还伴发其他肿瘤:1例胃底MANEC伴发胃窦腺癌,1例贲门胃底MANEC伴发胃壁极低危险度间质瘤,2例MANEC伴发小肠极低危险度间质瘤。
随访时间为6~87 个月,21 例(51.2%)出现复发或转移,转移部位为肝、腹腔、骨、肺和脑。中位PFS为12.0 个月。单因素生存分析显示,肿物直径>5 cm(P=0.038)、发现淋巴结转移(P=0.004)、发现远处转移(P<0.001)、诊断时即为进展期(P=0.001)、“组合型”和“碰撞型”肿瘤(P=0.039)与较差的PFS相关(图6A~E)。对单因素分析有意义的指标进行Cox 回归分析,结果显示淋巴结转移(P=0.023,HR=4.258,95%CI:1.222~14.844)和远处转移(P=0.002,HR=4.307,95%CI:1.680~11.045)提示胃MANEC PFS 较差的独立预后因素。至随访结束,17 例(41.5%)死亡,中位OS 为23.0 个月。单因素生存分析显示,发现淋巴结转移(P=0.004)、发现远处转移(P=0.034)、诊断时即为进展期(P=0.027)、“组合型”和“碰撞型”肿瘤(P=0.024)、淋巴结两种成分均有转移(P=0.001)、随访期间出现转移或复发(P=0.001)与较差的OS 有关(图6F~K)。对单因素分析有意义的指标进行Cox 回归分析,结果显示淋巴结转移(P=0.021,HR=5.885,95%CI:1.300~26.636)是提示胃MANEC OS 较差的独立预后因素。
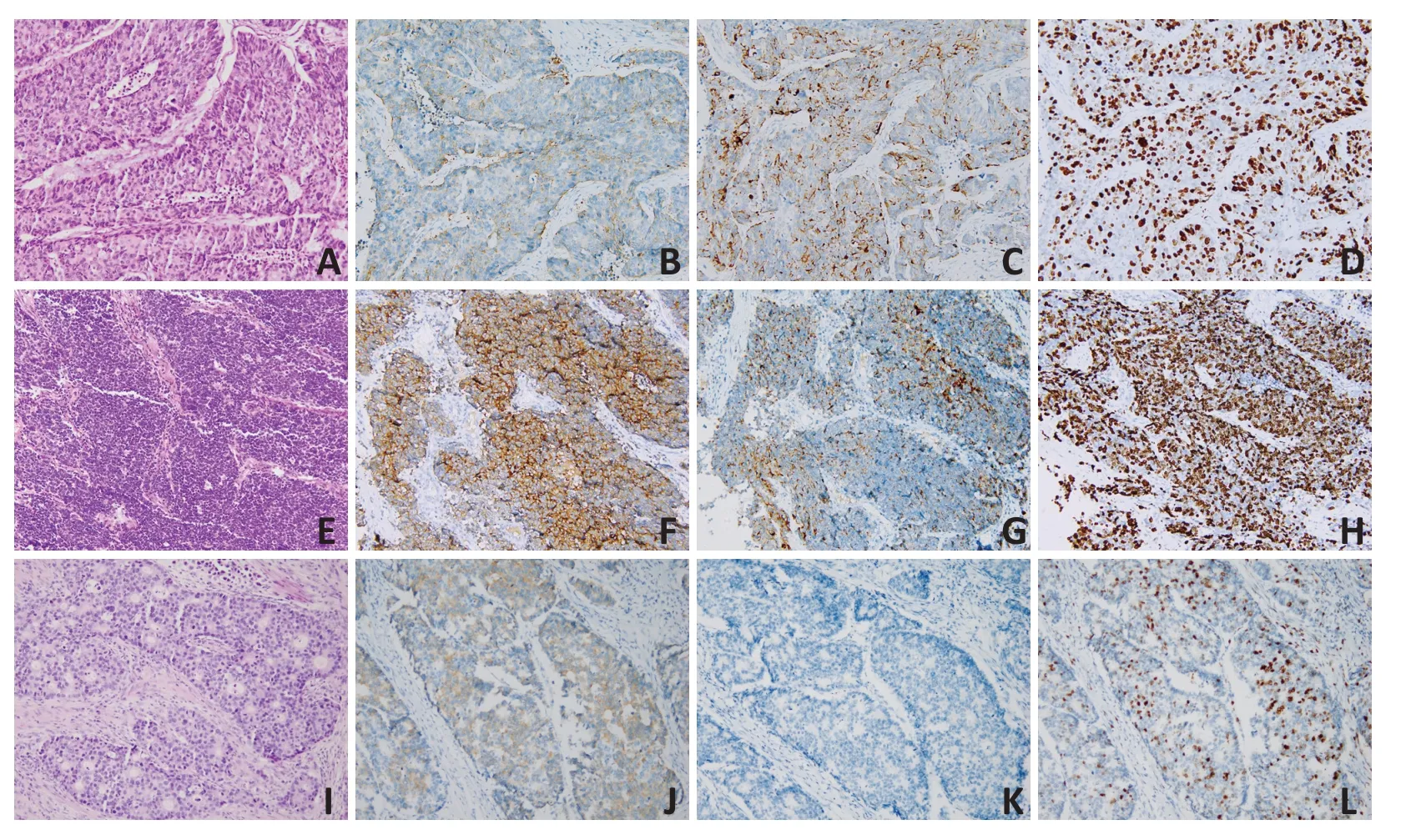
图3 胃NEC的典型组织病理学图像
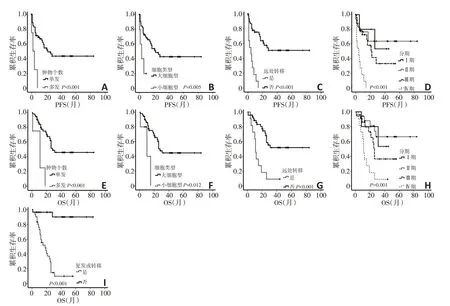
图4 57例胃NEC患者的单因素生存分析
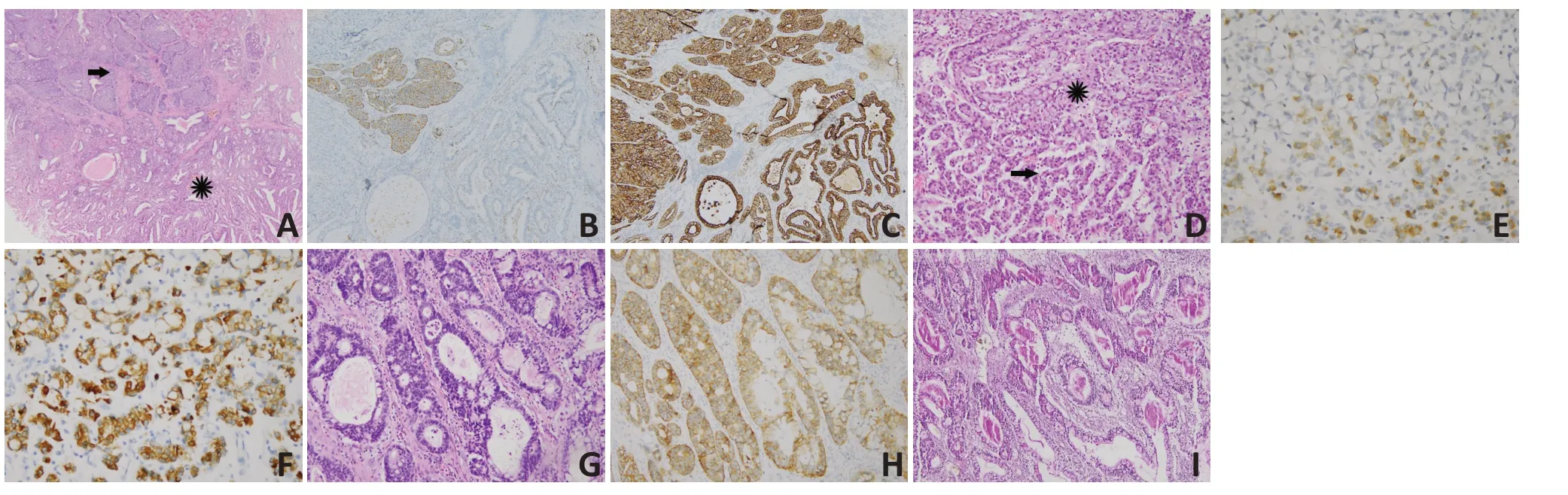
图5 胃MANEC的典型组织病理学图像

图6 41例胃MANEC患者的单因素生存分析
3 讨论
随着胃镜检查的普及、对NEN 认识的不断深入以及分子标记物检测技术的提升,胃NEN 的发病率和确诊率逐年提高[7]。国外文献报道消化系统NEN的好发部位依次是小肠、结直肠和胰腺[8],胃部的报道较少;而在国内病例报道中,胃是消化系统NEN的好发部位之一,仅次于胰腺和结直肠[9-10]。本课题组前期研究结果显示,不同部位的消化系统NEN 在临床病理特征和生存预后方面具有不同的特点[9]。因此,本研究拟通过对确诊的117 例胃NEN 的系统分析,进一步探索胃NEN 的临床病理特征及与生存预后密切相关的因素。
本研究依据WHO(2010年版)分类标准将胃NEN进行分类,结果显示以恶性程度高的NEC/MANEC为主,可能与本研究中心为肿瘤专科医院、收治的患者多考虑恶性肿瘤有关。本研究表明,WHO 分类与胃NEN 的PFS 和OS 均显著相关,与相关研究的结果一致[11-13],肯定了WHO 2010版NEN分类在评价患者病情和评估预后中的价值。进一步分析显示,不同WHO 分类的NEN 显示了差异性的病理学特征,NET G1/G2 虽然多数为多发肿物,但是肿物直径小,浸润深度浅,淋巴结转移和远处转移少见,确诊时分期较早;而NEC 和MANEC 以单发肿物为主,肿物直径大,浸润深度深,淋巴结转移和远处转移多见,确诊时多为进展期。因此,不同的病理学特征导致不同的生物学行为和预后,进而决定了不同的治疗方式。
本研究中,胃NET G1/G2的治疗方式包括ESD和根治性切除。但是,NET G1和G2在临床病理特征与患者预后均无显著性差异,一方面可能与病例数少有关,另一方面WHO 分类可能需要进一步完善。本研究中,NEC和MANEC全部行手术切除,5例Ⅳ期患者同时行肝脏转移病灶切除。目前,虽然缺乏大宗晚期NEN 病例治疗相关的随机对照研究,但有报道[14-15]强调即使确诊时已经发现远处转移,手术切除对于提高胃NEC/MANEC 患者无病生存和总体预后的仍具有一定意义。Galleberg 等[16]报道Ki-67<55%及经术后辅助化疗的胃肠胰NEC患者仍能受益于肝脏转移病灶切除或射频消融术。另外,本研究中,6例Ⅳ期NEC/MANEC患者行术前新辅助治疗,且全部Ⅳ期病例均行术后辅助治疗。本研究认为晚期NEN患者的治疗方案仍需进一步探讨,而多学科会诊和综合治疗的模式将发挥更大的作用。
本研究中,大多数胃NET G1/G2 包含NET 的前驱病变,而在NEC 和MANEC 中未见到,提示胃NET的发病机制可能与NEC、MANEC不同。Rindi等[17]提出将肠嗜铬样(enterochromaffin-like,ECL)细胞胃NET 分为3 种亚型,后来逐渐形成四型胃NEN,即Ⅰ型血清胃泌素增高伴胃酸分泌减少、Ⅱ型血清胃泌素增高伴胃酸分泌增多、Ⅲ型血清胃泌素和胃酸分泌都正常以及Ⅳ型低分化胃神经内分泌癌(病理分型为NEC G3 和MANEC)。本研究患者缺乏血清胃泌素及胃酸数据,未能进一步分型。张盼等[18]通过对241例胃NEN分析,结果显示Ⅰ型和Ⅱ型总体预后较好,Ⅲ型预后较差,Ⅳ型预后最差,提示临床分型也会影响胃NEN 患者的预后,临床医生需要进行相关检测。
本研究中,胃NEC 以男性、中老年为主,好发于贲门胃底,脉管瘤栓的比例高,与Xie等[14]、Deng等[19]和Liu等[15]的报道一致。Xie等[14]和Deng等[19]报道胃NEC以大细胞型为主;而Liu等[15]报道以小细胞型为主,并且Ki-67 均超过60%,但是未分析细胞亚型与患者生存的关系。本组胃NEC以大细胞型和分化程度差的NEC 为主,并且小细胞型患者的PFS 和OS 更差。有报道称在即将出版的WHO 新消化系统NEN分类中,会将原来的NEC 分为高增殖活性的NET G3和分化差的NEC[20],这是在考虑肿瘤细胞增殖的基础上同时考虑肿瘤分化,但是目前仅在胰腺NEN 中进行NET G3和NEC的区分[21]。本研究中,诊断时即为进展期NEC 的患者PFS 和OS 均较差,并且随访期间复发或转移是提示较差OS 的独立预后因素,与Deng等[19]结果一致。
本研究中胃MANEC 患者以男性为主,肿物多位于贲门胃底,以T4为主,脉管瘤栓和神经侵犯比例较高,虽然全部MANEC 患者行手术切除,大部分病例行辅助治疗,但患者的预后极差,与既往报道一致[4-5,22]。与NEC 相比,MANEC 的预后更差,并且影响两者PFS和OS的因素不同。淋巴结转移和远处转移是提示胃MANEC PFS 较差的独立预后因素,淋巴结转移提示胃MANEC OS 较差的独立预后因素。在WHO(2010年版)中,MANEC的定义为具有典型的腺癌和神经内分泌成分,且每种成分占30%以上,但未进行细致的分型。以往有报道将MANEC 分为碰撞型和组合型,生存分析显示预后较好胃MANEC 的病理特征包括“组合型”、AC成分为主型和无淋巴结转移[4-5,22]。Lewin[6]提出关于MANEC 组成形式的3 种亚型,即“组合型”、“碰撞型”和“双泌型”。本研究中,“双泌型”肿瘤的PFS和OS均优于“组合型”和“碰撞型”。目前关于胃MANEC 的分子研究较少。有研究认为两种成分起源于同一种多潜能干细胞[23],继而出现异质的腺癌分化以及后续的神经内分泌分化,或继而发生两个平行的、各自不同的分化方向。也有研究认为两种成分起源于不同的潜能干细胞[24],腺癌成分起源于多潜能干细胞,神经内分泌成分起源于胚胎神经嵴细胞或亲银细胞。因此,对胃MANEC不同类型及其发生发展机制的研究将有助于MANEC的精准治疗以及评估患者的生存预后。
本研究采用WHO(2010年版)和AJCC(第8 版)分期对胃NEN进行分析,但是这种分类、分期方法在肿瘤个体化诊治方面仍有局限。Kim等[13]报道AJCC分期在NEC G3 和MANEC 的预后评估有较高的价值。La Rosa 等[25]结果显示,综合运用组织学特点、WHO分类和欧洲神经内分泌肿瘤协会(ENETS)分期可以提高对患者预后的判断价值。
综上所述,目前的分类、分期方法在实际应用中仍存在一些问题和争议,需要多中心大样本的病例研究完善。另外,不同类别胃NEN 的发生发展机制仍需要进一步研究,以期指导临床治疗和预后评估。
